Revisão
Colestase da gravidez: revisão de literatura
Obstetric cholestasis: review of the literature
Francisco Edson de Lucena Feitosa1
Débora Silva Melo2
Munique Martins Monteiro2
Ana Cecília Lopes Mota2
Cristiane Maria Cavalcante Silveira2
Carlos Augusto Alencar Junior3
Palavras-chave
Gravidez
Colestase
Ácido ursodesoxicólico
Colestase intra-hépatica
Keywords
Pregnancy
Cholestasis
Ursodeoxycholic acid
Intrahepatic cholestasis
Resumo
Colestase da gravidez (CG) é uma doença hepática específica da gravidez
que tipicamente ocorre a partir do final do segundo trimestre. É uma doença de etiologia heterogênea
(multifatorial) com contribuição de fatores genéticos e hormonais, caracterizada por prurido generalizado
intenso e alterações das provas de função hepática, estando associada ao aumento das taxas de morbidade e
mortalidade fetal. A revisão de literatura realizada refere-se à epidemiologia, etiologia, manifestações clínicas,
achados laboratoriais e o manejo da CG na qual se conclui que o conhecimento por parte dos profissionais sobre
a doença é fundamental para que seja realizado um manejo adequado das gestantes, visando principalmente
prevenir complicações fetais. Apesar do número significativo de estudos relacionados com a CG, vários aspectos
da sua etiologia e patogênese não foram elucidados. O diagnóstico é feito por meio de achados clínicos e das
alterações das provas de função hepática e aumento dos níveis de ácidos biliares. O ácido ursodesoxicólico é
a droga atualmente utilizada na terapêutica da CG com eficácia no controle do prurido e no restabelecimento
de níveis normais dos ácidos biliares. Porém, há necessidade da condução de pesquisas e ensaios clínicos para
a melhor condução desta doença.
Abstract
Obstetric cholestasis (OC) it is a specific hepatic pathology of the pregnancy
that typically happens in the end of the second trimester. It is a heterogeneous etiology (multifactorial) disease
with contribution from genetic and hormonal factors, characterized by intense itch and abnormal liver function
tests, being associated to the increase of perinatal morbidity and mortality. The revision of accomplished literature
refers to the epidemiology, etiology, clinical manifestations, laboratory findings and of which management
OC concludes that knowledge by professionals about the disease is the key to an appropriate management,
undertaken by pregnant women, seeking mainly to prevent fetal complications. In spite of the significant number
of studies related with OC, several aspects of its etiology and pathogenesis were not elucidated. The diagnosis
is made through the clinical discoveries and abnormal liver function tests and increase of the levels of bile acids.
The ursodeoxycholic acid is now the drug used in the therapeutics of OC with effectiveness in the control of the
itch and in the re-establishment of normal levels of the bile acids. However, new research and clinical trials are
required for best conduction of this pathology.
Coordenador da residência em Tocoginecologia da Maternidade-Escola Assis Chateaubriand da Universidade Federal do Ceará (UFC) – Fortaleza
(CE), Brasil
Acadêmicos da Faculdade de Medicina da UFC – Fortaleza (CE), Brasil
3
Coordenador da Clínica Obstétrica da Maternidade-Escola Assis Chateaubriand da UFC – Fortaleza (CE), Brasil
1
2
Feitosa FEL, Melo DS, Monteiro MM, Mota ACL, Silveira CMC, Alencar Junior CAA
Introdução
Colestase da gravidez (CG) também conhecida como colestase
intra-hepática da gravidez, é uma doença hepática específica da
gestação que tipicamente ocorre a partir do final do segundo
trimestre.1 Trata-se de uma condição multifatorial, de causa
desconhecida, embora estudos mostrem que há influência de
fatores ambientais e genéticos.2,3,4 Caracteriza-se por prurido generalizado intenso e por alterações das provas de função hepática,
ambos remitindo após o parto e sem causa definida.2 A doença
pode apresentar algumas repercussões maternas,5 porém está
mais associada ao aumento das taxas de morbidade e mortalidade
fetal e, também com o aumento do risco perinatal como morte
intrauterina, sofrimento fetal e parto prematuro.3,6
Epidemiologia
A CG tem sido diagnosticada em quase todos os grupos
étnicos e apresentando uma distribuição geográfica irregular.3,6
É significativamente mais comum em populações do sul da Ásia
(0,8 a 1,46%) e da América do Sul (9,2 a 15,6%) e incomum
entre os europeus (0,1 a 0,2%) com alta incidência identificada
nos países escandinavos. Na América do Sul é muito comum,
com altas taxas de incidência observadas no Chile (16%),
particularmente entre os índios Araucanios (28%) e Bolívia
(9%); taxas de apenas 0,1 a 0,5% têm sido descritas na Europa
e América do Norte, com algumas áreas com elevadas incidências na Escandinávia e Países Bálticos (1 a 2%).7 No Brasil não
foram encontrados registros de dados epidemiológicos quanto
à prevalência da CG.
A CG tende a crescer dentro de certas famílias e sob influência genética, mas o preciso comportamento genético permanece
obscuro. Ocorre mais frequentemente em mulheres com idade
acima de 35 anos, com gestações múltiplas e naquelas com
histórico de CG em gestações prévias. A taxa de recorrência
da CG varia entre 40 e 60% das gestações com uma grande
variação na intensidade da doença nas gestações subsequentes
e em “random fashion”.1,3,8
Etiologia e patogênese
A etiologia da CG é heterogênea (multifatorial) com contribuição de fatores genéticos e hormonais.3
Fatores genéticos exercem uma função importante pelo menos
em registros de alta prevalência, podendo explicar a agregação
familiar nas sucessivas gerações nessas regiões, por exemplo,
na Escandinávia e no Chile.1 Apesar da procura de um defeito
204
FEMINA | Abril 2009 | vol 37 | nº 4
genético específico não ter sido bem sucedido, nos últimos
anos diferentes grupos de pesquisa têm observado mutações de
genes responsáveis pela codificação de proteínas envolvidas no
transporte biliar.3 Mutações das bombas de exportação de fosfolipídios (MDR3, ABCB4) nas bombas de aminofosfolipídios
(ATP8B1), e na bomba de exportação de sais biliares (BESB,
ABCB11) foram encontradas em pacientes que desenvolveram
CG.5,9,10,11 Recentemente as formas graves da doença também
foram associadas à variante do gene ABCB4.5
Várias informações sobre a evidência do papel dos hormônios
sexuais sugerem que o estrógeno tem um efeito na patogênese
da CG. A participação do estrogênio na patogênese da CG é
sustentada por várias linhas de evidência. Primeiro, a doença
surge no terceiro trimestre de gestação, época em que a produção
de estrogênio atinge seu máximo. Além disso, a prevalência de
CG é cinco vezes maior em gestações gemelares as quais são
caracterizadas por altos níveis de estrógenos do que em gestação
única. Segundo, a CG assemelha-se ao quadro de colestase desenvolvido em algumas mulheres que fizeram uso de contraceptivos
com altas doses de estrogênio. Terceiro, a administração de
derivados de estrogênio em experimentos com animais é capaz
de induzir colestase, que se mostra relacionada à expressão e/ou
função dos transportadores específicos de proteínas tais como: o
cotransportador de Na+/ taurocolato [Ntcp, S1c10a1], a bomba
de exportação de sais biliares (BESB, Abcb11) e a bomba de
exportações de múltiplos fármacos (Mrp2, Abcc2). Estes transportadores, dentre outros, são fundamentais para a produção de
fluxo biliar e da função excretora hepática.3
O papel da progesterona na patogênese da CG não está bem
elucidado. De acordo com Reyes e Sjövall11, mulheres com predisposição provavelmente têm um defeito seletivo na secreção
de metabólitos de progesterona sulfatada na bile e que isto pode
estar relacionado ao mau funcionamento dos transportadores da
membrana dos canalículos biliares, normalmente responsáveis
pelo transporte destes metabólitos dos hepatócitos para a bile.
Em estudo experimental com roedores, a administração de progesterona teve pouco efeito na secreção de bile, mas dados de
estudos in vitro sugerem que vários metabólitos de progesterona
foram capazes de induzir trans-inibição da bomba de exportação
de sais biliares (BESB), desempenhando consequentemente
uma função na patogênese na patogênese da CG.12 Observouse, também, que a administração de progesterona no início da
gravidez pode ser um dos fatores de risco para a CG.3
As variações geográficas e climáticas observadas nessa doença
sugerem o envolvimento de fatores ambientais na modulação
da expressão da CG em indivíduos geneticamente predispostos.
Além disso, vários fatores têm sido investigados incluindo o
Colestase da gravidez: revisão de literatura
selênio e ácidos graxos de cadeia longa, não havendo evidências
definitivas de suas participações na patogênese da CG.3
O fluxo de níveis elevados de ácidos biliares da mãe para o
feto e a inabilidade fetal de excretá-los tem sido relacionado a
alterações de contratilidade miometrial, sendo considerada a
principal explicação para ocorrência de parto prematuro.1,3,13
Enquanto que no sofrimento fetal e morte intrauterina, os
elevados índices de ácidos biliares causam constricção das veias
coriônicas com redução do fluxo sanguíneo feto-placentário e
consequente asfixia fetal; altos níveis de ácidos biliares também
estão relacionados ao prejuízo da função cardiomiócito fetal,
gerando arritmias.7,13,14
A etiologia do prurido é também desconhecida. Uma teoria
é que os ácidos biliares se depositam nos nervos terminais da
pele causando “coceira”; entretanto outra sugere que o acúmulo
de sais biliares nos hepatócitos causa a liberação de materiais
“pruridogênicos”.1
Manifestações clínicas
O prurido é a manifestação clássica e predominante dessa
doença, o qual surge caracteristicamente após 30 semanas de
gestação; geralmente inicia-se nas palmas das mãos e plantas dos
pés progredindo para o resto do corpo e, tipicamente, torna-se
mais intenso à noite.1,2 O aparecimento da icterícia é incomum,
sendo observado em cerca de 20% das pacientes pela elevação
de bilirrubina direta.1
Outros sintomas que podem estar presentes na CG são insônia,
fadiga, anorexia, mal-estar, esteatorreia devido à má absorção
de gorduras, desconforto epigástrico e colúria.15
Trata-se de um diagnóstico de exclusão. A resolução rápida
do prurido e a normalização dos marcadores de função hepática
após o parto são critérios necessários para o diagnóstico.1,2,3
Exames de screening para hepatite A, B e C; Epstein Barr e
citomegalovírus devem ser solicitados. Doenças autoimunes
como hepatite e cirrose biliar primária devem ser excluídas.
Pré-eclâmpsia e esteatose hepática da gravidez são causas de
alterações das provas de função hepática, fazendo parte do
diagnóstico diferencial e dos casos de apresentação atípica.2 É
necessário incluir no diagnóstico diferencial doenças dermatológicas como possíveis causas de prurido.
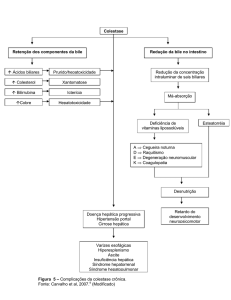
Achados laboratoriais
Alterações laboratoriais geralmente encontradas na CG
incluem níveis plasmáticos aumentados de transaminases
hepáticas, podendo atingir valores duas vezes superiores ao da
normalidade e o aumento dos níveis plasmáticos de ácidos biliares totais em jejum; sendo esse parâmetro considerado o mais
preditivo da doença, embora níveis normais de ácidos biliares
não a exclua.2,3,16-18
Observa-se uma ligeira elevação de gama-glutamil-transpeptidase (GGT) em menos de 30% dos casos. A fosfatase alcalina
(FA) pode estar elevada, trata-se de um marcador muito utilizado
em síndromes colestáticas; no entanto, durante a gravidez tornase menos confiável devido à produção placentária de FA.15
Walker, Piercy e Williamson16 consideram que os ácidos
biliares são marcadores sensíveis, mas não específicos para a CG.
Já Brites18 afirma que os marcadores de maior valor preditivo e
acurácia para diagnóstico e seguimento da CG são o aumento dos
níveis de ácido biliar total, aumento da porcentagem de acido
cólico e diminuição da relação glicina/taurina. Pode ocorrer atraso
na alteração das provas de função hepática em relação ao início dos
sintomas, portanto dosagens seriadas devem ser realizadas.1
Os níveis de ácidos biliares também têm sido utilizados para
definir gravidade. Considera-se CG grave quando os níveis séricos
maternos são superiores a 40 µmol/L, implicando em maiores
riscos fetais a partir destes níveis.5
Outros marcadores que poderão ser úteis no diagnóstico
da CG estão sendo pesquisados. Dann et al.19 observaram um
significativo aumento nos níveis de lipoproteína de baixa densidade (LDL) em mulheres com pruridus gravidarum e gestante
saudáveis (Grupo Controle).
Ambros-Rudolph et al.7 recomendam ultrassonografia do
abdome superior em pacientes com CG apresentando sintomas
abdominais para excluir colelitíase associada, não havendo necessidade de biópsia cutânea e hepática.
Tratamento
Embora não haja um consenso quanto ao manejo destas
pacientes no pré-natal, uma monitorização do bem-estar fetal
é uma conduta aceita pela maioria dos obstetras.3
Não estão claros quais parâmetros são mais preditivos
de morte intrauterina fetal.1 Entretanto, Fagan14 sugere um
protocolo que inclui cardiotocografia semanal, estimativa do
volume do líquido amniótico, Doppler da artéria umbilical e
acompanhamento regular do crescimento fetal, além da dosagem semanal de ácidos biliares, enzimas hepáticas e provas de
coagulação materna.
Os riscos fetais parecem aumentar progressivamente até a resolução da gestação, independentemente dos níveis de ácidos biliares
e enzimas hepáticas. Monitorização seriada desses marcadores é
essencial, mas não previne sofrimento fetal agudo e morte.1
FEMINA | Abril 2009 | vol 37 | nº 4
205
Feitosa FEL, Melo DS, Monteiro MM, Mota ACL, Silveira CMC, Alencar Junior CAA
Como a maioria das mortes fetais inexplicadas ocorre após
37 semanas de gestação, a resolução da gestação entre 37 a 38
semanas tem sido recomendada por vários autores.1,20 O parto
com cerca de 36 semanas ou menos deve ser considerado em
casos graves com icterícia, elevação progressiva de ácidos biliares
séricos e suspeita de sofrimento fetal.21 O prurido materno é o
principal sintoma a ser tratado. Repouso, sedação leve e dieta
pobre em gorduras, inclusive suplementação de vitamina K
(10 mg/dia) devem ser considerados no caso de fadiga, ansiedade
e má absorção de gorduras e vitaminas lipossolúveis apresentado
pela paciente.3,22
Recomenda-se a realização de exames de função hepática
no puerpério e se espera que estes se normalizem cerca de um
mês após o parto.14
Apesar de o estrogênio ter sido relacionado com a CG, o uso de
anticoncepcionais orais combinados (ACO) não é contraindicado
em mulheres com história prévia dessa condição. As pacientes
devem ser orientadas quanto aos riscos de prurido e aumento
das enzimas hepáticas com o uso de ACO.1
A terapia farmacológica atual consiste principalmente na administração de ácido ursodesoxicólico (UDCA), o qual tem sido
considerado o melhor fármaco disponível e tem eficácia comprovada
no alívio do prurido e normalização dos ácidos biliares.1,23
O UDCA aparentemente não apresenta efeitos adversos sobre
o feto. As pesquisas são insuficientes para se chegar a conclusões
quanto à teratogenicidade e a prevenção de efeitos adversos do
UDCA sobre o feto.1 Apesar de não existirem relatos sobre os
efeitos colaterais de UDCA é importante esclarecer à mãe que
esse fármaco não está licenciado para uso na gravidez.1
O UDCA recupera a capacidade placentária de excretar ácidos
biliares e promove um decréscimo significante na porcentagem de
acido cólico, elevação no ácido chenodeoxicólico e normalização
da relação glicina/taurina.1,20 Alguns autores consideram existir
algum efeito cardioprotetor no feto quanto à possíveis efeitos
tóxicos dos ácidos biliares.15 Outros fármacos são utilizados
como a colestiramina, S-adenosil-L-metionina e dexametasona;
no entanto, vários estudos têm mostrado que o UDCA é o mais
efetivo de todos eles.1,24 Um ensaio comparando o UDCA e a
colestiramina em 84 pacientes mostrou que o UDCA é mais
seguro e efetivo no tratamento da CG.24
Muitas pacientes relatam intolerância à colestiramina devido
ao sabor desagradável e à necessidade de doses frequentes, sendo
associada à constipação. Essa droga também potencializa a má
absorção de gorduras e vitaminas lipossolúveis, sendo essencial
a suplementação vitamínica.1
206
FEMINA | Abril 2009 | vol 37 | nº 4
A S-adenosil-L-metionina tem mostrado variável alívio do
prurido e redução da icterícia.1 O ensaio clínico randomizado,
realizado na Itália em 32 pacientes, apresentou superioridade
da combinação do UDCA com a S-adenosil-L-metionina com
relação ao uso de cada droga isoladamente para o alívio do prurido e normalização de parâmetros bioquímicos.1
Foi observado em outro ensaio clínico, envolvendo 46 pacientes, que o UDCA era mais efetivo que o S-adenosil-L-metionina
na redução dos ácidos biliares e na melhora das provas de função
hepática, enquanto que as duas terapias mostraram-se igualmente
efetivas no alívio do prurido.1
Saleh e Abdo20 afirmaram que o tratamento com altas doses
de dexametasona é efetivo na melhora dos sintomas e parâmetros
bioquímicos. Todavia, um recente ensaio clínico randomizado
comparando dexametasona e UDCA mostrou que a dexametasona não produziu alívio dos sintomas ou redução da alanina
aminotransferase (ALT) e foi menos efetiva que o UDCA na
redução de ácidos biliares e bilirrubina.1
Anti-histamínicos são usados frequentemente no tratamento
do prurido, seu efeito sedativo tem papel mais importante no
alívio deste sintoma do que sobre a produção de histamina, e
é benéfico em pacientes com episódios de exacerbação noturna
do prurido.1
Conclusões
O conhecimento por parte dos profissionais sobre a CG é
fundamental para que seja realizado um manejo adequado das
gestantes, pois apesar de se tratar de uma doença benigna para
a mãe, traz muitas complicações para o concepto.
Apesar do número significativo de estudos relacionados com
a CG, vários aspectos de sua etiologia e patogênese não foram
elucidados. Embora pareça existir uma combinação entre os
fatores genéticos e hormonais.
O diagnóstico dessa doença é feito em razão de suspeitas
clínicas e da presença de níveis anormais das provas de função
hepática e aumento dos níveis de ácidos biliares, após exclusão
de outras doenças relacionadas. Deve ser feito um controle dos
sintomas maternos e da monitorização fetal para identificação
precoce de sofrimento fetal.
O UDCA é a droga atualmente utilizada na terapêutica da
CG com eficácia no controle do prurido e no restabelecimento de
níveis normais e de ácido biliares. Há necessidade da condução
de pesquisas e ensaios clínicos para avaliar o tratamento atual
com UDCA e determinar sua maior efetividade e segurança.
Colestase da gravidez: revisão de literatura
Leituras suplementares
1.
Saleh MM, Abdo KR. Intrahepatic cholestasis of pregnancy: review of the
literature and evaluation of current evidence. J Womens Health (Larchmt).
2007;16(6):833-41.
2.
Royal College of Obstetricians and Gynaecologists. Obstetric cholestasis.
Guideline no. 43. 2006;(1):1-10.
3.
Arrese M, Reyes H. Intrahepatic cholestasis of pregnancy: a past and present
riddle. Ann Hepatol. 2006;5(3):202-5.
4.
O’Leary JG, Pratt DS. Cholestasis and cholestatic syndromes. Curr Opin
Gastroenterol. 2007;23(3):232-6.
5.
Wasmuth HE, Glantz A, Keppeler H, Simon E, Bartz C, Rath W, et al.
Intrahepatic cholestasis of pregnancy: the severe form is associated with
common variants of the hepatobiliary phospholipid transporter ABCB4 gene.
Gut. 2007;56(2):265-70.
6.
Kaaja RJ, Greer IA. Manifestations of chronic disease during pregnancy.
JAMA. 2005;294(21):2751-7.
7.
Ambros-Rudolph CM, Glatz M, Trauner M, Kerl H, Müllegger RR, et al. The
importance of serum bile acid level analysis and treatment with ursodeoxycholic
acid in intrahepatic cholestasis of pregnancy: a case series from central
Europe. Arch Dermatol. 2007;143(6):757-62.
8.
Painter JN, Savander M, Ropponen A, Nupponen N, Riikonen S, Ylikorkala
O, et al. Sequence variation in the ATP8B1 gene and intrahepatic cholestasis
of pregnancy. Eur J Hum Genet. 2005;13(4):435-9.
9.
Lang T, Haberl M, Jung D, Drescher A, Schlagenhaufer R, Keil A, et al. Genetic
variability, haplotype structures, and ethnic diversity of hepatic transporters
MDR3 (ABCB4) and bile salt export pump (ABCB11). Drug Metab Dispos.
2006;34(9):1582-99.
10. Pauli-Magnus C, Lang T, Meier Y, Zodan-Marin T, Jung D, Breymann C, et al.
Sequence analysis of bile salt export pump (ABCB11) and multidrug resistance
p-glycoprotein 3 (ABCB4, MDR3) in patients with intrahepatic cholestasis of
pregnancy. Pharmacogenetics. 2004;14(2):91-102.
11. Reyes H, Sjövall J. Bile acids and progesterone metabolites in intrahepatic
cholestasis of pregnancy. Ann Med. 2000;32(2):94-106.
12. Reyes H, Báez ME, González MC, Hernández I, Palma J, Ribalta J, et al. Selenium,
zinc and copper plasma levels in intrahepatic cholestasis of pregnancy, in normal
pregnancies and in healthy individuals, in Chile. J Hepatol. 2000;32(4):542-9.
13. Al Inizi S, Gupta R, Gale A. Fetal tachyarrhythmia with atrial flutter in obstetric
cholestasis. Int J Gynaecol Obstet. 2006;93(1):53-4.
14. Fagan EA. Disorders of liver, biliary system and pancrease. In: de Swiet M (Ed.)
Medical disorders in obstetric practice. London: Blackwell Science Ltd, 2002.
15. Tan LK. Obstetric cholestasis: current opinions and management. Ann Acad Med
Singapore. 2003;32(3):294-8.
16. Walker IA, Piercy CN, Williamson C. Role of bile acid measurement in pregnancy.
Ann Clin Biochem. 2002;39(Pt 2):105-13.
17. Milkiewicz P, Gallagher R, Chambers J, Eggington E, Weaver J, Elias E. Obstetric
cholestasis with elevated gamma glutamyl transpeptidase: incidence, presentation
and treatment. J Gastroenterol Hepatol. 2003;18(11):1283-6.
18. Brites D. Intrahepatic cholestasis of pregnancy: changes in maternal-fetal bile acid balance
and improvement by ursodeoxycholic acid. Ann Hepatol. 2002;1(1):20-8.
19. Dann AT, Kenyon AP, Wierzbicki AS, Seed PT, Shennan AH, Tribe RM. Plasma lipid
profiles of women with intrahepatic cholestasis of pregnancy. Obstet Gynecol.
2006;107(1):106-14.
20. Saleh M, Abdo K. Consensus on the management of obstetric cholestasis: National
UK survey. BJOG. 2007;114(1):99-103.
21. Roncaglia N, Arreghini A, Locatelli A, Bellini P, Andreotti C, Ghidini A. Obstetric
cholestasis: outcome with active management. Eur J Obstet Gynecol Reprod Biol.
2002;100(2):167-70.
22. Riely CA, Bacq Y. Intrahepatic cholestasis of pregnancy. Clin Liver Dis. 2004;8(1):16776.
23. Zapata R, Sandoval L, Palma J, Hernández I, Ribalta J, Reyes H, et al. Ursodeoxycholic
acid in the treatment of intrahepatic cholestasis of pregnancy. A 12-year experience.
Liver Int. 2005;25(3):548-54.
24. Kondrackiene J, Beuers U, Kupcinskas L. Efficacy and safety of ursodeoxycholic acid
versus cholestyramine in intrahepatic cholestasis of pregnancy. Gastroenterology.
2005;129(3):894-901.
FEMINA | Abril 2009 | vol 37 | nº 4
207
Exerce potente ação antioxidante,
na proteção da mama
1,2,3,4,6,14
Licopeno de Tomate
Exerce ações antioxidante
e antiproliferativa, sobre
as células mamárias
1,2,3,14
Vitaminas A e E
Auxiliam na prevenção da AFBM
4,14
Benefícios da Quimioprevenção
Nutricional com Licopeno:
Estudo caso-controle, em mulheres
saudáveis, acompanhadas por 9,5 anos,
observou relação inversa entre o Licopeno
sérico e o risco de doença da mama.
6
Apresentação: 30 cápsulas gelatinosas moles
Posologia: 1 cápsula ao dia
LICOXID® - Referências Bibliográficas: 1 - Agarwal, S. e Rao, A. V. – Tomato lycopene and its role in human health and chronic diseases. Canadian Medical Association Journal, 19: 163-169, 2000. 2 - Chalabi, N., Lê Corre, L., Maurizis, J., Bignon, Y. e
Bernard-Gallon, D. J. – The effects of lycopene on the proliferation of human breast cells and BRCA1 e BRCA2 gene expression. European Journal of Cancer, 40: 1768-1775, 2004. 3 - Fornelli, F., Leone, A., Verdesca, I., Minervini, F. E. e Zacheo, G. – The influence of lycopene on the proliferation of human breast cell line (MCF-7). Toxicology in Vitro, 21: 217-223, 2007. 4 - Fanini, R. A., Roseli, I. P. e Di Paolo, G. – L’uso delle vitamine A e E, con l’associazione di sostanze antiinflammatorie, nella terapia della displasia
mammaria. Minerva Ginecológica, 38(6):523-528, 1986. 5 - Rao, A. V. And Rao, L. G. – Lycopene. Advances in food and nutricion research. 51(06): 99-164, 2006. 6 - Dorgan, J. F. et al. – Relationships of serum carotenoids, retinol, alfa-tocopherol, and selenium
with breast câncer risk: results from a prospective study in Columbia, Missouri (United States). Cancer Causes and Control, 9: 89-97, 1998. 7 - Levi, F. et al. – Dietary intake of selected micronutrientes anda breast-cancer risk. Int. J. Cancer, 91: 260-263, 2001.
8 - Gaudet, M. M. Et al. – Fruits, Vegetables and Micronutrients in Relation to Breast Cancer Modified by Menopause and Hormone Receptor Status. Cancer Epidemiol Biomarkers Prev, 13(9): 1485-1494, 2004. 9 - Toniolo, P. Et al. – Serum Carotenoids and Breast Cancer.
Am. J. Epidemiol., 153(12): 1142-1147, 2001. 10 - Ching, S. et al – Serum Levels of Micronutrients, Antioxidants and Total Antioxidant Status Predict Risk of Breast Câncer in a Case Control Study. J. Nutr., 132(2): 303-306, 2002. 11 - Hultén, K. Et al. – Carotenoids, alphatocopherols, and retinol in plasma and breast cancer risk in northern Sweden. Cancer Causes and Control, 12: 529-537, 2001. 12 - Fibrocystic breast diseases. Disponível em: adam.sertaoggi.com.br/encyclopedia/ency/article/000912.htm. Acesso em: 30 de janeiro de
2008, 14:00. 13 - Quimioprevenção do câncer. Disponível em: www.fcf.usp.br/nutrição/Ensino/Graduação/Disciplinas/Exclusivo/Inserir/Anexos/LinkAne/nutrição e cancer pdf . Acesso em: 30/01/2008, 15:00h. 14 - Informações internas e extraídas do folheto interno do
produto Licoxid®. APRESENTAÇÃO: Cápsula Gelatinosa mole: Caixa contendo 30 cápsulas. USO ADULTO. INGREDIENTES: Suspensão de Licopeno (Ingrediente), Óleo de Girassol (veículo), Gelatina (excipiente da casca da cápsula), Glicerina (excipiente da casca
da cápsula), Gordura parcialmente hidrogenada (agente suspensor), Água destilada (excipiente da casca da cápsula), Vitamina E (ingrediente), Cera de abelha (agente suspensor), Lecitina de soja (emulsificante), Dióxido de titânio (opacificante), Vitamina A (ingrediente),
Corante vermelho ponceau (corante), Corante amarelo crepúsculo (corante). COMPOSIÇÃO: Cada cápsula gelatinosa mole contém: 5 mg de Licopeno. CUIDADOS NA ADMINISTRAÇÃO: Siga as orientações sugeridas, respeitando os horários e as doses recomendadas.
GESTANTES, NUTRIZES E CRIANÇAS SOMENTE DEVEM CONSUMIR ESTE PRODUTO SOB ORIENTAÇÃO DE NUTRICIONISTA OU MÉDICO. INFORMAÇÕES: LICOXID® é um alimento à base de Licopeno. O Licopeno tem ação antioxidante que protege as células
contra a ação dos radicais livres. Seu consumo deve estar associado a uma dieta equilibrada e hábitos de vida saudáveis. LICOXID® além de conter Licopeno em dose adequada, contém Vitamina A e Vitamina E em doses diárias recomendadas. USO: LICOXID® é
utilizado como antioxidante. MODO DE USO: 1 cápsula ao dia, preferencialmente junto com uma das refeições. M.S. nº 6.2913.0019.001-7. Fabricado e Embalado por: Bioativus Myralis Pharma Ltda. Rua Rogélia Galhardo Alonso, 650 - Aguaí - SP - Cep.: 13860-000.
SAC: 0800 771 2010. Indústria Brasileira. Para maiores informações, vide folheto interno do produto. CLASSIFICAÇÃO: ALIMENTO FUNCIONAL.