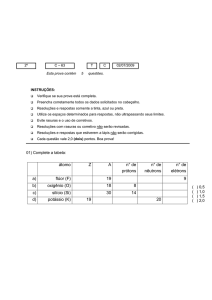
2016 – CURSO – TURMA DE MEDICINA – 1º ANO
QUÍMICA
Profs. Arthur e Jorge
1.
Relacione as características atômicas com os cientistas que as propuseram:
I. Dalton
II. Thomson
III. Rutherford
( ) Seu modelo atômico era semelhante a um “pudim de passas”.
( ) Seu modelo atômico era semelhante a uma bola de bilhar.
( ) Criou um modelo para o átomo semelhante ao “Sistema Solar”.
2.
Assinale a alternativa que completa melhor os espaços apresentados na frase abaixo:
“O modelo de Rutherford propõe que o átomo seria composto por um núcleo muito
pequeno e de carga elétrica ......, que seria equilibrado por ....…, de carga elétrica ...…, que ficavam
girando ao redor do núcleo, numa região periférica denominada .......”
a)
b)
c)
d)
e)
neutra, prótons, positiva e núcleo.
positiva, elétrons, positiva, eletrosfera.
negativa, prótons, negativa, eletrosfera.
positiva, elétrons, negativa, eletrosfera.
negativa, prótons, negativa, núcleo.
3.
O elétron foi descoberto por Thomson no fim do século XIX, o que lhe rendeu o prêmio Nobel. Uma
característica do modelo atômico proposto por ele é:
O átomo é indivisível.
Os elétrons ocupam orbitais com energias bem definidas.
O átomo sofre decaimento radioativo naturalmente.
O átomo é maciço e poderia ser associado a um “pudim de passas”.
a)
b)
c)
d)
4.
a)
b)
5.
O átomo é uma partícula esférica, maciça e indivisível. Tal afirmativa refere-se ao modelo atômico
proposto por:
Rutherford
c) Thomson
Dalton
d) Bohr
a)
b)
c)
d)
O modelo atômico proposto por Niels Bohr completou o modelo apresentado por Rutherford. Conforme o
modelo de Bohr, a proposição falsa é:
Ao elétron são permitidos certos estágios estacionários de energia.
Quando o elétron está em um desses estágios, não irradia nem absorve energia.
Quando passa de estágio de baixa energia para alta energia, emite energia.
Quando passa de um estágio de alta energia para baixa energia, emite energia luminosa.
6.
a)
b)
c)
d)
e)
Uma importante contribuição do modelo de Rutherford foi considerar o átomo constituído de:
elétrons mergulhados numa massa homogênea de carga positiva.
uma estrutura altamente compactada de prótons e elétrons.
um núcleo de massa desprezível comparada com a massa do elétron.
uma região central com carga negativa chamada núcleo.
um núcleo muito pequeno de carga positiva, cercada por elétrons.
7.
Rutherford, em seu clássico experimento, bombardeou uma delgada lâmina com partículas alfa. Nessa
experiência, ele demonstrou que:
todos os átomos dos elementos possuem elétrons;
o volume nuclear é muito pequeno em relação ao volume do átomo;
os elétrons tem carga elétrica negativa;
os elétrons giram em órbitas elípticas ao redor do núcleo;
a matéria é compacta e impenetrável.
a)
b)
c)
d)
e)
1
2016 – CURSO – TURMA DE MEDICINA – 1º ANO
8.
a)
b)
c)
d)
e)
Os raios catódicos são constituídos por:
elétrons
prótons
cátions
ânions
n.d.a.
9.
a)
Segundo o modelo de Thomson, o átomo
poderia ser caracterizado por uma esfera gelatinosa com carga positiva, na qual estariam incrustados os
elétrons, neutralizando a carga positiva.
não é maciço, mas é formado por um núcleo com carga positiva, no qual se concentra praticamente toda a
sua massa, e ao redor do qual ficam os elétrons, neutralizando a carga positiva.
é formado por elétrons que giram ao redor do núcleo em determinadas órbitas.
é neutro, cercado de elétrons que estariam dispostos ao redor do núcleo, como os planetas ao redor do Sol.
é formado por um pequeno núcleo maciço e positivo, e os elétrons movimentam-se em órbitas estacionárias,
sendo que nesse movimento não emitem energia.
b)
c)
d)
e)
10.
a)
b)
c)
d)
e)
No esquema a seguir, um elétron saltando de K para L deve
absorver uma energia E1;
absorver uma energia E2
absorver uma energia (E1 + E2);
absorver uma energia (E2 – E1);
devolver uma energia (E2 – E1).
1.
II, I, III
2.
D
3.
D
4.
B
5.
C
6.
E
7.
B
8.
A
9.
A
GABARITO
10. D
2