Actividade Avaliação – 1ºPeríodo
Professora: Dulce Campos
Agrupamento de Escolas Anselmo de Andrade
Química 10.º Ano - Ano Lectivo 10/11
Avaliação Diagnóstica
Duração da Actividade: 90 minutos
1. A lista que se segue diz respeito a materiais diversificados que se usam ou de que se ouve
falar na vida do quotidiano.
G. ferrugem
A. ácido acetilsalicílico, num
H. hemoglobina do sangue
comprimido de Aspirina®
I. tecido constituído por 30% viscose
B. B PS (poliestireno expandido) da
e 70% algodão
esferovite
J. dioxinas cannabis
C. Celofane (papel de...)
K. gasolina sem tetrametilchumbo
D. vitamina C
L. as proteínas do leite
E. Lulu de Cacharel® (perfume)
M. cloro na água de piscinas
F. CFC, destruidores da camada de
ozono
De entre todos os materiais destacados, seleccione:
1.1. os naturais e os sintéticos;
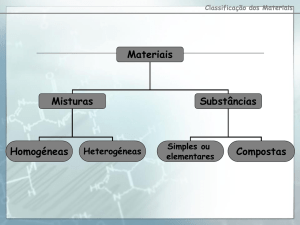
1.2. os que são misturas e os que são substâncias;
1.3. as substâncias compostas e as elementares.
2. No texto que a seguir se transcreve, encontram-se referências a diversos materiais, como
misturas e substâncias elementares e compostas, através do seu nome ou da sua fórmula
química:
"Os oceanos são fonte de vida do planeta. Às suas águas contêm suspensões de
areias finas e dissolvidos naturalmente gases como o dióxido de carbono, a
oxigénio e o azoto, e sais dissolvidos como o cloreto de sódio, o cloreto de
magnésio, KBr e Na2SO4. É possível, também, encontrar CaCO3, tanto dissolvido
como no estado sólido, formando as conchas e os esqueletos dos animais
marinhos.'Algumas das algas que nelas vivem possuem iodo (indispensável, por
exemplo, para o bom funcionamento da tiróide e 'algumas bactérias que
conseguem extrair enxofre dos minerais de sulfato de cálcio, que se acumula no
fundo das marés. Mas a poluição esse terrível flagelo, introduz nessas águas
outras substâncias que alteram todo este processo natural.
A partir do texto, preencha os rectângulos do diagrama na folha de resposta. Sempre que uma
substância estiver representada pelo nome, deverá fazer corresponder-lhe a sua fórmula
química, e vice-versa.
1
Actividade Avaliação – 1ºPeríodo
Professora: Dulce Campos
3. As representações simbólicas seguintes dizem respeito a alguns núcleos de elementos,
como as que se referem ao enxofre, oxigénio, fósforo, cloro, sódio e hidrogénio.
3.1. As frases seguintes podem ser verdadeiras ou, pelo contrário, traduzirem
incorrecções científicas e, portanto, serem falsas. Faça-lhes corresponder o símbolo V
ou F, explicando as razões da escolha efectuada.
A. O núcleo do átomo de fósforo representado é uma zona interior do átomo, onde
existem 46 partículas sub atómicas, das quais 31 são neutrões
B. Os átomos de cloro representados diferem entre si no número de protões.
C. O átomo de enxofre representado tem tantos protões como neutrões.
D. No núcleo do átomo de oxigénio representado, existem oito protões e oito
electrões.
E. Qualquer átomo de sódio tem 11 electrões que se movem numa zona exterior ao
núcleo.
F. Em todos os átomos, o número de protões tem de ser igual ao número de
electrões.
G. O átomo de hidrogénio representado tem 1 único neutrão.
3.2. Ainda a partir daquelas representações, escolha, em cada alínea, a hipótese correcta,
que deverá justificar:
3.2.1.Um dos iões que o elemento enxofre poderá originar é S2-. O número total de
electrões que esse ião possui é:
l-2
II-14
III-16
IV-18
V-8
3.2.2.Um ião, muito comum, formado por enxofre e oxigénio é o anião sulfato, SO42-. A
carga 2- deste ião significa que:
1. o número total de electrões excede, em dois, o número total de protões;
2. o número total de protões excede, em dois, o de electrões;
3. o número total de electrões é 2;
4. o número total de electrões é 48;
5. a soma do número de protões e neutrões é inferior ao número total de
electrões em duas unidades.
3.2.3.A representação de um ião, muito estável, formado a partir de um átomo de
sódio (grupo 1 da T.P.) poderá ser:
1-Na+
2-Na3-Na
4-Na2+
5-Na23.3. Entre os átomos dos elementos F, Cl, O, Si, Na, H e C, podem formar-se ligações que
originam compostos conhecidos como os que a seguir se representam pelas suas
fórmulas químicas:
1-CO2
2-NaF
3-Cl2
4-O2
5-O3,
7-H2O
6-SiO2
Relativamente àquelas substâncias, complete o quadro da folha de respostas.
2
Actividade Avaliação – 1ºPeríodo
Professora: Dulce Campos
4. A tabela seguinte diz respeito a quatro substâncias e a duas das constantes físicas que as
caracterizam - o ponto de fusão e o ponto de ebulição.
4.1. Tendo em consideração os dados nela registados, indique:
4.1.1.o estado físico de cada uma das substâncias à temperatura de 20 "c;
4.1.2.um valor de temperatura para o qual o iodo está na forma de vapor;
4.1.3.um valor de temperatura para o qual o bromo se encontra no estado sólido;
4.1.4.as unidades estruturais de cada substância nos estados sólido, líquido e gasoso.
(nas alíneas que se justificar apresente a resposta sob a forma de quadro ou tabela)
5. A substância NaCl pode encontrar-se dissolvida em água, como, por exemplo, na água do
mar, onde existe em concentrações variáveis de mar para mar. Assim, a concentração
mássica média de cloreto de sódio (NaCl) no mar Mediterrâneo é 32,3 g/dm3 e no mar
Morto é 102,0 g/dm3.
5.1. Interprete a frase: "A concentração mássica média de NaCI nas águas do mar
Mediterrâneo é 32,3 g/dm3 "
5.2. Utilizando os termos "concentrada" e "diluída", estabeleça relações entre as
composições médias das águas dos dois mares.
5.3. Se tivesse necessidade de dessalinizar 250 cm3 de água de um daqueles dois mares
com o objectivo de obter cloreto de sódio, qual escolheria? Apresente os cálculos.
3
Actividade Avaliação – 1ºPeríodo
Professora: Dulce Campos
Folha de Respostas
Agrupamento de Escolas Anselmo de Andrade
Química 10.º Ano - Ano Lectivo 10/11
Avaliação Diagnóstica
Duração da Actividade: 90 minutos
Data:
/ 09 / 10
Prof._____________________________________
Nome _________________________________________________
1.
2.
N.º _________
Turma ____
…….
1.1.
A
B
C
D
E
F
G
H
I
J
K
L
M
N
1.2.
A
B
C
D
E
F
G
H
I
J
K
L
M
N
1.3.
A
B
C
D
E
F
G
H
I
J
K
L
M
N
…….
1
Actividade Avaliação – 1ºPeríodo
Professora: Dulce Campos
3.
..
3.1
A porque ______________________________________________________________________
_________________________________________________________________________
B porque ______________________________________________________________________
_________________________________________________________________________
C porque ______________________________________________________________________
_________________________________________________________________________
D porque ______________________________________________________________________
_________________________________________________________________________
E porque ______________________________________________________________________
_________________________________________________________________________
F porque ______________________________________________________________________
_________________________________________________________________________
G porque ______________________________________________________________________
_________________________________________________________________________
3.2
3.2.1.
1
2
3
4
5
3.2.2.
1
2
3
4
5
3.2.3.
1
2
3
4
5
3.3
2
Actividade Avaliação – 1ºPeríodo
Professora: Dulce Campos
4.
..
4.1
4.1.1.
4.1.2. __________________________________________________________________
4.1.3 __________________________________________________________________
4.1.4
5.
5.1
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
_____________________________________________________________________________
5.2
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
_____________________________________________________________________________
5.3
_________________________________________________________________________________
_________________________________________________________________________________
_____________________________________________________________________________
OBSERVAÇÕES: (espaço reservado ao professor)
3