www.professormazzei.com – CINÉTICA QUÍMICA – Folha 11 - Prof.: João Roberto Mazzei
01.Apresente a expressão cinética para a velocidade das reações elementares abaixo:
a) N2(g) + 3H2(g) 2NH3(g)
b) 2CO2(g) 2CO(g) + O2(g)
c) 2NO2(g) N2O4(g)
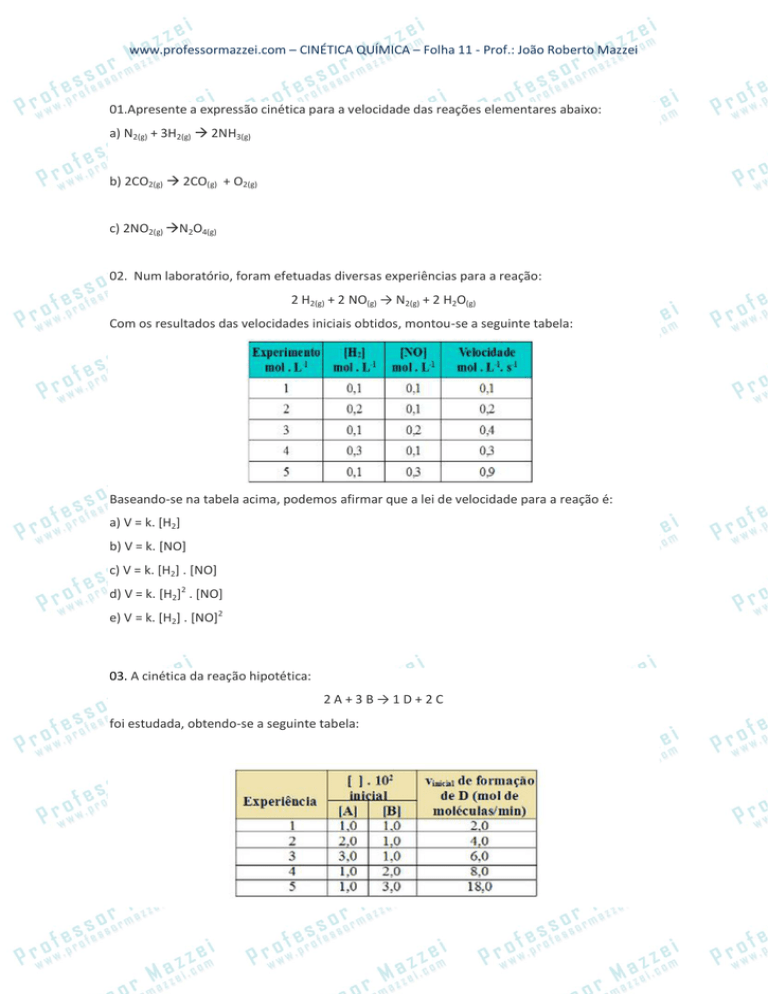
02. Num laboratório, foram efetuadas diversas experiências para a reação:
2 H2(g) + 2 NO(g) → N2(g) + 2 H2O(g)
Com os resultados das velocidades iniciais obtidos, montou-se a seguinte tabela:
Baseando-se na tabela acima, podemos afirmar que a lei de velocidade para a reação é:
a) V = k. [H2]
b) V = k. [NO]
c) V = k. [H2] . [NO]
d) V = k. [H2]2 . [NO]
e) V = k. [H2] . [NO]2
03. A cinética da reação hipotética:
2A+3B→1D+2C
foi estudada, obtendo-se a seguinte tabela:
www.professormazzei.com – CINÉTICA QUÍMICA – Folha 11 - Prof.: João Roberto Mazzei
A lei da velocidade para a reação hipotética é fornecida pela equação:
a) v = k . [A]2 . [B]3
b) v = k . [A]2 . [B]2
c) v = k . [A]2 . [B]
d) v = k . [A] . [B]2
e) v = k . [A]
04. Considere a seguinte reação química hipotética:
A(g) + 2 B(g) → AB2(g)
Com os dados obtidos, construiu-se o seguinte gráfico, em que foi medida a velocidade inicial
da reação, variando-se as concentrações de A e B.
Gráfico com velocidade inicial de reação genérica
Determine a lei da velocidade dessa reação genérica:
a) v = k . [A]2 . [B]3
b) v = k . [A]2 . [B]2
c) v = k . [A]2 . [B]
d) v = k . [A] . [B]
e) v = k . [A]
05. Considere a seguinte reação a 55ºC:
(CH3)3CBr(aq) + OH-(aq) → (CH3)3COH(aq) + Br-(aq)
www.professormazzei.com – CINÉTICA QUÍMICA – Folha 11 - Prof.: João Roberto Mazzei
Experimentos sobre lei de ação das massas ou lei de velocidade das reações
Determine a equação da rapidez ou lei da velocidade dessa reação a 55ºC:
a) V = k. [(CH3)3CBr]
b) V = k. [OH-]
c) V = k. [(CH3)3CBr] . [OH-]
d) V = k. [(CH3)3CBr]2 . [OH-]
e) V = k. [(CH3)3CBr] . [OH-]2
06. (UERJ) A água oxigenada é empregada, frequentemente, como agente microbicida de ação
oxidante local. A liberação do oxigênio, que ocorre durante a sua decomposição, é acelerada
por uma enzima presente no sangue.
Na limpeza de um ferimento, esse microbicida liberou, ao se decompor, 1,6g de oxigênio por
segundo.
Nessas condições, a velocidade de decomposição da água oxigenada, em mol/min é igual a:
a) 6,0
b) 5,4
c) 3,4
d) 1,7
07. A revelação de uma imagem fotográfica em um filme é um processo controlado pela
cinética química da redução do halogeneto de prata por um revelador. A tabela abaixo mostra
o tempo de revelação de um determinado filme, usando um revelador D-76.
A velocidade média (vm) de revelação, no intervalo de tempo de 7 min a 10 min, é:
www.professormazzei.com – CINÉTICA QUÍMICA – Folha 11 - Prof.: João Roberto Mazzei
a) 3,14 mols de revelador / min.
b) 2,62 mols de revelador / min.
c) 1,80 mols de revelador / min.
d) 1,33 mols de revelador / min.
e) 0,70 mol de revelador / min.
08. A reação de decomposição da amônia gasosa foi realizada em um recipiente fechado:
2 NH3 → N2 + 3 H2
A tabela abaixo indica a variação na concentração de reagente em função do tempo.
Qual é a velocidade média de consumo do reagente nas duas primeiras horas de reação?
a) 4,0 mol L-1h -1
b) 2,0 mol L-1h -1
c) 10 km h-1
d) 1,0 mol L-1h -1
e) 2,3 mol h-1
09. A combustão da gasolina pode ser equacionada por C 8H18 + O2 CO2 + H2O
(equação não-balanceada). Considere que após uma hora e meia de reação foram
produzidos 36 mols de CO2. Dessa forma, a velocidade de reação, expressa em
número de mols de gasolina consumida por minuto, é de:
a) 3,00 mol/min.
b) 4,50 mol/min.
c) 0,10 mol/min.
d) 0,40 mol/min.
e) 0,05 mol/min.
10. Óxidos de nitrogênio, NOx, são substâncias de interesse ambiental, pois são
responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são
amplamente estudadas. Num dado experimento, em um recipiente fechado, a
concentração de NO2 em função do tempo apresentou o seguinte comportamento:
www.professormazzei.com – CINÉTICA QUÍMICA – Folha 11 - Prof.: João Roberto Mazzei
O papel do NO2 neste sistema reacional é:
a) reagente.
b) intermediário.
c) produto.
d) catalisador.
e) inerte
GABARITO:
01. a) V = K [N2(g)][H2(g)]3
b) V = K [CO2(g)]2
c) V = K [NO2(g)]2
02. [D]
De acordo com os dados fornecidos, dobrando-se a concentração em quantidade de matéria
de A, a velocidade da reação dobra. Por outro lado, dobrando-se a concentração em
quantidade de matéria de B, a velocidade da reação quadruplica. Logo a expressão da
velocidade da reação é: V = k . [A] . [B]2.
03. [D]
De acordo com os dados fornecidos, dobrando-se a concentração em quantidade de matéria
de A, a velocidade da reação dobra. Por outro lado, dobrando-se a concentração em
quantidade de matéria de B, a velocidade da reação quadruplica. Logo a expressão da
velocidade da reação é: V = k . [A] . [B]2.
04. [D]
V = k. [A]α . [B]β
De acordo com os dados fornecidos no gráfico, a velocidade da reação dobra quando a
concentração de B dobra e a de A é mantida constante (seta laranja abaixo). Logo, α = 1 . A
www.professormazzei.com – CINÉTICA QUÍMICA – Folha 11 - Prof.: João Roberto Mazzei
velocidade da reação também dobra quando a concentração de A é dobrada (seta verde).
Portanto, β = 1 .
Então, conclui-se que a lei da velocidade da reação é: v = k . [A] . [B].
05.[A]
De acordo com os dados fornecidos, dobrando-se (experimentos 1 e 2) a concentração em
quantidade de matéria de [(CH3)3CBr], a velocidade da reação dobra, logo seu expoente é igual
a 1. Por outro lado, dobrando-se a concentração em quantidade de matéria de [OH-]
(experimentos 2 e 3), a velocidade da reação não é alterada. Logo a expressão da velocidade
da reação é: V = k. [(CH3)3CBr] . [OH-]0. Mas todo número elevado a zero é igual a 1. Por isso,
temos:
V = k. [(CH3)3CBr] . 1
V = k. [(CH3)3CBr]
06. [A]
a) Equação química: 2H2O2(liq) 2 H2O(liq) + O2(gás)
b) 1mol de O2 .................. 32g
n mol de O2 ................. 1,6g onde n = 0,05mol de O2.
c) Velocidade de produção de O2 = 0,05mol/s
d) Velocidade de decomposição do H2O2 = 2.0,05 = 0,10mol/s
e) 0,1 mol ................... 1 segundo
n mol ........................ 60 segundos ................. 1 minuto
onde n = 6
Resposta: 6 mol/min
07.[D]
08. [B]
www.professormazzei.com – CINÉTICA QUÍMICA – Folha 11 - Prof.: João Roberto Mazzei
09. [E]
10. [A]
O reagente é a espécie consumida ao longo do processo, logo, sua concentração diminui, com
o passar do tempo.












