Polyclonal Rabbit Anti-Human IgM/FITC, Rabbit F(ab’)2
Polyclonal Rabbit Anti-Human IgM/RPE, Rabbit F(ab’)2
Utilização prevista
F0058
R5111
Para utilização em diagnósticos in vitro.
O F0058 e o R5111 foram concebidos para utilização em citometria de fluxo. Na citometria de fluxo, os
anticorpos de IgM são eficazes para a demonstração da IgM na superfície celular e, assim, para a subtipagem
da leucemia linfoblástica aguda da pré-célula B (pre-B-ALL), da leucemia linfoblástica aguda da célula B (BALL) e das anomalias linfoproliferativos crónicas da célula B, juntamente com uma série de outros anticorpos
(1-6). A interpretação dos resultados deve ser feita por um profissional qualificado, dentro do contexto dos
antecedentes clínicos do doente e de outros testes de diagnóstico.
Resumo
e explicação
A maioria das células B, com excepção do progenitor pré-B, das células pré-B e das células plasmáticas
maduras, expressa imunoglobulina na sua superfície. As células pré-B expressam cadeias µ citoplasmáticas,
mas não expressam nenhuma cadeia leve, ao passo que os linfócitos B iniciais expressam apenas a
membrana da lgM. Os linfócitos B maduros produzem ainda lgD, que é inserida na membrana celular e se une
à lgM e estabelece uma população de linfócitos B IgM+IgD+, a qual é a maior população de linfócitos B em
circulação no ser humano. A reorganização subsequente da região constante dos genes de cadeia pesada da
imunoglobulina resulta em células que expressam IgG ou IgA na membrana, inicialmente em conjunção com
IgM ou IgD. A exposição ao antígeno activa a produção destas células. As mesmas podem evoluir de
precursores B menos maduros, numa reacção primária, ou de células de memória, numa reacção secundária
(7). As células da leucemia linfocítica crónica da célula B (B-CLL) são normalmente positivas a IgM e IgD de
superfície (2-6). Além disso, observam-se frequentemente casos positivos a lgM e lgD nas leucemias
prolinfocíticas da célula B, nas leucemia dos tricoleucitos, nos linfomas esplénicos com linfócitos vilosos, nos
linfomas das células do manto e nos linfomas das células foliculares (1-5). Os casos pré-B-ALL expressam
IgM citoplasmático , ao passo que os casos B-ALL expressam IgM de superfície (1).
Reagente fornecido
Os conjugados anti-IgM, F0058 e R5111, foram produzidos de um fragmento F(ab')2 de anticorpo policlonal de
coelho, isolado por afinidade. Os conjugados são fornecidos na forma líquida, em tampão contendo
soroalbumina bovina (BSA) a 1% e 15 mmol/L de NaN3, pH 7,2. Cada ampola de F0058 contém 100 testes (10
µL de F0058 para um máximo de 106 leucócitos de sangue periférico humano normal). Cada ampola de R5111
contém 100 testes (10 µL de conjugado para um máximo de 106 leucócitos de sangue periférico humano
normal).
Concentração do conjugado em g/L: Ver o rótulo do frasco.
Preparação
N.º Código
do Anticorpo
Fluorocromo
N.º Código
Controlo Negativo
F0058
FITC (Isotiocianato de Fluoresceína Isómero 1)
X0929
R5111
RPE (R-Ficoeritrina)
X0930
1.
O anticorpo utilizado para a conjugação de FITC e RPE foi absorvido na fase sólida com proteínas de
plasma humano para se removerem os anticorpos indesejáveis.
2.
O anticorpo absorvido foi ainda purificado por cromatografia de afinidade, numa coluna com lgM humana
imobilizada.
3.
O anticorpo isolado por afinidade foi então degradado com pepsina e o fragmento F(ab')2 foi isolado por
filtração em gel.
4.
Por fim, o fragmento F(ab')2 foi conjugado com o isómero 1 de isotiocianato de fluoresceína ou com Rficoeritrina.
Imunogénio
IgM isolada de soro humano de um doente com macroglobulinanemia de Waldenström.
Especificidade
O Anti-IgM reage com as cadeias µ- da IgM humana. A especificidade foi verificada conforme descrito a
seguir. Para se obter um máximo de sensibilidade, executaram-se os testes de especificidade de
imunoelectroforese cruzada e ELISA antes da purificação por afinidade e da degradação por pepsina.
Imunoelectroforese cruzada: Quando se analisa o anticorpo contra plasma humano, surge apenas o arco de
precipitação de lgM. Coloração: Azul Brilhante de Coomassie.
ELISA: No ELISA indirecto não se observou qualquer reacção significativa com a IgA e IgG humanas. No
duplo anticorpo ELISA em sanduíche, não se observa nenhuma reacção significativa com plasma humano
desprovido de IgM.
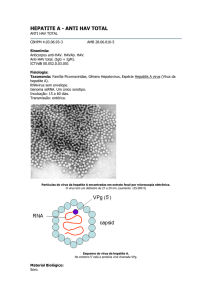
Citometria de fluxo: Quando testado em sangue lisado humano, o Anti-IgM marca uma subpopulação das
células positivas a CD19.
A análise dos linfócitos de sangue periférico por citometria de fluxo demonstra que o Anti-IgM marca uma
percentagem de B-CLL. Assim, num estudo de 121 casos (3), 32 deram resultados positivos somente a IgM,
tendo outros 21 casos dado resultados positivos a IgD e também a IgM. Noutro estudo de 165 casos (4), 142
deram resultados positivos a IgM, tendo vários destes casos dado ainda resultados positivos a IgD.
Precauções
1. Para utilizadores profissionais.
2. Este produto contém azida sódica (NaN3), uma substância química altamente tóxica na forma pura. Em
concentrações de produto, mesmo não classificadas como perigosas, a azida sódica poderá reagir com as
canalizações de chumbo e de cobre, formando acumulações de azidas metálicas altamente explosivas. Ao
(104061-002)
F0058/R5111/PT/ROP/01.02.07 p. 1/3
Dako Denmark A/S | Produktionsvej 42 | DK-2600 Glostrup | Denmark | Tel. +45 44 85 95 00 | Fax +45 44 85 95 95 | CVR No. 33 21 13 17
descartar, lavar com grandes quantidades de água a pressão, a fim de evitar a acumulação de azidas
metálicas na canalização.
3. Tal como no caso de qualquer produto derivado de fontes biológicas, devem empregar-se processos de
manuseamento apropriados.
4. Usar equipamento de protecção pessoal adequado para evitar o contacto com a pele e os olhos.
5. A solução não utilizada deverá ser eliminada em conformidade com as regulamentações locais e nacionais.
Armazenamento
Armazenar em local escuro, entre 2 e 8 ºC. Não utilizar após a data de validade inscrita no frasco. Caso os
reagentes sejam armazenados noutras condições para além das que se encontram especificadas, o utilizador
deve verificar tais condições. Não há sinais óbvios que indiquem a instabilidade deste produto. Por
conseguinte, os controlos positivo e negativo devem ser processados em simultâneo com as amostras do
doente. Este produto pode, durante o seu armazenamento, desenvolver ocasionalmente uma pequena
precipitação, a qual causará uma coloração granular fina não específica. Através de uma simples filtração
(com um filtro de acetato de celulose de 0,22 µm), é possível restaurar a grande qualidade original do
conjugado. Não armazenar os conjugados na forma diluída. Caso se observem colorações inesperadas que
não possam ser explicadas por variações dos procedimentos de laboratório e se suspeite de um problema
com o anticorpo, contactar com o nosso Centro de Assistência Técnica.
Observação processual
Antes de se colorirem amostras de sangue periférico, devem isolar-se as células mononucleares por
centrifugação, num meio de separação, ou deve lavar-se a amostra de sangue para remover as proteínas de soro
solúveis. Dado que os monócitos humanos se ligam às imunoglobulinas do soro através dos seus receptores Fc
de superfície, estas células devem ser ou removidas por depleção ou identificadas.
Processo de coloração
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
Recolher sangue venoso para dentro de um tubo de ensaio que contenha um anticoagulante.
Transferir 100 µL de sangue anticoagulado para um tubo de ensaio.
Adicionar 2 mL de PBS a 0,01 mol/L, pH 7,4. Misturar cuidadosamente por meio de um misturador de
vórtice.
Centrifugar a 300 x g durante 5 minutos, e depois aspirar o sobrenadante, deixando ficar
aproximadamente 50 µL do líquido.
Repetir as etapas 3 e 4 mais duas vezes.
Adicionar 10 µL de rabbit immunoglobulin fraction, N.º de código X0903, para efectuar o bloqueio.
Misturar cuidadosamente por meio de um misturador de vórtice e incubar em lugar escuro a 37ºC
durante 30 minutos.
Adicionar 10 µL de anti-IgM conjugado com fluorocromo. Misturar cuidadosamente.
Utilizar um fragmento F(ab’)2 não reactivo de imunoglobulinas de coelho, conjugado com o mesmo
fluorocromo, como controlo negativo (consultar a tabela).
Incubar em lugar escuro a 4 °C durante 30 minutos.
Adicionar 1-2 mL de reagente lisante de eritrócitos a cada tubo e misturar cuidadosamente. Seguir as
recomendações do fabricante do regente relativamente ao período e temperatura de incubação.
Centrifugar a 300 x g durante 5 minutos.
Aspirar o sobrenadante, deixando ficar aproximadamente 50 µL de fluído.
Adicionar 2 mL de PBS a 0,01 mol/L, pH 7,4. Misturar cuidadosamente por meio de um misturador de
vórtice.
Repetir as etapas 11 e 12.
Ressuspender novamente o pellet num fluído apropriado para a citometria de fluxo, p. ex. 0,3 mL de
paraformaldeído a 1% (fixador) em de PBS a 0,01 mol/L, pH 7,4.
Analisar num citómetro de fluxo.
Recomenda-se a inclusão de uma amostra adequada de controlo positivo e negativo em cada tiragem, para
controlo do reagente e do preparado. Reparar que os conjugados de fluorocromo são sensíveis à luz, e que as
amostras devem ser protegidas da luz durante o processo de coloração e até à sua análise. Para coloração do
IgM citoplasmático, recomenda-se o kit de fixação e permeabilização Dako IntraStain, N.º de código K2311.
Referências
(104061-002)
1.
van Dongen JJM, Adriaansen HJ. Immunobiology of leukaemia. In: Henderson ES, Lister TA, Greaves
MF, editors. Leukemia. Philadelphia, London, Toronto, Montreal, Sydney, Tokyo: WB Saunders
Company; 1996. p. 83-130.
2.
Geisler CH, Larsen JK, Hansen NE, Hansen MM, Christensen BE, Lund B, et al. Prognostic importance
of flow cytometric immunophenotyping of 540 consecutive patients with B-cell chronic lymphocytic
leukemia. Blood 1991;78:1795-1802.
3.
Cartron G, Linassier C, Bremond JL, Desablens B, Georget MT, Fimbel B, et al. CD5 negative B-cell
chronic lymphocytic leukemia: clinical and biological features of 42 cases. Leuk Lymphoma 1998;31:20916.
4.
Gandini D, Lanza F, Latorraca A, Levato F, Del Senno L, Castoldi G. Immunophenotypic and genotypic
characterization of B-cell chronic lymphocytic leukemia patients from Northern Italy. Haematologica
1993;78:18-24.
5.
Batata A, Shen B. Immunophenotyping of subtypes of B-chronic (mature) lymphoid leukemia. A study of
242 cases. Cancer 1992;70:2436-43.
6.
Shen PUF, Fuller SG, Rezuke WN, Sherburne BJ, DiGiuseppe JA. Laboratory, morphologic, and
immunophenotypic correlates of surface immunoglobulin heavy chain isotype expression in B-cell chronic
lymphocytic leukemia. Am J Clin Pathol 2001;116:905-12.
F0058/R5111/PT/ROP/01.02.07 p. 2/3
Dako Denmark A/S | Produktionsvej 42 | DK-2600 Glostrup | Denmark | Tel. +45 44 85 95 00 | Fax +45 44 85 95 95 | CVR No. 33 21 13 17
7.
Deegan MJ. B lymphocytes and plasma cells: their development and identification. In: Keren DF, editor.
Flow cytometry in clinical diagnosis. Chicago: ASCP Press; 1989. p. 139-63.
Explicação dos símbolos
(104061-002)
Número de catálogo
Limites de temperatura
Utilizar até
Dispositivo médico para
diagnóstico in vitro
Manter ao abrigo da luz solar
(consultar a secção de
armazenamento)
Fabricante
Consultar as instruções de
utilização
Código de lote
F0058/R5111/PT/ROP/01.02.07 p. 3/3
Dako Denmark A/S | Produktionsvej 42 | DK-2600 Glostrup | Denmark | Tel. +45 44 85 95 00 | Fax +45 44 85 95 95 | CVR No. 33 21 13 17