Análise de fluorescência em alimentos e materiais cotidianos
Análise de fluorescência em alimentos e materiais cotidianos
Ana Luiza Neves Soares, Danielle Lazzer Lucarini, Henrique Lopes Karam, Joyce Cristina
Ribeiro, Luana Lúcia dos Santos, Victor Gonçalves Marques
Professor: Maria Inês Ribas Rodrigues, CCNH
Campus Santo André
Resumo
A fluorescência é comumente vista em lâmpadas fluorescentes e em letreiros de
neon, por exemplo. No entanto, este fenômeno não ocorre apenas em objetos de
iluminação. Substâncias com características fluorescentes podem estar presentes
em outros lugares, como em alimentos. O intuito do experimento realizado foi
contemplar e analisar a fluorescência, mostrando que ela pode ocorrer em
alimentos e materiais cotidianos, e não apenas em objetos de iluminação.
INTRODUÇÃO
O efeito de fluorescência, explicado pelo
modelo de Bohr, resume-se na capacidade
de uma substância emitir luz visível ao ser
submetida à radiação ultravioleta (invisível
ao olho humano). Pela estrutura atômica
proposta por Bohr, elétrons de um dado
átomo, ao absorverem radiação UV,
quantizam energia e podem ser capazes de
passar de um estado fundamental para um
estado excitado, emitindo, ao retornar, a
diferença de energia dos estados na forma
de radiação eletromagnética. [1]
OBJETIVO
Detectar o efeito da fluorescência em
alimentos (água tônica, ovo marrom, hortelã
e vitamina B).
METODOLOGIA
A metodologia é dividida em três partes: o
preparo da solução, a iluminação com a
lâmpada de luz negra e a medição da
absorbância com o espectrofotômetro.
Como a água tônica já é a própria solução,
não foi feita a primeira etapa com sua
amostra, sendo que o único processo
realizado foi a retirada do seu gás com o
auxílio de um agitador magnético. A
preparação das soluções de hortelã e ovo
marrom envolve a diluição desses
alimentos em 50 mL de acetato de etila
(para cada solução), após triturar as folhas
de hortelã e dissolver a casca do ovo
marrom em 15 mL de ácido clorídrico 10%.
O complexo de vitamina B foi apenas
diluído em água destilada. [2]
Após o preparo das soluções, as amostras
são expostas à luz negra, resultando nas
diferentes cores emitidas, como mostrado
nas figuras a seguir.
IX Simpósio de Base Experimental das Ciências Naturais da Universidade Federal do ABC - 12 e 13 de agosto de 2011
Análise de fluorescência em alimentos e materiais cotidianos
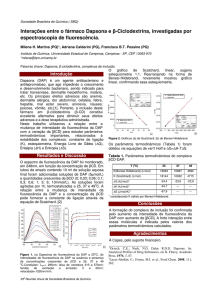
Figura 1: Amostras analisadas sob a luz
branca (à esquerda) e sob a radiação UV (à
direita). Em cada imagem, da esquerda
para a direita: água tônica, solução de
vitamina B, solução com ovo marrom, e
solução de hortelã.
A terceira etapa envolve pegar pequenas
quantidades de amostras e colocar no
espectrofotômetro para criar um gráfico da
absorbância em função do comprimento de
onda, e entender o porquê das diferentes
cores emitidas na segunda etapa.
RESULTADOS E DISCUSSÃO
Em exposição à radiação UV, as amostras,
apresentaram suas variações de emissão
de fótons de acordo com suas propriedades
fluorescentes, como o alcaloide quinina da
água tônica, a clorofila da hortelã, a
protoporfirina IX da casca do ovo marrom e
a riboflavina da vitamina B, mostrado
abaixo os resultados visíveis obtidos
experimentalmente:
Tabela I: Comparação entre as cores
emitidas pelas amostras sob a luz branca e
sob a radiação ultravioleta.
Cor emitida sob
Cor emitida sob
Amostra
radiação
luz branca
ultravioleta
Água tônica Transparente
Azul
Hortelã
Verde
Vermelho
Ovo marrom Marrom
Magenta
Vitamina B Amarelo
Verde-amarelado
Com
as
análises
adquiridas
espectrofotômetro,
observou-se
capacidade de absorbância de
substância:
pelo
a
cada
Figura 2: Gráfico da absorbância em
função do comprimento de onda (em nm).
As diferentes emissões de fluorescência
das amostras podem ser entendidas pela
capacidade de absorbância de cada uma
delas, como por exemplo, a Vitamina B, que
mais emitiu fluorescência, foi também a que
mais absorveu a radiação UV; a amostra de
casca de ovo marrom foi a substância que
menos absorveu a radiação UV e a que
menos emitiu fluorescência, ou seja, que
precisou de menos energia para excitar um
elétron, com isso emitiu menos energia ao
retornar ao estado fundamental.
CONCLUSÕES
Conclui-se que a diferença obtida nas
análises é devido à mudança na quantidade
de energia fornecida.
REFERÊNCIAS BIBLIOGRÁFICAS
[1]Peruzzo, F. M. Química: na abordagem
do cotidiano. 2ª ed. São Paulo: Moderna,
2002.
[2]Nery, A. L. P. e Fernandez, C.;
Fluorescência
e
Estrutura
Atômica:
Experimentos simples para abordar o tema;
disponível
em
http://qnesc.sbq.org.br/online/qnesc19/19a12.pdf; acessado em 07/07/2011.
AGRADECIMENTOS
À Professora Dr.ª Maria Inês Ribas
Rodrigues e às técnicas do laboratório pelo
auxílio e orientações no decorrer da
realização do experimento.
IX Simpósio de Base Experimental das Ciências Naturais da Universidade Federal do ABC - 12 e 13 de agosto de 2011