TABELA PERIÓDICA DOS ELEMENTOS
[Escolher a
data]
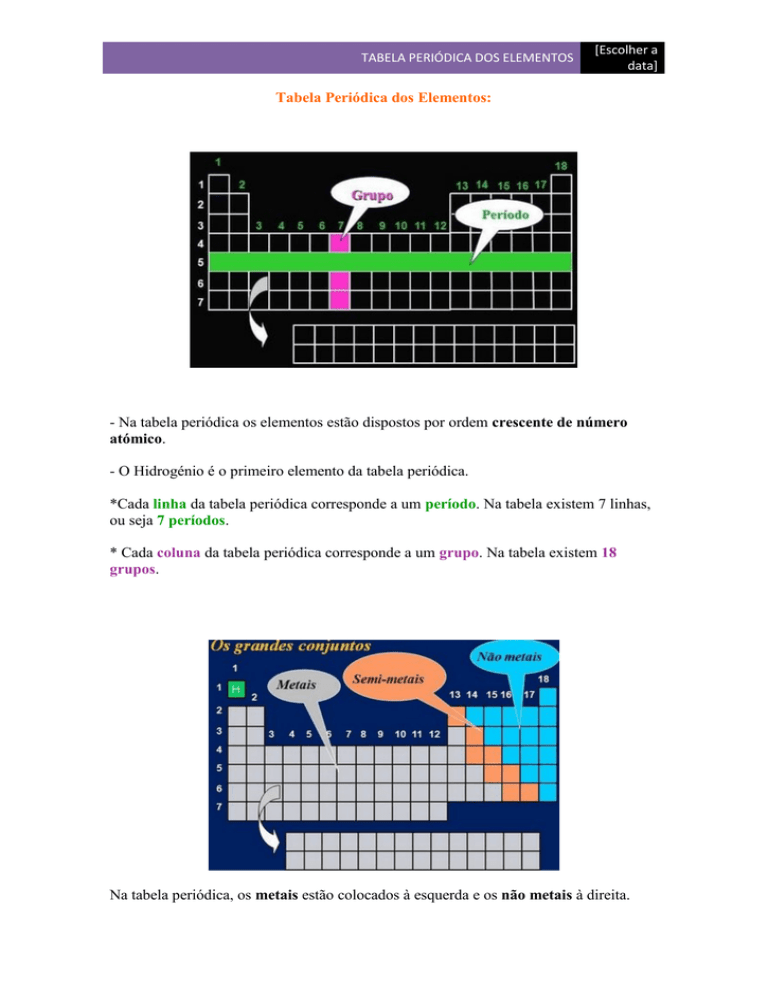
Tabela Periódica dos Elementos:
- Na tabela periódica os elementos estão dispostos por ordem crescente de número
atómico.
- O Hidrogénio é o primeiro elemento da tabela periódica.
*Cada linha da tabela periódica corresponde a um período. Na tabela existem 7 linhas,
ou seja 7 períodos.
* Cada coluna da tabela periódica corresponde a um grupo. Na tabela existem 18
grupos.
Na tabela periódica, os metais estão colocados à esquerda e os não metais à direita.
TABELA PERIÓDICA DOS ELEMENTOS
[Escolher a
data]
Entre os metais e os não metais situam-se os elementos designados por semi-metais,
por apresentarem propriedades semelhantes aos metais e aos não metais.
Determinação do período e do grupo de um elemento:
A análise da configuração electrónica permite determinar o período e o grupo a que um
elemento pertence.
Exemplo:
Li:2,1
- O lítio pertence ao 2º período, pois possui dois níveis de energia.
- O lítio pertence ao grupo 1, pois possui um electrão de valência.
Cl:2,8,7
- O Cloro pertence ao 3º período, pois possui três níveis de energia.
- O Cloro pertence ao grupo 17, pois possui sete electrões de valência.
Variação do tamanho dos átomos:
TABELA PERIÓDICA DOS ELEMENTOS
[Escolher a
data]
-Ao longo de um grupo, o raio atómico aumenta, uma vez que está a aumentar o nº de
níveis de energia e os electrões de valência vão sendo distribuídos cada vez mais longe
do núcleo.
-Ao longo de um período, o raio atómico diminui, embora os átomos possuam o
mesmo número de níveis de energia, aumenta o número de protões, e consequentemente
a carga nuclear, fazendo com que os electrões sejam cada vez mais atraídos pelo núcleo.
Isto faz com que aumente a atracção electrostática (núcleo-electrões), havendo uma
maior contracção da nuvem electrónica, diminuindo o tamanho do átomo.
Carácter metálico
Diz-se que, um elemento apresenta carácter metálico quando as suas propriedades
físicas e químicas são características dos metais, nomeadamente a tendência para perder
electrões e assim formar catiões.
*Como varia o carácter metálico ao longo da Tabela periódica?
-Aumenta ao longo de um grupo, devido ao aumento do número de níveis de energia.
Desta forma, os electrões de valência são menos atraídos pelo núcleo, sendo mais fácil a
sua remoção.
- Diminui ao longo de um período, uma vez que, apesar de ser constante o nº de
camadas, vai aumentando a carga nuclear, e aumenta o poder de atracção sobre os
electrões de valência, sendo mais difícil o átomo perder electrões, diminuindo deste
modo o seu carácter metálico.
TABELA PERIÓDICA DOS ELEMENTOS
[Escolher a
data]
Propriedades dos grupos da tabela periódica:
Alguns grupos da tabela periódica tem designações especiais:
Grupo 1: Metais alcalinos
Grupo 2: Metais alcalino-terrosos
Grupo 16: Calcogéneos
Grupo 17: Halogéneos
Grupo 18: Gases nobres, raros ou inertes.
Os elementos que se localizam no mesmo grupo possuem propriedades físicas e
químicas semelhantes pelo facto de possuírem estrutura electrónica semelhante.
Grupo 1-Metais Alcalinos: Li, Na, K, Rb, Cs, Fr
São elementos do grupo 1: possuem 1 electrão de valência;
-Formam iões monopositivos estáveis :
- A reactividade dos metais alcalinos aumenta ao longo do grupo.
-Reagem muito rapidamente com o oxigénio formando os respectivos óxidos (Li2O,
Na2O, K2O,…) que são do tipo X2O, pelo que devem ser guardados em parafina
líquida ou petróleo;
- Reagem violentamente com a água formando hidróxidos do tipo XOH.
Exemplo:
Grupo 2-Metais alcalino-terrosos: Be, Mg, Ca, Sr, Ba, Ra
-São elementos do grupo 2, possuem 2 electrões de valência;
TABELA PERIÓDICA DOS ELEMENTOS
[Escolher a
data]
-Formam iões dipositivos estáveis;
-A reactividade dos metais alcalino-terrosos aumenta ao longo do grupo.
- Reagem com o oxigénio, formando os respectivos óxidos (BeO, MgO, CaO,…), do
tipo XO;
- Reagem com a água formando hidróxidos do tipo X(OH)2 , originando soluções
alcalinas.
Exemplo:
Grupo 17-Halogéneos: F, Cl, Br, I, At
-São elementos do grupo 17 : têm 7 electrões de valência;
-Formam iões mononegativos estáveis:
-Formam moléculas diatómicas ( I2 , Br2 , Cl2 , etc);
- Reactividade dos Halogéneos diminui ao longo do grupo.
Grupo 18-Gases Nobres, raros ou inerte: He, Ne, Ar, Kr, Xe, Rn
- São elementos do grupo 18: têm 8 electrões de valência (excepto o hélio que tem 2);
- São químicamente substâncias muito estáveis e raras;
- São todos gases, à temperatura ambiente;
- Devido à sua grande estabilidade, estes elementos são muito pouco reactivos.
Reactividade dos átomos
TABELA PERIÓDICA DOS ELEMENTOS
[Escolher a
data]
À medida que a nuvem electrónica aumenta, os electrões de valência encontram-se mais
afastados do núcleo,diminuindo a atracção ao núcleo e sendo mais fácil "sair" do átomo,
por isso são mais reactivos.












