O FOGO E A REAÇÃO DE COMBUSTÃO
Figura 1 – Reação de combustão
Fonte: Alunos online
CONTEÚDOS
•
A importância do domínio do fogo pelo homem
•
Triângulo do fogo
•
Energia de ligação
•
Energia de ativação
•
Diferentes regiões da chama e a temperatura
AMPLIANDO SEUS CONHECIMENTOS
A importância do domínio do fogo pelo homem
Antes do domínio do fogo pelo homem, os seres ficavam à mercê da natureza,
esperando um raio atingir uma árvore, e com a sua queima, aparecer o fogo. Nessa
época, os seres eram muito mais vulneráveis e primitivos.
Quando passou a dominar o fogo, foi possível se aquecer, proteger-se dos predadores
e cozinhar alimentos. Além disso, o domínio das técnicas de combustão 1 permitiu o
desenvolvimento da cerâmica e da metalurgia, surgindo novos materiais, entre outras
realizações.
1
Combustão: termo técnico para queima.
O que é fogo e como é alimentado?
O fogo surge rapidamente quando certo material reage com o oxigênio, esse material
que sofre a combustão é o combustível. Com a queima do combustível, há liberação
luz, calor e os produtos gasosos da reação. O fogo é uma mistura de gases em altas
temperaturas e por isso emite luz na faixa do infravermelho e visível.
Para que haja fogo, são necessários três elementos: combustível (material que queima),
calor e oxigênio (comburente). A reação química entre esses elementos provoca uma
reação em cadeia, propagando mais calor.
Figura 2 – Teoria do fogo
Fonte: Portal dos bombeiros
Para manter o fogo aceso, é preciso haver combustível e oxigênio. Não é preciso ficar
alimentando o fogo com calor, porque durante a combustão, o calor liberado é suficiente
para manter a queima do combustível e, enquanto isso ocorrer, haverá chama.
De onde vem o calor liberado na queima?
Como dito, a queima é a reação de um combustível com o oxigênio, liberando muito
calor, geralmente, com formação de chama.
Os combustíveis mais comuns utilizados possuem em sua composição átomos de
carbono e hidrogênio e, durante a queima, esses átomos de carbono se ligam ao
oxigênio e se transformam em gás carbônico. Os átomos de hidrogênio também se
ligam ao oxigênio e se transformam em água.
Representação da reação de queima:
Figura 3 – Reação de queima
Fonte: Fundação Bradesco
Observação
As substâncias químicas são formadas por átomos, que podem ser iguais ou diferentes,
unidos por ligações químicas. Existem diferentes tipos de ligações ou interações entre
os átomos.
Em uma reação química, as ligações entre os átomos dos reagentes são quebradas e
formam-se novas ligações entre os átomos para a formação dos produtos.
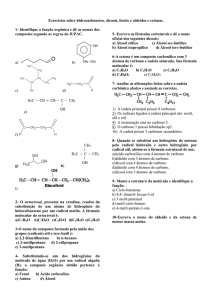
Por exemplo, na queima do metano, que é uma reação de metano (CH4) com oxigênio
(O2), os átomos das moléculas das duas substâncias precisam ser separados para que
ocorra a formação dos produtos, dióxido de carbono (CO2) e água (H2O) 2.
Figura 4 – Representação da queima do metano
Fonte: Fundação Bradesco
Atenção
No dióxido de carbono, o átomo de carbono está ligado a dois átomos de oxigênio,
assim, O = C = O.
A molécula de água é formada de 2 átomos de hidrogênio ligados a um átomo de oxigênio,
que pode ser representada linearmente por H – O – H.
2
A equação química da combustão do metano não está balanceada, ou seja, não está apresentada a
proporção entre os reagentes e os produtos.
Analisando como os átomos se combinam, conclui-se então que, é preciso separar a
molécula de oxigênio em 2 átomos, para formar o dióxido de carbono e a água. Mas,
sabe-se que, para separar os átomos da molécula de oxigênio, é preciso muita energia.
Uma energia tão alta, que só seria alcançada a uma temperatura perto de 8.000 °C. E a
queima de um combustível não chega a essa temperatura.
Como as reações químicas ocorrem a temperaturas bem mais baixas que as
necessárias para romper ligações entre átomos, pode-se concluir que a quebra e a
formação de ligações acontecem ao mesmo tempo.
As ligações nos reagentes vão se afrouxando, enquanto novas ligações já começam a
se formar. Nesse momento, as distâncias entre os átomos dos reagentes são um pouco
maiores do que antes, e as distâncias entre os átomos que vão formar os produtos ainda
são um pouco maiores do que vão ser no fim.
Figura 5 – O calor auxilia a distanciar os átomos nas moléculas
Fonte: Fundação Bradesco
Essa estrutura intermediária, que se forma quando os reagentes se transformam em
produtos, tem energia maior que os reagentes e que os produtos, pois é necessário
fornecer energia para esticar as ligações.
Se para quebrar ligações precisamos fornecer energia, de onde vem o calor
quando se queima um combustível?
Na realidade, a formação de ligação é um processo que libera calor. Quando dois
átomos se ligam, liberam energia (calor). No caso da queima, o calor liberado é maior
que o calor necessário para quebrar as ligações. Por isso, no total, a queima é um
processo que libera calor.
A mistura de metano e oxigênio não reage à temperatura ambiente. Se reagisse, nos
pântanos ou nos lixões, haveria fogo, porque o metano é um gás que se forma pela
decomposição de materiais orgânicos.
A energia que o metano e o oxigênio têm, à temperatura ambiente, não é suficiente para
a reação ocorrer. É necessário aquecer a mistura até a temperatura de ignição 3,
fornecendo calor por meio de uma chama. O calor da chama faz algumas moléculas,
em sua proximidade, adquirirem energia suficiente para reagir.
A energia necessária para a reação ocorrer é chamada energia de ativação. Para a
combustão começar, essa energia precisa vir de fora. Por exemplo, de um fósforo. Uma
vez iniciada a queima, ela mesma produz energia suficiente para as moléculas vizinhas
também reagirem.
Observação
As moléculas que participam da reação fornecem energia de ativação para as outras,
que vão reagir em seguida.
Costuma-se representar a energia dos produtos, dos reagentes e da estrutura
intermediária, com as ligações afrouxadas, num diagrama de energia.
Figura 6 – Diagrama da energia de ativação necessária para iniciar a combustão
Fonte: Instituo de Química, USP
3
Temperatura de ignição: temperatura até a qual é preciso aquecer um combustível para ele pegar
fogo, sem a necessidade de uma chama.
Esse diagrama é típico de uma combustão. Como a energia dos reagentes é maior que
a energia dos produtos, é liberada energia na reação. A reação é exotérmica 4. A
energia da estrutura intermediária é maior que a dos reagentes. Para formá-la, é preciso
fornecer energia. Costumam-se ligar os níveis de energia dos reagentes e dos produtos
por meio de uma curva, porque se trata de uma barreira de reação. Essa barreira é a
diferença entre a energia que precisa ser fornecida para afrouxar as ligações e a que é
liberada na formação de novas ligações.
A queima de outros combustíveis
O gás de botijão é uma mistura de duas substâncias chamadas propano e butano. As
duas substâncias são formadas por moléculas que têm só átomos de carbono e
hidrogênio. Eles são diferentes, porque têm números de átomos de carbono e
hidrogênio diferentes.
Existem milhares e milhares de substâncias que são formadas só de átomos de carbono
e hidrogênio. Como existem muitas substâncias desse tipo, foi dado um nome especial
para elas: são chamadas hidrocarbonetos.
Portanto, propano e butano são hidrocarbonetos. A molécula de propano é formada por
3 átomos de carbono e 8 átomos de hidrogênio, e a molécula de butano é formada por
4 átomos de carbono e 10 átomos de hidrogênio. A fórmula do propano é C3H8. Os
átomos de carbono e hidrogênio estão ligados da seguinte maneira:
Figura 7 – Fórmula estrutural do propano
Fonte: Fundação Bradesco
A molécula de butano é formada por 4 átomos de carbono e 10 átomos de hidrogênio.
A fórmula do butano é C4H10. Os átomos de carbono e hidrogênio estão ligados da
seguinte maneira:
4
As reações exotérmicas ocorrem com liberação de energia.
Figura 8 – Fórmula estrutural do butano
Fonte: Fundação Bradesco
A gasolina também é uma mistura de hidrocarbonetos. Este combustível tem alta
concentração do hidrocarboneto chamado octano. A molécula de octano é formada por
8 átomos de carbono (C) e 18 átomos de hidrogênio (H). Portanto, sua fórmula é C8H18.
Atenção
Agora, já sabemos quais são os átomos que formam as moléculas dos combustíveis.
Sabemos também que a molécula do gás oxigênio é formada por 2 átomos ligados
de oxigênio. E ainda que a queima é uma reação entre combustível e oxigênio.
Quando ocorre uma transformação química, os átomos das substâncias que reagem
trocam de lugar. Sabemos que, na queima, formam-se dióxido de carbono (CO2) e água
(H2O).
Comparando as fórmulas do propano (C3H8) e do butano (C4H10), é possível saber qual
deles precisa de mais oxigênio para queimar. Ou seja, se um combustível tem mais
átomos de carbono e de hidrogênio, ele precisa mais de oxigênio para reagir.
Combustão do propano
C3H8 + 5 O2 → 3 CO2 + 4 H2O
Combustão do butano
C4H10
+
13/2 O2
→ 4 CO2 + 5 H2O
Observação
Analisando a equação de queima de cada um dos combustíveis, veja que a quantidade
de oxigênio necessária para que ocorra a combustão é diferente. Para o butano, que
apresenta mais átomos de carbono em sua composição, a quantidade de oxigênio
necessária é maior. Consequentemente, as quantidades de produtos formados também
são maiores, em relação às quantidades formadas na queima do propano.
É importante perceber que houve um rearranjo de átomos das moléculas do combustível
e do oxigênio e que, nesse rearranjo, há liberação de calor e luz (energia armazenada
nas partículas do combustível).
ATIVIDADE
Experiência – A resistência do fogo
Atenção
Tome bastante cuidado ao realizar a experiência. Organize o espaço, removendo os
objetos e materiais que não serão utilizados.
Encha um copo com água. Espete um montinho de algodão em um garfo. Segure o
garfo com o algodão logo acima do copo com água. Risque um fósforo e coloque fogo
no chumaço de algodão e marque o tempo, com um relógio ou cronômetro, que demora
para queimar todo o algodão. Cuidado para não se queimar!!! Anote o tempo.
Repita a experiência, desta vez, colocando uma pastilha de efervescente (uma pastilha
de antiácido ou antitérmico para dores) dentro do copo com água. Marque o tempo
também e compare com o caso anterior.
Figura 9 – Experiência com a chama da vela
Fonte: Jornal Re-Ação
Agora, pegue um fio de cobre grosso. Faça uma espiral com o fio. Acenda uma vela
bem fina, daquelas de aniversário e cubra a chama da vela com o espiral de fio de cobre.
Repita a experiência, mas desta vez aqueça o cobre antes de colocá-lo sobre a chama
da vela.
Cuidado: segure o fio de cobre com um alicate e espere esfriar antes de colocá-lo sobre
a mesa.
O que será que aconteceu? Para auxiliá-lo no entendimento, seguem algumas dicas
sobre a teoria do fogo, que na verdade, você já sabe!
Para qualquer material pegar fogo, é preciso de três de elementos: a substância que
queima (papel, álcool, gasolina etc), a substância que alimenta a queima (o oxigênio do
ar) e o calor. Então, atenção: o oxigênio sozinho não pega fogo. Esses três elementos
formam o triângulo do fogo.
A temperatura necessária para o fogo começar, depende da substância que vai queimar.
Chamamos de temperatura de ignição a temperatura até a qual se precisa aquecer um
combustível para ele pegar fogo. Nessa temperatura não precisa de chama.
Fonte: Simone Diniz, Jornal Re-Ação, n° 7, 1995. Adaptado.
LEITURA COMPLEMENTAR
O que é chama?
Figura 10 – O que é chama?
Fonte: Instituto de Física
Algumas vezes, quando o combustível queima, produz tanto calor, que ocorre a
formação de chamas. Isso acontece, por exemplo, com o gás de cozinha, quando os
gases reagem com o oxigênio do ar.
Vamos examinar a chama de uma vela com cuidado. É possível distinguir
principalmente três partes: a parte de baixo, que consiste numa porção azulada; um
pouco mais acima, uma parte mais escura; e a parte mais externa da chama, que é de
cor laranja.
Figura 11 – Chama de uma vela com suas diferentes cores.
Fonte: Brasil escola
As diferentes regiões da chama da vela
A vela é formada de parafina sólida, tendo dentro de si um barbante. A parafina é uma
substância formada só de carbono e de hidrogênio. As moléculas de parafina usadas na
fabricação de velas têm de 20 a 30 átomos de carbono. Esses átomos estão ligados uns
aos outros, formando uma cadeia muito longa. Quando o barbante se aproxima da chama
de um palito de fósforo, ele começa a se queimar. Nessa queima, há liberação de calor
provocando a fusão da parafina. Por sua vez, a parafina líquida sobe pela capilaridade do
barbante e encontra a chama do pavio. Nessa região, a parafina vaporiza-se.
Mas como isso está acontecendo dentro da chama, onde o oxigênio do ar não tem acesso,
a parafina não se queima. Os vapores de parafina (cadeia longa de átomos) recebem a
energia da chama e se quebram em pedaços pequenos, muito energéticos. Esses
pedaços bastante energéticos podem se chocar entre si, formando a fuligem. O choque
entre as partículas energéticas libera luz, que é a chama da vela. Essas partículas
energéticas podem se chocar com as moléculas de oxigênio do ar que estão ao redor e
formar ligações com o oxigênio, até se chegar à formação de gás carbônico e água, que
são substâncias que não reagem mais com o oxigênio.
Quando observamos uma lâmpada incandescente, percebemos que a luz
produzida é branco-amarelada e, dificilmente, conseguimos ver outras
cores. Já a observação da chama de uma vela pode nos revelar que a luz
emitida por ela possui cores diferentes.
Cada uma dessas regiões da chama, apresenta uma temperatura diferente, observe:
Cores
Temperatura
Castanho
520 oC a 650 oC
Vermelho
650 oC a 1.050 oC
Amarelo
1.050 oC a 1.250 oC
Branco/azulado
acima de 1.250 oC
INDICAÇÕES
Neste tema, você passou a dominar mais sobre o assunto “fogo” e como ocorrem as
reações de combustão. Agora, consulte as sugestões a seguir, e veja como o homem
evoluiu e a humanidade se transformou com o domínio do fogo.
A primeira indicação de leitura é um texto que discute como o domínio do fogo
possibilitou início da “boemia” na pré-história. O estudo sugere que as conversas à beira
da fogueira proporcionaram a interatividade entre os humanos.
Link de acesso: disponível em http://oglobo.globo.com/sociedade/ciencia/dominio-dofogo-possibilitou-inicio-da-boemia-na-pre-historia-diz-estudo-antropologico-14016031
O texto “O homem e o fogo”, de autoria de Manuela Musitano, narra a descoberta, o
domínio e a propagação do fogo pelo homem. O texto está publicado no site da
Fundação Oswaldo Cruz (Fiocruz) cuja indicação está no Portal EJ@, nas Indicações
de Texto da Biblioteca Digital da área de CNII/CN. Segue o link de acesso disponível
em:
http://www.eja.educacao.org.br/bibliotecadigital/indicacoes/textos_site/Lists/Texto/Disp
Form.aspx?ID=228&Source=http%3A%2F%2Fwww%2Eeja%2Eeducacao%2Eorg%2E
br%2Fbibliotecadigital%2Findicacoes%2Ftextos%5Fsite%2FLists%2FTexto%2FAllIte
ms%2Easpx%3FPaged%3DTRUE%26p%5FTitle%3DGeometria%2520%252d%2520
Defini%25c3%25a7%25c3%25a3o%2520de%2520pol%25c3%25adgono%26p%5FID
%3D132%26View%3D%257b56C95A5C%252d0AF4%252d4424%252d98BC%252d0
53C85A95791%257d%26PageFirstRow%3D101
A indicação a seguir, é um vídeo de orientação sobre o uso seguro de velas,
disponibilizado no site do Corpo de bombeiros do Estado de São Paulo. Segue o link
disponível em: http://corpodebombeiros.sp.gov.br/emb5/?page_id=1566
REFERÊNCIAS
ALUNOS
ONLINE.
Reação
de
combustão.
Disponível
em:
<http://alunosonline.uol.com.br/quimica/reacao-combustao.html>. Acesso em: 1 mar.
2016. 9h30min.
BRASIL
ESCOLA.
Chama
de
uma
vela.
Disponível
em:
<http://educador.brasilescola.uol.com.br/estrategias-ensino/qual-estado-fisicofogo.htm>. Acesso em: 3 mar. 2016. 15h40min.
DINIZ Simone. A resistência do fogo. Jornal Re-Ação, n° 7, Instituto de Química, USP.
1995.
DINIZ Simone. A resistência do fogo. Jornal Re-Ação, n° 8, Instituto de Química, USP.
1995.
ISUYAMA Reiko. Curso de Capacitação de Professores de Química da Secretaria
do Estado de São Paulo. Instituto de Química, USP. 1998.
OLIVEIRA Adilson de. A descoberta que mudou a humanidade. Ciência Hoje.
Disponível em: <http://cienciahoje.uol.com.br/colunas/fisica-sem-misterio/a-descobertaque-mudou-a-humanidade>. Acesso em: 1 mar. 2016. 10h15min.
GABARITO
Explicação da experiência – A resistência do fogo
O que aconteceu quando você colocou a pastilha de antiácido na água? Você deve ter
reparado que o fogo no algodão apagou mais rapidamente. Isto aconteceu porque
dentro do antiácido existem substâncias, como o bicarbonato de sódio, que reagem com
o ácido cítrico (presente na pastilha) formando o ácido carbônico. Essa substância é
instável e se decompõe em água e dióxido de carbono, assim:
Figura 12 – Reação entre o antiácido e a água
Fonte: Jornal Re-Ação
O gás formado “ocupa” o lugar do oxigênio (que é comburente) apagando a chama.
Desta forma, você criou um extintor de incêndio!
Antes de explicar o que aconteceu na segunda parte da experiência, vamos entender
como funciona a vela: a chama aquece a parte de cima da vela e derrete a parafina. O
pavio da vela puxa a parafina líquida para cima, para o meio da chama. Experimente
encostar um barbante de algodão na água para ver como ela sobe pelo barbante. A
parafina vaporiza-se e são os vapores que queimam.
Figura 13: Experiência com a chama da vela
Fonte: Jornal Re-Ação, USP
Você deve ter observado que ao colocar o fio de cobre frio em volta da vela, ela apagou.
Isto aconteceu porque o cobre é um metal que conduz facilmente o calor. O cobre
absorveu o calor do vapor da parafina da vela. A parafina esfria e sua temperatura ficou
abaixo da temperatura de ignição, por isso, a vela apaga. Quando você esquentou o
cobre não aconteceu nada porque ele não retirou o calor da chama.
Você apagou o fogo de outra maneira, retirando o calor que estava perto. Então, lembrese: só há fogo na presença de combustível, calor e oxigênio!
Fonte: Simone Diniz, Jornal Re-Ação, n° 8, 1995. Adaptado.