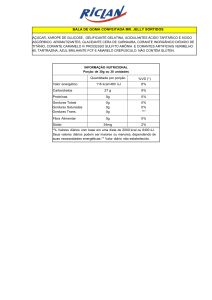
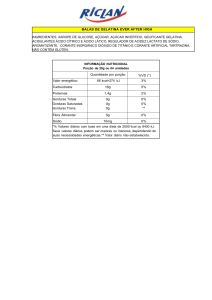
CENTRO FEDERAL DE EDUCAÇÃO TECNOLÓGICA DE MINAS GERAIS
CAMPUS TIMÓTEO
Corante azo
Contexto temático: Substituição eletrofílica de aromáticos
Assuntos abordados: Preparo do sal de diazônio; acoplamento azo; recristalização, cromatografia TLC.
Elaboração: Prof. Armin Isenmann.
Objetivo: Síntese e purificação de um corante orgânico a partir de um sal de diazônio.
Introdução teórica
Os corantes sintéticos são compostos de grande importância nas indústrias de cosméticos,
farmacêutica, plásticos e resinas, tintas e vernizes, tecelagem e vários outros segmentos. A obtenção
de um corante pode envolver várias reações químicas, sendo o processo total resultante da reação
entre intermediários obtidos em cada uma das etapas ("síntese convergente").
Dentre os corantes se destacam os compostos azo, por ser a classe mais diversificada e, também,
ser a economicamente mais importante. O grupo funcional azo, -N=N-, é considerado sendo o
cromóforo. A intensidade da sua absorção e também as tonalidades da cor variam de acordo com os
demais elétrons π e n que estão em conjugação este grupo. O sistema conjugado mais importante,
certamente é formado por dois núcleos aromáticos: Ar-N=N-Ar´. Estes compostos apresentam
coloração bastante intensa, o que os torna corantes de grande utilidade industrial. O campo principal
dos corantes azo é a coloração têxtil.
Os núcleos aromáticos podem apresentar deferentes grupos funcionais ("auxocrómicos"),
atendendo a finalidade da sua utilização. Em bebidas, por exemplo, o corante requer grupos polares
em sua estrutura (hidroxila, carboxila, grupo sulfônico), na tintura de algodão se têm de preferência
grupos básicos, em cima da lã se prefere grupos ácidos, etc. Já a indústria de produção de óleos e
margarinas necessita de corantes pouco polares (= lipofílicos). A carmoisina, representada no
esquema a seguir, é um corante utilizado na indústria alimentícia.
Em laboratório de Química Analítica também é comum a utilização de corantes como indicador
ácido-base. Um exemplo é o "Vermelho de metila", cuja mudança de cor ocorre no intervalo de pH
4,2 - 6,3 (vermelho ou amarelo). Note que a sensibilidade
á acidez do ambiente é especialmente pronunciada quando um anel aromático dispõe de um grupo
auxocrómico que é retirador de elétrons, e o outro anel um doador de elétrons.
SO3Na
COOH
N N
Carmoisina
OH
SO3Na
N N
Vermelho de metila
N(CH3)2
Os compostos azo são obtidos através de uma reação de acoplamento que faz parte da família da
substituição eletrofílica (SE). Os reagentes são um sal de diazônio aromático que representa o
eletrófilo (E+) e um composto aromático ativado, sob condições selecionadas, temperatura baixa e
um ambiente aquoso de pH moderado. Os sais de diazônio, por sua vez, resultam da reação entre
aminas primárias e o ácido nitroso (HNO2). Os sais a partir de aminas aromáticas primárias são
especialmente estáveis a 0°C.
N2+ Cl-
OH
N
N
+
OH
- HCl
Nesta prática será realizada a síntese de um corante (azobenzeno), utilizando-se o cloreto de
anilíno e o 2-naftol. Todas as etapas do procedimento deverão ser conduzidas em banho de gelo,
devido à baixa estabilidade do sal de diazônio em temperatura ambiente (decomposição).
Atenção: O corante produzido mancha sua roupa!
Parte prática
Temos três partes preparativas: a purificação da anilina, síntese do sal de diazônio e o acoplamento
azo com 2-naftol.
Purificação da anilina
A anilina pura é um líquido quase incolor. A coloração avermelhada até preta é provocada pelas
impurezas provenientes da sua produção, da auto-oxidação ou da sua auto-polimerização. Esperamse benzaldeído, nitrobenzeno e compostos contendo enxofre, sendo as impurezas principais.
a) Tratar 10 mL de anilina com 15 mL de HCl comercial (d = 1,1 ; 20% w/w) num
Erlenmeyer. Misture bem com o bastão de vidro.
b) Tratar a solução aquosa com uma espátula de carvão ativado.
c) Aquecer por 5 minutos. Filtrar a quente pelo filtro pregueado.
d) Deixar no freezer para precipitação do cloreto de anilínio. Filtrar pelo funil de Büchner.
Lavar o resíduo sólido com três porções de 10 mL de dietiléter gelado.
e) Secar o sólido na estufa a 80 °C.
Teste de pureza pelo ponto de fusão (Literatura: Tfus = 196 - 198 °C).
Preparo do sal de diazônio
a) Em um béquer de 50 mL, coloque 0,7g de cloreto de anilínio e 6,5 mL de água destilada com 5
a 10 gotas de HCl comercial (solução 1). Resfrie a mistura em banho de gelo, agitando
continuamente com o bastão de vidro durante 5 minutos.
b) Em outro béquer de 50 mL, prepare uma solução de 0,3g de nitrito de sódio em 6,5 mL de água
destilada (solução 2).
c) Adicione o conteúdo da solução 2 sobre o béquer contendo a solução 1. A solução resultante
(solução 3) deverá ser mantida em banho de gelo até o momento de sua utilização, na etapa
seguinte (item a baixo).
Preparo do corante
a) Em um béquer de 50 mL,dissolva 0,9g de 2-naftol e 0,5g de hidróxido de sódio em 6,5 mL de
água destilada (solução 4).Resfrie a mistura em banho de gelo.
b) Adicione solução 4 ao béquer contendo a solução 3, mantendo a mistura sob banho de gelo e
agitação constante por 15 minutos.
c) Filtre o corante (filtração a vácuo em funil de Büchner) e reserve pequena quantidade para ser
utilizada na cromatografia em camada delgada.
Havendo tempo disponível, o corante obtido poderá ser recristalizado em mistura etanol/água,
sendo a quantidade de solventes determinada experimentalmente.
Análise cromatográfica
a) Em um vidro de penicilina, dissolva pequena quantidade de corante em 1,0mL de etanol. Faça o
mesmo para o corante não-recristalizado.
b) Aplique as soluções em placa cromatográfica, com auxílio de capilares preparados para
cromatografia em camada delgada.
c) Espere secar e coloque a placa em uma cuba cromatográfica contendo a mistura eluente
(hexeno/éter dietílico, 9:1). Após o término da eluição, retire a placa de dentro da cuba, marque
com um lápis (não caneta!) a distância percorrida pelo solvente e deixe a placa sobre a bancada
para evaporação do solvente. Em seguida, observe a placa em câmara de luz ultravioleta. Faça
um desenho da placa cromatográfica revelada.
Materiais e reagentes
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Balança;
Bastão de vidro;
Bomba de vácuo;
Capilar para cromatografia ;
Cápsula de porcelana;
Cuba cromatografia;
Erlenmeyer de 100 mL
Funil de separação 200 mL
Funil de Büchner;
Kitassato;
Lâmpada ultravioleta;
Papel-filtro;
Placa aquecedora;
Placas cromatográficas de sílica;
Proveta de 10mL;
3 béqueres de 50mL;
Vidro d relógio ;
Álcool etílico 20mL;
Cloreto de anilínio 0,7g;
2-naftol 0,9g;
2 vidros de penicilina;
Éter dietílico 10 mL;
Gelo;
Hidróxido de sódio 0,5g;
Hexano 20mL;
Nitrito de sódio, NaNO2, 0,3g;
Questões
1) A última etapa da purificação da anilina foi uma recristalização. Qual é o princípio fisicoquímico da recristalização? Quais outros métodos existem para executar a recristalização?
2) Anote as vantagens de usar o cloreto de anilínio, em vez da anilina livre, no preparo do sal
de diazônio.
3) Foi afirmado, na introdução do texto, que a reação entre uma amina primaria e o ácido
nitroso resulta na formação de um sal de diazônio. Entretanto, na prática, utilizou-se cloreto
de anilínio e nitrito de sódio. Formule a reação ácido-base.
4) Elabore o mecanismo da formação do sal de diazônio.
5) Mostre como o alaranjado-de-metila pode ser sintetizado, a partir da anilina.
6) O 4-(N,N-dimetilaminofenil)azobenzeno, composto amarelo, foi largamente utilizado para
colorir manteiga e margarina, até que se descobriram suas propriedades carcionogênicas.
Mostre como este composto pode ser preparado a partir da anilina.
Na+ -O3S
4-(N,N-dimetilaminofenil)azobenzeno
N N
N N
Laranjado
de metila
N(CH3)2
N(CH3)2
7) Explique por que ambas as etapas da síntese devem ser realizadas em banho de gelo.
8) No texto foi mencionado o acoplamento que requer "um composto aromático ativado".
Explique o significado de "ativado" numa SE. O 2-naftol em si já é um composto ativado.
Nesta prática foi tratado com NaOH que aumentou mais uma vez sua reatividade. Explique.
9) A reação de substituição eletrofílica entre o cloreto de fenildiazônio e o 2-naftol resulta na
formação do 1-(fenilazo)-2-naftol, como produto principal. Explique, a base da estabilidade
do complexo σ, por que esta substituição ocorre preferencialmente no carbono 1 do 2-naftol.
REFERÊNCIA BIBLIOGRÁFICA
• A. Isenmann, Princípios da síntese orgânica. Aromáticos (Cap. 4.2.1.) e Síntese e reações
dos Compostos aromáticos contendo o grupo N2 (Cap. 11.1); disponível no site
http://www.timoteo.cefetmg.br/site/sobre/cursos/quimica/repositorio/livros/
• A. Isenmann, Corantes. A química dos corantes azo (Cap. 4.4); disponível no site
http://www.timoteo.cefetmg.br/site/sobre/cursos/quimica/repositorio/livros/