4º
Q144vl
M
A
06/11/2007
Esta prova contém 10 questões.
PF – INSTRUÇÕES:
Verifique se sua prova está completa.
Preencha corretamente todos os dados solicitados no cartão de respostas.
Cartões com rasuras ou incompletos serão invalidados.
Em caso de dúvida, chame o responsável pela sala.
Utilize os espaços em branco para rascunho.
Duração da prova: 50 minutos.
Guarde esta prova. Ela poderá ser utilizada como material de aula.
Questões com crédito de vestibular podem ter sido alteradas em sua redação ou dados.
Boa prova!
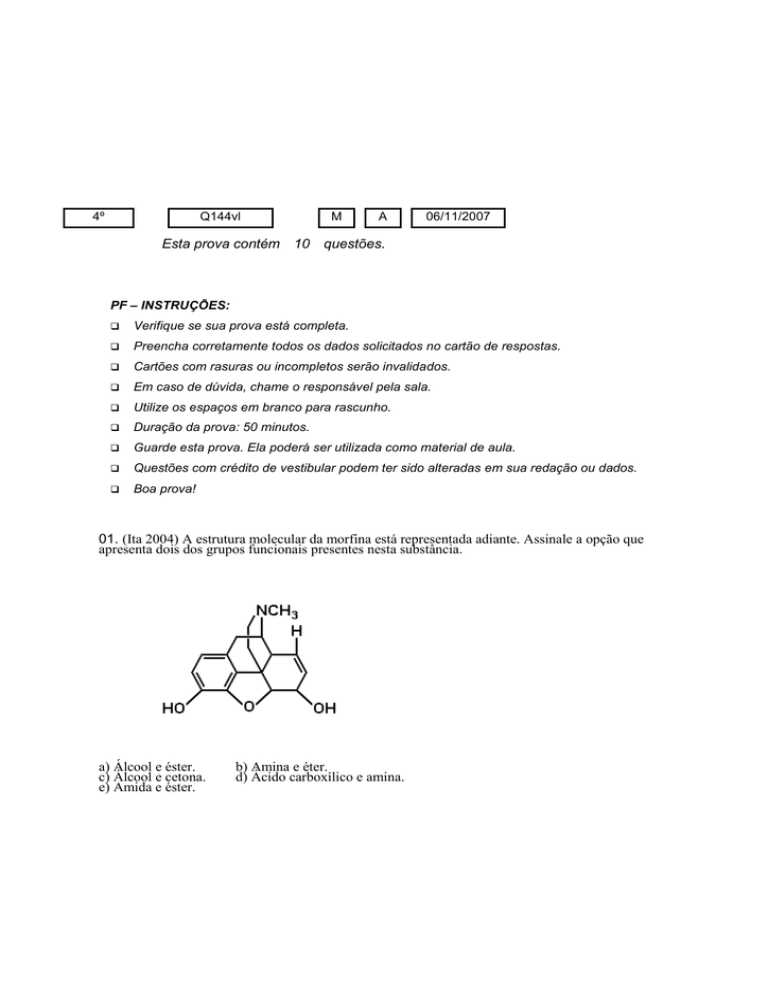
01. (Ita 2004) A estrutura molecular da morfina está representada adiante. Assinale a opção que
apresenta dois dos grupos funcionais presentes nesta substância.
a) Álcool e éster.
c) Álcool e cetona.
e) Amida e éster.
b) Amina e éter.
d) Ácido carboxílico e amina.
02. (Unesp 2004) Durante a guerra do Vietnã (década de 60 do século passado), foi usado um
composto chamado agente laranja (ou 2,4-D) que, atuando como desfolhante das árvores, impedia que
os soldados vietnamitas (os vietcongues) se ocultassem nas florestas durante os ataques dos
bombardeiros. Esse material continha uma impureza, resultante do processo de sua fabricação,
altamente cancerígena, chamada dioxina. As fórmulas estruturais para estes compostos são
apresentadas a seguir.
Esses compostos apresentam em comum as funções:
a) amina e ácido carboxílico.
b) ácido carboxílico e amida.
c) éter e haleto orgânico.
d) cetona e aldeído.
e) haleto orgânico e amida.
03. (Ufpi 2001) Os aromas da banana e do abacaxi estão relacionados com as estruturas dos dois
ésteres dados a seguir. Escolha a alternativa que apresenta os nomes oficiais das duas substâncias
orgânicas.
a) Acetilpentanoato e Etilbutanoato
b) Etanoato de pentila e Butanoato de etila
c) Pentanoato de etila e Etanoato de butila
d) Pentanoato de acetila e Etanoato de butanoíla
e) Acetato de pentanoíla e Butanoato de acetila
04. Dada a equação termoquímica:
S(s) + O2(g)
SO2(g)
∆H = -72 kcal
Na formação de 160 g de dióxido de enxofre:
a)
b)
c)
d)
Há a liberação de 72 kcal, pois a reação é exotérmica.
Há absorção de 72 kcal, pois a reação é endotérmica.
Não há troca de calor, pois a reação é atérmica.
Há desprendimento de 180 kcal, pois a reação é exotérmica.
e) Há absorção de 180 kcal, pois a reação é endotérmica.
05. A combustão da grafita pode ser dado pela seguinte equação:
C(graf)
+
O2(g)
CO 2(g)
∆H = -394 kJ/mol
A queima de 3 g de grafite envolverá:
a)
b)
c)
d)
e)
absorção de 197 kJ
absorção de 98,5 kJ
liberação de 1576 kJ
liberação de 197 kJ
liberação de 98,5 kJ
06. A entalpia de formação do metanol líquido e a do metanol gasoso valem,
respectivamente, - 239 kJ/mol e –201 kJ/mol . De acordo com a equação
CH3OH (g)
CH3OH (l)
a entalpia de liquefação do metanol valerá:
a)
b)
c)
d)
e)
–38 kJ/mol
+38 kJ/mol
–440 kJ/mol
+440 kJ/mol
–220 kJ/mol
07. Coletou-se água do rio Tietê, na cidade de São Paulo. Para oxidar completamente toda
a matéria orgânica contida em 1,00 litro dessa amostra, microorganismos consumiram 48,0
mg do oxigênio(O2 ). Admitindo que a matéria orgânica possa ser representada por C6H10O5
e sabendo que sua oxidação completa produz CO2 e H2O, qual a massa de matéria orgânica
por litro de água do rio?
Dados: C = 12 u , O = 16 u , H = 1 u .
a) 20,5 mg
b)40,5 mg
c) 80,0 mg
d)160 mg e) 200 mg
08. Combustível e importante na obtenção de amônia e compostos saturados o hidrogênio
pode ser obtido pela reação:
NaH(s) + H2O(l)
NaOH(aq) + H2 (g)
Quantos litros do gás nas condições ambiente, podem ser obtidos pela hidrólise de 60,0 g
de hidreto de sódio?
Dados: volume molar, nas condições ambiente = 24,5 l/mol ; massa molar do NaH = 24
g/mol
a) 61,2
b) 49,0
c) 44,8
d) 36,8
e) 33,6
09. Amônia é preparada industrialmente pela reação:
N2(g) + 3 H2(g)
2 NH3(g)
Se uma indústria pretende transformar em amônia o seu estoque de 1 400 kg de nitrogênio,
quantos quilogramas de hidrogênio serão consumidos?
Dados : massas molares (g/mol): N2 = 28 e H2 = 2.
a) 100 kg b) 300 kg c) 400 kg d) 800 kg e) 1 500 kg
10. Um paciente que sofre de úlcera duodenal pode apresentar no suco gástrico HCl
suficiente para formar solução 0,08 mol/l de HCl. Supondo que o estômago do paciente
receba 3,0 litros de suco gástrico por dia, quantos comprimidos contendo 2,08 g Al(OH)3
devem ser ingeridos para neutralizar todo o HCl?
Dado: massa molar do Al(OH)3 = 78 g/mol.
a) 1 b) 6
c)3
d)2
e)4












