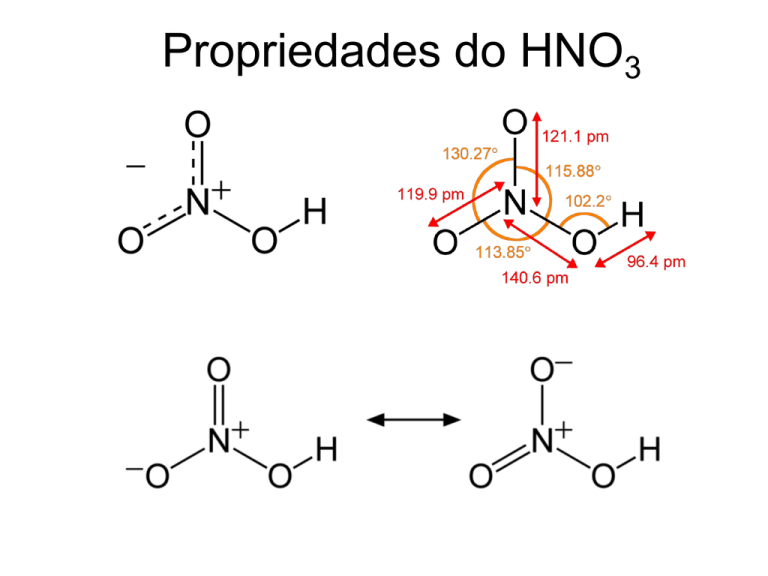
Propriedades do HNO3
Propriedades do HNO3
Em escala industrial, essa síntese é feita em pressões reduzidas para
diminuir a quantidade de óxido de nitrogênio (NO2).
O ácido nítrico é feito pela reação do dióxido de nitrogênio com água:
3 NO2(g) + H2O → 2 HNO3(aq) + NO(g)
Normalmente, o NO é produzido e oxidado rapidamente pelo oxigênio
do ar para produzir uma quantidade adicional de NO2.
NO2 encontra-se normalmente em equilíbrio com o N2O4 em fase
gasosa:
NO2
Gás marrom
N 2 O4
Gás incolor
Propriedades do HNO3
No laboratório, o ácido nítrico pode ser
preparado pela reação entre nitrato de
cobre (II) ou um sal de nitrato com ácido
sulfúrico concentrado (H2SO4). Destila-se a
mistura no ponto de ebulição do ácido
nítrico (83°C) até um sólido branco
cristalino de hidrogeno sulfato ser
observado no vaso reacional.
H2SO4 + NO3- → HSO−4(s) + HNO3(g)
Propriedades do HNO3
Propriedades ácidas
Sendo um ácido típico, o ácido nítrico reage
com álcalis, óxidos básicos e carbonatos para
formar sais, como o nitrato de amônio.
O ácido nítrico não participa de reações com
metais, pois ele dificilmente doa seu próton.
Propriedades do HNO3
Reações com não-metais
Reage com esses elementos oxidando-os aos
seus estados de oxidação mais elevados, com
formação de óxido de nitrogênio e dióxido de
nitrogênio, dependendo da sua concentração
em solução.
C + 4 HNO3 (CONC.) → CO2 + 4 NO2 + 2 H2O
ou
3 C + 4 HNO3 (DILUÍDO) → 3 CO2 + 4 NO + 2 H2O
Propriedades do HNO3
Propriedades oxidantes:
O mesmo ocorre na reação com metais.
Usando-se ácido nítrico concentrado:
Cu + 4 H+ + 2 NO3− → Cu 2+ + 2 NO2 + 2 H2O
Usando-se ácido nítrico diluído:
3 Cu + 8 HNO3 → Cu(NO3)2 + 2 NO + 4 H2O
2 NO + 3 O2 → 2 NO2
Somente metais com baixas E.I. reagem com o ácido
nítrico:
Mg (s) + 2 HNO3 (aq) → Mg(NO3)2 (aq) + H2 (g)
Propriedades do HNO3
Reação do enxofre com HNO3
S8(s) + 2 HNO3(aq) → 2 H+(aq) + SO42-(aq) + 2 NO(aq)
Reação paralela:
NO + O2 → 2 NO2
Pequenas quantidades de NO2 também são
formadas junto com NO.
Propriedades do HNO3
Formação do ácido nítrico:
NaNO3 + H2SO4 → HNO3 + NaHSO4
Reação paralela:
HNO3(aq) → 4 NO2(g) + O2(g) + 2 H2O
Forma mais completa:
4 NO3-(aq) + 2 H2SO4(aq) → 4 NO2 + O2 +
2SO42- + 2 H2O
Propriedades do HNO3
Reação com sulfato ferroso:
Como todos os sais de Fe(II), o sulfato ferroso é um
agente redutor. Ele reduz o ácido nítrico a oxido
nitroso:
6 Fe2+ + 6 H+ +2 HNO3→ 6 Fe3+ + 4 H2O +2 NO
As reações paralelas do NO, descritas anteriormente,
também devem ser consideradas.
Reações de outros compostos
nitrogenados
1- Cloreto de amônio com hidróxido de potássio:
NH4Cl + KOH → NH3 + KCl + H20
2- Cloreto de amônio e nitrato de sódio:
NH4Cl + NaNO3 → NaCl + N2 + 2 H20
Reações paralelas:
NH4+ + OH- → NH3 + H20
NH4NO3 → N2 + H2O
Reações de outros compostos
nitrogenados
3- Cloreto de amônio e nitrito de sódio
NH4Cl + NaNO2 → NaCl + {NH4NO2}
NH4NO2 → N2 + 2H20 (sob aquecimento essa
reação é rápida)
Reações de outros compostos
nitrogenados
4- Cloreto de amônio e hidróxido de cálcio
2NH4Cl(s) + Ca(OH)2(s) → CaCl2(s) + 2NH3(g)
+ 2H2O (g)
NH3(g) + H2O(l) → NH4+(aq) + OH–(aq)
(O meio torna-se básico, detectado, por
exemplo, por fenolftaleína em sistema
fechado).
Reações de outros compostos
nitrogenados
5- NH4SO4 + NaOH → NaNH4 + H2O + NH3
6- H2SO4 + NaNO2 → 2 NaHSO4 + {HNO2}
HNO2 → NO2 + NO + H2O