REAÇÃO DE ESTERIFICAÇÃO DO ALGINATO DE SÓDIO ATRAVÉS DO
MÉTODO INICIADO POR MICROONDAS
J. M. C. da Feira; M. M. C. Forte; J. M. Klein; P. L. dos. Santos
Universidade Federal do Rio Grande do Sul - Escola de Engenharia/LAPOL/PPGEM
CP 15010, 91501-970 Porto Alegre/RS. [email protected], [email protected]
RESUMO
Polímeros biodegradáveis têm sido estudados na substituição de materiais
sintéticos, que causam impacto sobre o meio ambiente. Dentre estes polímeros
podemos citar o alginato de sódio que é um biopolímero polieletrólito,
biocompatível, atóxico, não mutagênico, biodegradável e de fonte renovável
obtido de algas marrons ou bactérias. Estes polímeros naturais possuem
algumas desvantagens, tais como caráter hidrofílico e baixa resistência
mecânica. Para contornar estes problemas tem-se desenvolvido matrizes
quimicamente modificadas através da esterificação dos grupos hidroxila do
alginato com ácidos orgânicos, resultando em materiais com propriedades mais
estáveis. O objetivo deste trabalho foi avaliar a estrutura do éster de alginato
através do comportamento térmico deste em função da variação da
temperatura. Os produtos obtidos foram caracterizados por técnicas de FTIR e
TGA. A esterificação foi verificada através do aparecimento de carbonilas do
éster, sendo este menos estável termicamente do que o alginato que degrada
em torno de 325C.
Palavras chaves: Alginato de sódio, Esterificação, Micro-ondas, Modificação,
Polissacarídeos.
INTRODUÇÃO
Os polissacarídeos são uma classe de carboidratos de polímeros naturais
e têm sido amplamente utilizados na indústria de alimentos como agente de
gelificação e na indústria farmacêutica como matriz no encapsulamento de
células vivas e para sistemas de liberação controlada de drogas(1).
Polímeros biodegradáveis, como polissacarídeos, têm sido estudados
com o objetivo de utilizá-los na substituição de materiais sintéticos tradicionais,
que causam grande impacto sobre o meio ambiente. Dentre estes polímeros
podemos citar o alginato de sódio que é um polissacarídeo linear obtido a partir
de algas marrons ou bactérias e é composto por resíduos dos ácidos -Dmanurônico e -L-gulurônico na forma de sal de sódio, unidos por ligações
glicosídicas (14) e distribuídos em diferentes proporções ao longo da cadeia.
Apesar das vantagens já citadas acima, muitos polímeros naturais têm
algumas desvantagens inerentes, tais como pobre resistência mecânica e
contaminação microbiana. Para superar estes problemas tem-se feito esforços
para desenvolver matrizes quimicamente modificadas pela combinação dos
polímeros naturais com os monômeros sintéticos(2).
O alginato contém grupos hidroxilas e carboxílicos livres distribuídos ao
longo da cadeia, sendo, portanto um candidato ideal para a funcionalização
química,
podendo
estes
modificar
propriedades
como
solubilidade,
hidrofobicidade e características físico-químicas e biológicas. A modificação
química do alginato tem sido realizada pelo uso de técnicas como: sulfatação,
esterificação, amidação ou métodos de grafting, sendo que os derivados destes
têm demonstrado um grande potencial de aplicação(3).
Reações químicas ativadas por radiação micro-ondas têm se tornado um
método muito promissor para obtenção de novos materiais, cujos experimentos
têm sido realizado em forno micro-ondas doméstico ou em reatores específicos
para esta finalidade(4).
O objetivo deste trabalho foi avaliar o efeito do tratamento térmico,
utilizado na obtenção do éster, na estrutura química do alginato de sódio
esterificado
através da
avaliação
da
estabilidade
térmica
deste
por
termogravimétrica (TGA).
MATERIAIS E MÉTODOS
Materiais
Neste trabalho foi utilizado alginato de sódio de média viscosidade e ácido
maleico fornecido pela VETEC, hidróxido de sódio e ácido clorídrico (F. MAIA),
cetona (NEON) e etanol da (ECIBRA). Todos os reagentes usados foram de
grau analítico e sem prévia purificação. A síntese do éster de alginato foi feita
através de uma adaptação do método iniciado por micro-ondas descrito pelo
RAJAN e colab. (5) substituindo a enzima pelo ácido maleico.
Análise Termogravimétrica – TGA
Os ensaios de análise térmica do alginato de sódio e do alginato
esterificado foram realizadas em um aparelho da TA Instruments modelo 2050,
sob atmosfera de nitrogênio no intervalo de temperatura de 25°C a 1000°C com
taxa de aquecimento de 20°C min-1.
Espectroscopia de Infravermelho – FTIR
Espectros de Infravermelho das amostras do alginato de sódio, e dos
compostos modificados quimicamente por reação de esterificação foram
obtidas num Espectrofotômetro FTIR Spectrum 1000 da Perkim Elmer na
região de 4000 a 400 cm-1 com resolução de 4 cm-1. As amostras foram
analisadas na forma de pastilhas com KBr (1,0%).
RESULTADOS E DISCUSSÃO
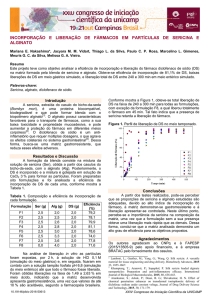
A estabilidade térmica do alginato de sódio e dos derivados com ácido
maleico pode ser avaliada comparativamente pelos termogramas apresentados
na Figura 1 (a) e (b). Para o alginato de sódio observa-se uma perda de massa
de 8,7% em torno de 100°C, devido à evaporação de água, já que este tem
caráter hidrofílico e hidrata com facilidade. A degradação máxima do alginato
ocorre ao redor de 325°C, devido aos processos complexos incluindo
desidratação das cadeias sacarídicas, despolimerização com formação de
água, dióxido de carbono, metano e degradação do sal do ácido algínico com
perda de massa de 39,7%, conforme já descrito por ISIKLAN
(6).
Verifica-se que
após a esterificação do alginato ainda existe massa relativa a água de
hidratação, o qual foi atribuído a eliminação de água adsorvida na estrutura do
alginato modificado.
A temperatura de degradação máxima do alginato esterificado passa a
ser inferior a 325C, ficando esta na faixa de 158C - 317C com o aumento da
concentração de ácido maleico. Podendo-se assim concluir que a redução da
estabilidade térmica do alginato modificado é devido à inserção das cadeias de
ácido maleico na estrutura molecular do alginato durante a reação de
esterificação, conforme resultados encontrados por ISKLAN e Colab.
(6),
que
estudaram a estabilidade térmica do alginato que apresentou degradação
inicial de 248C com redução da temperatura de degradação dos produtos
modificados para 222C sendo esta inferior a observada para o alginato de
sódio puro devido a despolimerização com formação de água, dióxido de
carbono e metano. Isto pode ser atribuído a baixa estabilidade térmica do ácido
como resultado da reação de descarboxilação observada durante este estágio
de degradação.
100
Alginato de sódio
Alginato/Ácido maleico 1:0,2
Alginato/Ácido maleico 1:0,5
Alginato/Ácido maleico 1:1
Alginato/Ácido maleico 1:2
8,7%
Massa (%)
80
60
40
39,7%
20
0
(a) 0
100
200
300
400
500
600
Temperatura (°C)
700
800
900
1000
3,0
158
194
Derivada Massa (%/°C)
2,5
Alginato de sódio
Alginato/Ácido maleico 1:0,2
Alginato/Ácido maleico 1:0,5
Alginato/Ácido maleico 1:1
Alginato/Ácido maleico 1:2
86
2,0
154
86
311
1,5
92
317
1,0
78
325
0,5
70
0,0
(b)
0
200
400
600
800
1000
Temperatura (°C)
Figura 1. Curva de TGA de perda de massa (A) e derivada de perda de massa (B) do alginato
e seus ésteres de alginato nas r.m. A/a 1:0,2; 1;0,5; 1:1 e 1:2 respectivamente.
As condições de reação para a esterificação do alginato (A) com ácido
maleico (a) por micro-ondas, ou seja, a freqüência (2.450 MHz), a potência
(560 W) e o tempo de irradiação, sendo este composto por quatro intervalos
intermitentes de 15 s intercalados por intervalos de 1 min em banho de gelo,
foram estabelecidas após otimização da reação de esterificação, utilizando-se
uma solução contendo os reagentes. Durante a reação de esterificação foi
seguida uma ordem de adição dos reagentes alginato (A) /ácido maleico (a)
com as respectivas razões mássicas 1:0,2; 1:0,5; 1:1 e 1:2 em meio aquoso,
onde esta foi efetiva. Primeiramente foi preparado uma suspensão de alginato
com 25 mL de água deionizada em um becker A, em seguida num becker B foi
preparado a suspensão de ácido maleico com 25 mL de água deionizada. Após
homogeneização das suspensões A e B estas foram adicionadas num becker
C, homogeneizadas e submetidas ao processo de radiação. A radiação foi feita
em intervalos intermitentes para se inibir um superaquecimento do meio
reacional ou da solução e favorecer um melhor rendimento. A esterificação do
alginato de sódio com o ácido maleico foi acompanhada através da análise de
FTIR do produto obtido e esta foi efetiva nas quatro condições de razão
mássica (r.m.) alginato/ácido maleico avaliadas.
A Figura 2 mostra os espectros de FTIR do alginato puro e dos produtos
obtidos em reações com r.m. A/a igual a 1:1, 1:2, 1:0,5 e 1:0,2. Não se
observou variação perceptível das bandas de absorção dos grupamentos
ésteres nos espectros dos produtos obtidos na esterificação do alginato com a
variação das razões mássicas do ácido maleico. Porém, verificou-se a
diminuição da banda de absorção dos grupamentos hidroxilas em 3422 cm -1
devido a reação destes com ácido maleico, e o aparecimento da banda de
absorção relativa aos grupamentos carbonilas de éster de alginato em 1729
cm-1
(6).
O espectro do ácido maleico (b) tem as bandas de absorção
características do estiramento C-H olefínico na região de 1637 cm-1 e 786 cm-1
e a banda de absorção da carbonila na região de 1707 cm -1. A presença destas
bandas presentes nos espectros dos alginatos esterificados (c), (d), (e) e (f)
confirmam a esterificação do alginato com o ácido maleico.
O alginato de sódio (a) apresenta banda intensa de absorção dos grupos
hidroxilas na região de 3422 cm-1, também mostrou bandas de absorção na
região de 2927, 1638, 1414 e 1021 cm-1, indicando respectivamente a vibração
do estiramento alifático da ligação C-H, COO- assimétrico, COO- simétrico e CO, o que são características destes polissacarídeos. Com a esterificação a
banda de absorção dos grupos hidróxilas tende a reduzir em intensidade
devido a diminuição da concentração de pontes de hidrogênio entre os grupos
hidroxilas do polissacarídeo, devido a conversão destes em grupo éster,
conforme já observado por KAPUSNIAK e SIEMON(7).
(f)
786
Transmitância (u.a)
(e)
786
3430
(d)
16371638 1638
3429
822
1707 1707 1727
3429
(c)
787
1729 1637
3432
(b)
786
3422
2922
2927
1707
1637
1638
1220
3422
4000
3500
3000
2500
2000
-1
Número de onda (cm )
(a)
1414
1021
1500
1000
500
Figura 2. Espectros de FTIR do alginato de sódio (a), ácido maleico (b) e produtos da reação
de esterificação com r.m A/a iguais a 1:0,2 (c), 1:0,5 (d), 1:1 (e) e 1:2 (f).
A Figura 3 mostra um esquema de reação com esterificação total dos
grupos hidroxilas do alginato pelo ácido maleico. A quantidade mássica de
ácido maleico máxima utilizada foi duas vezes aquela do alginato de forma a
favorecer a esterificação de duas hidroxilas por unidade repetitiva (mero), já
que o alginato apresenta dois grupos –OH potencialmente reativos por mero,
conforme ilustrado na Fig. 3, e de acordo com já descrito na literatura para
derivados de alginato, com substituição dos dois radicais hidroxílicos ligados
aos carbonos C-2, C-3 da unidade de glicose na molécula do alginato de
sódio(8).
Figura 3. Esquema da reação de esterificação total do alginato pelo ácido maleico.
CONCLUSÕES
O forno de micro-ondas mostrou ser eficiente para a realização da reação
de esterificação catalisada por ácido nas cadeias do alginato. A degradação
máxima do alginato de sódio ocorre ao redor de 325C, devido aos processos
complexos incluindo desidratação das cadeias sacarídicas, despolimerização
com formação de água, dióxido de carbono, metano e degradação do sal do
ácido algínico com perda de massa de 39,7%. Após esterificação do alginato
ainda existe massa relativa à água de hidratação, o qual foi atribuído a
eliminação de água adsorvida na estrutura do alginato modificado. A
temperatura de degradação máxima do alginato esterificado passa a ser
inferior a 325C, ficando esta na faixa de 158C – 317C com o aumento da
concentração de ácido maleico. Podendo-se assim concluir que a redução da
estabilidade térmica do alginato modificado é devido a inserção das cadeias de
ácido maleico na estrutura molecular do alginato durante a reação de
esterificação, visto que este apresenta baixa estabilidade térmica como
resultado da reação de descarboxilação observada durante este estágio de
degradação.
AGRADECIMENTOS
Os autores agradecem ao CNPq e a CAPES pelo apoio financeiro ao projeto.
REFERÊNCIAS
1. ISIKLAN, N.; ERCAN, G.; KURSUN, F.; INAL, M. Ph responsive itaconic acid
grafted alginate microspheres for the controlled release of nifedipine.
Carbohydrate Polymers, v. 84, p. 933-943, 2011.
2. MISHRA, D. K.; BEHARI, K.; SAND, A.; YADAV, M. Modification of alginate
by grafting of N-vinyl-2-pyrrolidone and studies of physicochemical properties in
terms of swelling capacity, metal-ion uptake and flocculation. Carbohydrate
Polymers, v. 80, p. 1147-1154, 2010.
3. YANG, J. S.; XIE, Y. J. ; HE, W. Research progress on chemical modification
of alginate: A review. Carbohydrate Polymers, v. 84, p. 33-39, 2011.
4. PAL, S.; GHOSH, S.; JHA, U. High performance polymeric flocculant based
on hydrolyzed polyacrylamide grafted tamarind kernel polysaccharide (Hyd.
TKP-g-PAM). Bioresource Technology, v. 102, p. 2137-2139, 2011.
5. RAJAN, A.; SUDHA, J. D.; ABRAHAM, T. E. Enzymatic modification of
cassava starch by fungal lipase. Industrial Crops and Products, v. 27, p. 50 59, 2008.
6. ISIKLAN, N.; KURSUN, F.; INAL, M. Graft copolymerization of itaconic acid
onto sodium alginate using benzoyl peroxide. Carbohydrate Polymers, v. 79,
p. 665-672, 2010.
7. KAPUSNIAK, J.; SIEMION, P. Thermal reactions of starch with long-chain
unsaturated fatty acids. Part 2. Linoleic acid. Journal of Food Engineering, v.
78, p. 323-332, 2007.
8. YANG, J. S.; XIE, Y. J. ; HE, W. Research progress on chemical modification
of alginate: A review. Carbohydrate Polymers, v. 84, p. 33-39, 2011.