Lista de Exercícios – Tratamento Sistemático de Equilíbrio
ALGUNS EXERCÍCIOS SÃO DE AUTORIA PRÓPRIA. OS DEMAIS SÃO
ADAPTADOS DE LIVROS CITADOS ABAIXO.
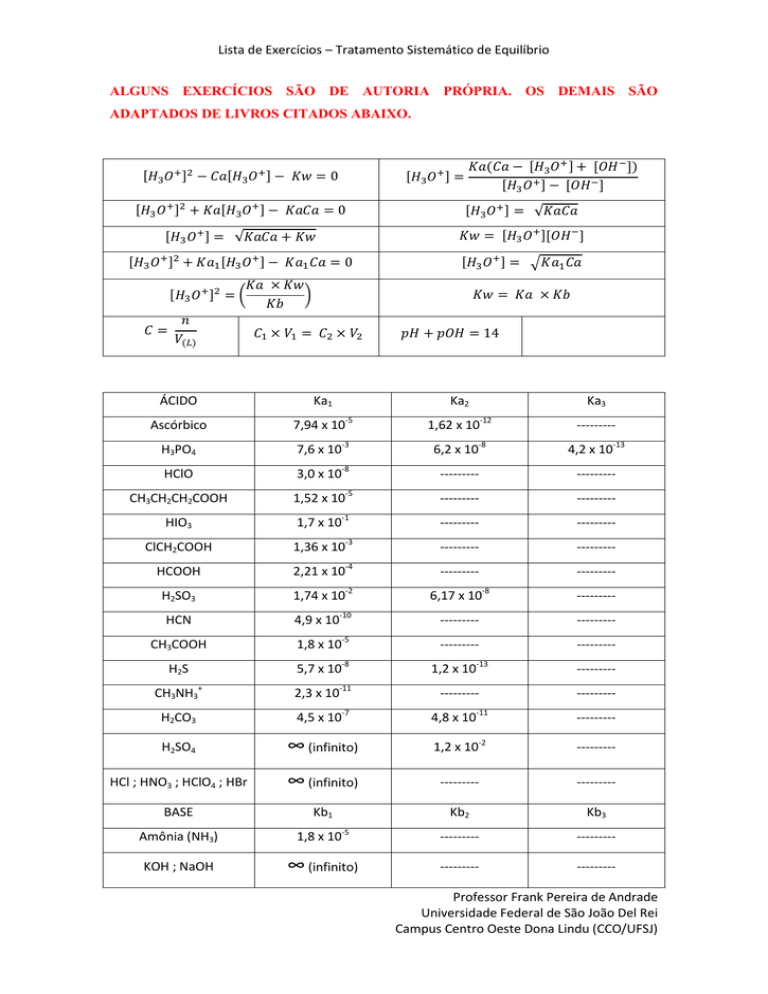
ÁCIDO
Ka1
Ka2
Ka3
Ascórbico
7,94 x 10-5
1,62 x 10-12
---------
H3PO4
7,6 x 10-3
6,2 x 10-8
4,2 x 10-13
HClO
3,0 x 10-8
---------
---------
CH3CH2CH2COOH
1,52 x 10-5
---------
---------
HIO3
1,7 x 10-1
---------
---------
ClCH2COOH
1,36 x 10-3
---------
---------
HCOOH
2,21 x 10-4
---------
---------
H2SO3
1,74 x 10-2
6,17 x 10-8
---------
-10
---------
---------
CH3COOH
1,8 x 10-5
---------
---------
H2S
5,7 x 10-8
1,2 x 10-13
---------
CH3NH3+
2,3 x 10-11
---------
---------
H2CO3
4,5 x 10-7
4,8 x 10-11
---------
H2SO4
∞ (infinito)
1,2 x 10-2
---------
HCl ; HNO3 ; HClO4 ; HBr
∞ (infinito)
---------
---------
BASE
Kb1
Kb2
Kb3
Amônia (NH3)
1,8 x 10-5
---------
---------
KOH ; NaOH
∞ (infinito)
---------
---------
HCN
4,9 x 10
Professor Frank Pereira de Andrade
Universidade Federal de São João Del Rei
Campus Centro Oeste Dona Lindu (CCO/UFSJ)
Lista de Exercícios – Tratamento Sistemático de Equilíbrio
CH3CH2NH2
4,33 x 10-4
---------
---------
(CH3)3NH2
6,3 x 10-5
---------
---------
C6H5NH2
3,99 x 10-10
---------
---------
1 – Calcule o pH das seguintes soluções:
a) HBr 1,0 x 10-3 mol/L
b) HNO3 2,0 x 10-9 mol/L
c) KOH 3,0 x 10-3 mol/L
d) NaOH 4,0 x 10-9 mol/L
Respostas:
a) pH = 3,00
b) pH = 6,996 ≈ 7,00
c) pH = 11,48
d) pH = 7,01
2 – Calcule o pH das seguintes soluções:
a) ácido hipocloroso 0,0300 mol/L
b) ácido butanóico 0,0600 mol/L
c) etilamina 0,100 mol/L
d) trimetilamina 0,200 mol/L
e) ácido cloroacético 0,00001 mol/L
f) metilamina 0,0100 mol/L
g) HIO3 0,200 mol/L
h) felinidrazina 0,100 mol/L
Respostas:
a) pH = 4,52
b) pH = 6,04
c) pH = 11,80
d) pH = 11,55
e) pH = 4,03
f) pH = 11,27
g) pH = 0,93
h) pH = 7,66
3 – Calcule o pH e a concentração de todas as espécies para as seguintes soluções:
a) ácido hipocloroso 5,0 x 10-4 mol/L
b) ácido cianídrico 4,0 x 10-6 mol/L
c) ácido fórmico 2,0 x 10-3 mol/L
d) ácido sulfídrico 0,05 mol/L
e) ácido sulfuroso 0,01 mol/L
Respostas:
a) pH = 5,41 ; [H3O+] = 3,87 x 10-6 M = [ClO-] ; [OH-] = 2,58 x 10-9 M
b) pH = 6,96 ; [H3O+] = 1,09 x 10-7 M ; [HCN] = 4,0 x 10-6 M ; [CN-] =
4,9 x 10-10 M ; [OH-] = 9,14 x 10-8 M
c) pH = 3,25 ; [H3O+] = 5,63 x 10-4 M = [HCOO-] ; [HCOOH] = 1,43 x
10-3 M ; [OH-] = 1,78 x 10-11 M
d) pH = 4,27 ; [H3O+] = 5,34 x 10-5 M = [HS-] ; [H2S] = 0,05 M ; [S2-] =
1,2 x 10-13 M ; [OH-] = 1,87 x 10-10 M
e) pH = 2,15 ; [H3O+] = 7,1 x 10-3 M = [HSO3-] ; [H2SO3] = 2,90 x 10-3
M ; [S2-] = 6,16 x 10-8 M ; [OH-] = 1,41 x 10-12 M
Professor Frank Pereira de Andrade
Universidade Federal de São João Del Rei
Campus Centro Oeste Dona Lindu (CCO/UFSJ)
Lista de Exercícios – Tratamento Sistemático de Equilíbrio
4 – Determine a concentração de todas as espécies presentes em uma solução obtida a
partir da dissolução de 2,0 gramas de vitamina C em 100 mL de água. Dados: MM ácido
ascórbico
= 176,13 g/mol).
Respostas: [H3O+] = 3,003 x 10-3 = [HA-] ; [H2A] = 0,1136 M ; [A2-] = 1,62 x 10-12 M ;
[OH-] = 3,33 x 10-12 M.
5 – Calcule o pH das seguintes soluções:
a) acetato de sódio 0,025 mol/L
b) cloreto de amônio 0,060 mol/L
c) cianeto de potássio 0,010 mol/L
d) hipoclorito de sódio 0,01 mol/L
Respostas:
a) pH = 8,57
b) pH = 5,24
c) pH = 10,82
d) pH = 9,76
Referências
1. Harris, D. C. Explorando a Química Analítica. 4ª ed. LTC – Livros Técnicos e
Científicos Editora, Rio de Janeiro, 2011.
2. Harris, D. C. Análise Química Quantitativa. 6ª ed. LTC – Livros Técnicos e Científicos
Editora, Rio de Janeiro, 2005.
3. Skoog, D. A.; West, D. M.; Holler, F. J.; Crouch, S. R. Fundamentos de Química
Analítica. 8ª ed. Pioneira Thomson Learning, São Paulo, 2006.
Professor Frank Pereira de Andrade
Universidade Federal de São João Del Rei
Campus Centro Oeste Dona Lindu (CCO/UFSJ)