ÍNDICE
QUÍMICA 10.º ANO
I.ELEMENTOS QUÍMICOS E SUA ORGANIZAÇÃO
1.Massa e tamanho dos átomos ............................................................................................... 8
1.1
Ordens de grandeza e escalas de comprimento ............................................................. 8
1.2
Dimensões à escala atómica ........................................................................................... 9
1.3
Massa isotópica e massa atómica relativa média ........................................................... 10
1.4
Quantidade de matéria e massa molar ........................................................................... 10
1.5
Fração molar e fração mássica ....................................................................................... 11
Exercícios para resolver ............................................................................................................ 12
2.Energia dos eletrões nos átomos........................................................................................... 17
2.1
Espetros contínuos e descontínuos.................................................................................. 17
2.2
O modelo atómico de Bohr............................................................................................... 19
2.3
Transições eletrónicas...................................................................................................... 20
2.4
Energia de remoção eletrónica......................................................................................... 22
2.5
Modelo quântico do átomo................................................................................................ 23
2.6
Configuração eletrónica de átomos.................................................................................. 24
Exercícios para resolver............................................................................................................ 26
3.Tabela Periódica...................................................................................................................... 36
3.1
Estrutura da Tabela Periódica.......................................................................................... 36
3.2
Propriedades dos elementos e das substâncias elementares........................................ 37
3.3
Propriedades periódicas dos elementos representativos............................................... 38
Exercícios para resolver............................................................................................................ 42
II.PROPRIEDADES E TRANSFORMAÇÕES DA MATÉRIA
1.Ligação química...................................................................................................................... 48
1.1
Tipos de ligações químicas............................................................................................... 48
1.2
Ligação covalente.............................................................................................................. 49
1.3
Ligações intermoleculares............................................................................................... 57
Exercícios para resolver............................................................................................................ 59
2.Gases e dispersões................................................................................................................. 67
2.1
Lei de Avogadro, volume molar e massa volúmica.......................................................... 67
2.2
Soluções, coloides e suspensões..................................................................................... 68
2.3
Composição quantitativa de soluções.............................................................................. 70
2.4
Diluição de soluções aquosas.......................................................................................... 71
Exercícios para resolver............................................................................................................ 73
3.Transformações químicas....................................................................................................... 78
3.1
Energia de ligação e reações químicas............................................................................ 78
3.2
Reações fotoquímicas na atmosfera................................................................................ 80
Exercícios para resolver............................................................................................................ 84
FÍSICA 10.º ANO
I.ENERGIA E SUA CONSERVAÇÃO
1.Energia e movimentos............................................................................................................ 90
1.1
Energia mecânica e energia interna................................................................................. 90
1.2
Trabalho realizado por forças constantes........................................................................ 91
1.3
Trabalho do peso............................................................................................................... 93
1.4
Conservação da energia mecânica................................................................................... 94
1.5
Teorema da Energia Cinética ou Lei do Trabalho-Energia.............................................. 96
1.6
Forças não conservativas e variação da energia mecânica............................................. 97
1.7
Potência e rendimento...................................................................................................... 99
Exercícios para resolver............................................................................................................ 100
2.Energia e fenómenos elétricos............................................................................................... 113
2.1Relação entre corrente elétrica, diferença de potencial elétrico
e resistência elétrica......................................................................................................... 113
2.2
Resistência elétrica de condutores filiformes.................................................................. 114
2.3
Corrente elétrica............................................................................................................... 115
2.4
Efeito Joule....................................................................................................................... 117
2.5
Geradores de tensão contínua. Balanço energético do circuito...................................... 118
2.6
Associações de resistências em série e em paralelo...................................................... 121
Exercícios para resolver............................................................................................................ 123
CPE_FQ11 © RAIZEDITORA
4
ÍNDICE
3 Energia, fenómenos térmicos e radiação............................................................................... 132
3.1
Sistema termodinâmico.................................................................................................... 132
3.2
Calor.................................................................................................................................. 133
3.3
Radiação e irradiância...................................................................................................... 134
3.4
Radiação solar na produção de energia elétrica.............................................................. 134
3.5
Mecanismos de transferência de calor: condução e convecção...................................... 136
3.6
Condução térmica e condutividade térmica..................................................................... 136
3.7
Capacidade térmica mássica ........................................................................................... 137
3.8
Variação de entalpia de fusão e de vaporização............................................................... 138
3.9
Funcionamento de um coletor solar................................................................................ 140
3.10 Primeira Lei da Termodinâmica.................................................................................... 141
3.11 Segunda Lei da Termodinâmica..................................................................................... 141
Exercícios para resolver............................................................................................................ 142
CPE_FQ11 © RAIZEDITORA
FÍSICA 11.º ANO
I.MECÂNICA
1.Tempo, posição e velocidade................................................................................................... 148
1.1
Referencial e posição. Deslocamento e distância percorrida.......................................... 148
1.2
Rapidez média e velocidade média.................................................................................. 149
1.3
Aceleração média............................................................................................................. 150
Exercícios para resolver............................................................................................................ 153
2.Interações e seus efeitos........................................................................................................ 157
2.1
As quatro interações fundamentais................................................................................. 157
2.2
Terceira Lei de Newton..................................................................................................... 158
2.3
Segunda Lei de Newton.................................................................................................... 159
2.4
Efeitos das foças sobre a velocidade................................................................................ 159
2.5
Primeira Lei de Newton.................................................................................................... 160
2.6
Movimento segundo Aristóteles, Galileu e Newton......................................................... 161
Exercícios para resolver............................................................................................................ 163
3.Forças e movimentos.............................................................................................................. 167
3.1
Movimento de queda e lançamento na vertical com efeito de resistência
do ar desprezável.............................................................................................................. 167
3.2
Movimento de queda com efeito de resistência do ar apreciável.................................... 169
3.3Movimento retilíneo uniforme e uniformemente variado em planos horizontais
e planos inclinados........................................................................................................... 171
3.4
Movimento circular uniforme........................................................................................... 173
Exercícios para resolver............................................................................................................ 177
II.ONDAS E ELETROMAGNETISMO
1.Sinais e ondas......................................................................................................................... 186
1.1
Sinais, propagação de sinais e velocidade de propagação.............................................. 186
1.2
Ondas transversais e ondas longitudinais....................................................................... 186
1.3
Ondas mecânicas e ondas eletromagnéticas................................................................... 187
1.4
Periodicidade temporal e periodicidade espacial............................................................ 187
1.5
O som como onda de pressão........................................................................................... 189
Exercícios para resolver............................................................................................................ 192
2.Eletromagnetismo................................................................................................................... 196
2.1
Campo elétrico.................................................................................................................. 196
2.2
Campo magnético............................................................................................................. 197
2.3
Fluxo magnético e indução eletromagnética................................................................... 199
2.4
Produção industrial e transporte de energia elétrica: geradores e transformadores.... 201
Exercícios para resolver............................................................................................................ 203
3.Ondas eletromagnéticas......................................................................................................... 210
3.1
Espetro eletromagnético.................................................................................................. 210
3.2
Reflexão............................................................................................................................ 211
3.3
Refração............................................................................................................................ 211
3.4
Reflexão total.................................................................................................................... 213
3.5
Difração............................................................................................................................. 215
3.6
Efeito Doppler, desvio para o vermelho e o big-bang....................................................... 217
Exercícios para resolver............................................................................................................ 218
5
ÍNDICE
QUÍMICA 11.º ANO
I.EQUILÍBRIO QUÍMICO
1.Aspetos quantitativos das reações químicas.......................................................................... 224
1.1
Reações químicas............................................................................................................. 224
1.2
Reagente limitante e reagente em excesso..................................................................... 225
1.3
Grau de pureza de uma amostra...................................................................................... 226
1.4
Rendimento de uma reação química................................................................................ 226
1.5
Economia atómica e Química Verde................................................................................. 227
Exercícios para resolver............................................................................................................ 228
2.Equilíbrio químico e extensão das reações químicas............................................................. 231
2.1
Reações incompletas e equilíbrio químico....................................................................... 231
2.2
Extensão das reações químicas....................................................................................... 232
2.3
Fatores que alteram o equilíbrio químico........................................................................ 235
Exercícios para resolver............................................................................................................ 240
II.REAÇÕES EM SISTEMAS AQUOSOS
1.Reações ácido-base................................................................................................................ 247
1.1
Ácidos e bases.................................................................................................................. 247
1.2
Acidez e basicidade de soluções...................................................................................... 248
1.3
Autoionização da água...................................................................................................... 248
1.4
Ácidos e bases em soluções aquosas.............................................................................. 250
1.5
Constantes de acidez e de basicidade.............................................................................. 251
1.6
Titulação ácido-base......................................................................................................... 252
1.7
Aspetos ambientais das reações ácido-base................................................................... 255
Exercícios para resolver............................................................................................................ 257
2.Reações de oxidação-redução................................................................................................ 264
2.1
Caracterização das reações de oxidação-redução........................................................... 264
2.2
Força relativa de oxidantes e redutores........................................................................... 267
Exercícios para resolver............................................................................................................ 268
3.Soluções e equilíbrio de solubilidade..................................................................................... 272
3.1
Mineralização das águas e processo de dissolução......................................................... 272
3.2
Solubilidade de sais em água........................................................................................... 273
3.3
Equilíbrio químico e solubilidade de sais......................................................................... 276
3.4
Alteração da solubilidade dos sais................................................................................... 277
3.5 Desmineralização de águas e processo de precipitação................................................. 279
Exercícios para resolver............................................................................................................ 281
RESOLUÇÕES.................................................................................................................................... 285
EXAMES-TIPO
EXAME-TIPO 1............................................................................................................................... 326
EXAME-TIPO 2............................................................................................................................... 331
EXAME-TIPO 3............................................................................................................................... 336
EXAME-TIPO 4............................................................................................................................... 342
RESOLUÇÕES................................................................................................................................. 348
EXAMES NACIONAIS
EXAME NACIONAL 1...................................................................................................................... 354
Resoluções................................................................................................................................ 361
EXAME NACIONAL 2...................................................................................................................... 364
Resoluções................................................................................................................................ 371
EXAME NACIONAL 3...................................................................................................................... 374
Resoluções................................................................................................................................ 381
EXAME NACIONAL 4...................................................................................................................... 385
Resoluções................................................................................................................................ 391
ANEXOS ........................................................................................................................................... 394
CPE_FQ11 © RAIZEDITORA
6
FÍSICA 10.º ANO
I.1 ENERGIA
E MOVIMENTOS
1.1 Energia mecânica e energia interna
A energia potencial é uma energia
armazenada no corpo pronta a
manifestar-se.
Ec
Um corpo ou um conjunto de corpos que são alvo de estudo é designado
por sistema físico. Todo o resto do universo que interage com o sistema é
designado por vizinhança.
Num sistema, as diferentes manifestações de energia resultam apenas de
duas formas fundamentais de energia: energia cinética e energia potencial. A energia cinética está associada ao movimento dos corpos, nomeadamente de translação, rotação e vibração. A energia potencial está associada
às interações entre os corpos de um sistema, nomeadamente gravítica, elétrica, elástica e magnética.
ENERGIA CINÉTICA E ENERGIA POTENCIAL GRAVÍTICA
Declive = valor de 1/2 m
v2
Fig. 1 Gráfico Ec = f (v2).
A energia cinética, Ec, está associada ao movimento de um corpo e o seu
valor é tanto maior quanto maior for a massa, m, e a velocidade do corpo, v.
A energia cinética exprime-se por:
1
Ec = m v2
2
v»
Ec – energia cinética 1J2
m - massa 1kg2
v - módulo da velocidade 1m s - 12
3m
2m
m
2v»
Ep
v»
Declive = valor de m g
h
Fig. 3 Gráfico Ep = f(h).
Ep - energia potencial gravítica 1J2
m - massa 1kg2
g - módulo da aceleração gravítica 1m s - 22
h - altura em relação ao nível de
referência 1m2
A posição de referência é habitualmente considerada o ponto
mais baixo da trajetória.
v»
v»
3v»
A massa duplica,
a energia cinética duplica.
A velocidade duplica,
a energia cinética é quatro vezes maior.
A massa triplica,
a energia cinética triplica.
A velocidade triplica,
a energia cinética é nove vezes maior.
Fig. 2 Relação da massa e da velocidade de um corpo com a sua energia cinética.
A energia potencial gravítica, Ep, deve-se à interação gravítica entre os corpos de um sistema e depende da sua posição. A energia potencial gravítica
depende da massa do corpo, m, da aceleração gravítica, g, e da altura do corpo, h, relativamente à posição de referência e essa relação é dada por:
Ep = m g h
A soma da energia cinética com a energia potencial de um sistema designa-se energia mecânica, Em:
Em = Ec + Ep
CPE_FQ11 © RAIZEDITORA
90
ENERGIA E SUA CONSERVAÇÃO
Contudo, a energia total, Etotal, de um sistema não é devida apenas à
energia mecânica, mas também à energia associada às partículas que o
constituem: a energia cinética interna, Ec interna, e a energia potencial interna, Ep interna. A energia cinética interna está associada ao grau de agitação das partículas do sistema e é avaliada macroscopicamente através da
temperatura. A energia potencial interna está associada às interações entre
as partículas que constituem o sistema. A soma da energia cinética interna
com a energia potencial interna de um sistema designa-se energia interna, Einterna, do sistema.
Etotal = Emecânica + Einterna
Etotal = Ec + Ep + Ec interna + Ep interna
A energia interna é a energia que
um sistema possui a nível microscópico e é tanto maior quanto
maior for a sua massa e a sua temperatura.
SISTEMA MECÂNICO
Um sistema mecânico é um sistema onde as variações de energia interna,
relacionadas com os efeitos de aquecimento e/ou deformação, não são
consideradas. No movimento de translação de um corpo rígido pode considerar-se que o corpo é um ponto ou partícula com a massa do corpo ‑ centro de massa do sistema. No modelo do centro de massa:
• o sistema deve ser um corpo rígido, indeformável e apenas apresentar
movimento de translação;
• a massa do sistema está localizada no centro de massa.
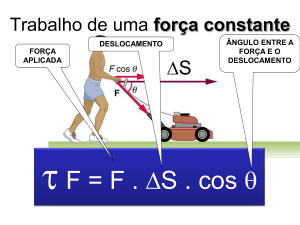
1.2 Trabalho realizado por forças constantes
O trabalho é um processo de transferência de energia de ou para um corpo por ação de forças. Para que uma força realize trabalho é necessário que
desloque o centro de massa do corpo. Se não houver força, não há trabalho!
Mas há situações em que há força e esta não realiza trabalho. O trabalho de
uma força constante sobre um corpo é dado por:
WF = F * d * cos q
Não é possível usar o modelo do
centro de massa:
•se se pretender estudar o movimento de rotação do corpo;
•se existirem variações de energia
interna devido a deformações ou
variações de temperatura.
Centro de massa (CM) - é um
ponto representativo do sistema
ao qual se associa a sua massa,
considerando-se que todas as forças que atuam no sistema estão
nele aplicadas.
O trabalho está associado a uma
força e, por isso, se diz trabalho de
uma força.
"
As intensidades da força, F, e do deslocamento, d, são sempre positivas,
pelo que o sinal do valor do trabalho, W, é determinado inteiramente
pelo ângulo entre a força e o deslocamento.
W negativo
W positivo
F»
F»
F»
d»
WF - trabalho de uma força (J)
F - intensidade da força (N)
d - módulo do deslocamento do
corpo (m)
q - ângulo entre a força e o deslocamento
"
F»
d»
CPE_FQ11 © RAIZEDITORA
Fig. 4 Força aplicada na direção do deslocamento.
Para que a atuação de uma força tenha a máxima eficácia deverá apresentar a mesma direção do deslocamento, isto é, um ângulo de 0° ou 180°. Se o
ângulo entre a força e o deslocamento for de 0°, o trabalho positivo ou
potente é máximo e a energia do corpo aumenta.
Se o ângulo entre a força e o deslocamento for de 180°, o trabalho negativo ou resistente é máximo e a energia do corpo diminui.
O valor de q é o menor ângulo
entre o vetor força e o vetor deslocamento.
91
QUÍMICA 11.º ANO
EXERCÍCIOS PARA RESOLVER
1 Considere a reação representada pela seguinte
equação:
2 H2S (g) + 3 O2 (g) " 2 SO2 (g) + 2 H2O (g)
Selecione a única opção que contém os termos
que preenchem, sequencialmente, os espaços seguintes, de modo a obter uma afirmação correta.
O oxigénio atua como agente ______ e o número
de oxidação do átomo de enxofre aumenta em
______.
A. oxidante … 2
C. redutor … 2
B. oxidante … 6
D. redutor … 6
2 A água pode sofrer decomposição em oxigénio e
A. A espécie redutora é o Fe3O4 e o elemento
que se oxida é o ferro.
B. A espécie oxidante é o CO e o elemento
que se reduz é o ferro.
C. A espécie oxidante é o Fe3O4 e o elemento
que se reduz é o carbono.
D. A espécie redutora é o CO e o elemento
que se oxida é o carbono.
4 Uma fita de um determinado metal (que pode ser
cobre, chumbo, zinco ou alumínio) foi enrolada
em torno de um prego de ferro e ambos foram
mergulhados numa solução de água salgada.
Solução de
água salgada
hidrogénio pela passagem de uma corrente elétrica – eletrólise da água – de acordo com a seguinte equação química:
2 H2O (l) " 2 H2 (g) + O2 (g)
Prego
de ferro
2.1 Que quantidade de matéria de H2 (g) pode
ser produzida pela passagem de 4,8 * 1021
eletrões?
A. 2,00 * 10 - 3 mol
Observou-se, após algum tempo, que o prego de
ferro foi bastante corroído. Considere a série eletroquímica seguinte:
B. 4,00 * 10 - 3 mol
C. 8,00 * 10 - 3 mol
D. 1,60 * 10 - 2 mol
Au Ag Cu Pb Fe Zn Aℓ
2.2 Escreva os pares conjugados da reação de
oxidação-redução que ocorre.
3 O ferro, um dos metais produzidos em maior es-
cala, é extraído de minérios como a magnetite,
Fe3O4, e a hematite, Fe2O3. No alto-forno das siderurgias, destes minérios é obtido ferro metálico
através de reações de oxidação-redução, como a
seguinte:
Fe3O4 (s) + 4 CO (g) " 3 Fe (l) + 4 CO2 (g)
3.1 Qual é o número de oxidação do carbono na
molécula de CO2?
A. + 4
B. + 2
Fita de
um metal
C. - 4
D. - 2
3.2 Selecione a alternativa correta, relativamente
à reação de produção de ferro.
Poder redutor crescente
Com base nas observações efetuadas, conclui-se
que o metal da fita deve ser
A. Aℓ ou Pb.
C. Ag ou Aℓ.
B. Cu ou Pb.
D. Zn ou Aℓ.
5 O alumínio líquido pode ser obtido industrial-
mente através da eletrólise do respetivo óxido,
Al2O3, utilizando a grafite, C (s), como um dos elétrodos. A reação pode ser traduzida através da
seguinte equação química:
2 Aℓ2O3 (fundido) + 3 C (s) " 4 Aℓ (l) + 3 CO2 (g)
5.1 Selecione a única alternativa que contém os
termos que preenchem, sequencialmente, os
espaços seguintes, de modo a obter uma
afirmação correta.
CPE_FQ11 © RAIZEDITORA
268
REAÇÕES EM SISTEMAS AQUOSOS
O átomo de alumínio, ao ______ três eletrões, ______, sendo o alumínio a espécie
______.
A. ceder … reduz-se … oxidante
2 MnO4- (aq) + 6 H+ (aq) + 5 H2O2 (aq) "
" 2 Mn2 + (aq) + 5 O2 (g) + 8 H2O (l)
B. ceder … oxida-se … redutora
7.1 Verifique, justificando, se se trata de uma reação de oxidação-redução.
C. ganhar … reduz-se … oxidante
7.2 Indique o agente oxidante e o agente redutor.
D. ganhar … oxida-se … redutora
7.3 Quais são os pares conjugados de oxidação-redução? Qual é o mais forte?
5.2 Relativamente a esta equação química, selecione a opção correta. A variação do número
de oxidação do alumínio, Aℓ, e do carbono, C,
é respetivamente,
A. - 6 e + 2
C. - 3 e - 2
B. - 3 e + 4
D. - 6 e + 4
5.3 Calcule a massa de alumínio, Aℓ (l)
(M = 26,98 g mol - 1), obtido por eletrólise,
quando são libertados 200 dm3 de CO2 (g),
medido em condições de pressão e temperatura normais. Apresente todas as etapas de
resolução.
6 Um parafuso de níquel prende uma porca de co-
bre. Esse sistema foi colocado num recipiente que
contém uma solução diluída de ácido clorídrico
(HCℓ), conforme a figura.
Solução de HCℓ
Solução
Cor da solução
2+
Ni
+
H
Cu
Cobre
2+
Cℓ
-
Verde
Incolor
Azul
Incolor
Níquel
Nesse recipiente ocorre uma reação de oxidação-redução. Os elementos abaixo indicados estão
dispostos por ordem crescente de poder redutor:
Cℓ " Cu " H " Ni
6.1 Escreva a equação acertada da reação global
que ocorre no recipiente.
CPE_FQ11 © RAIZEDITORA
7 Considere a reação traduzida pela equação:
6.2 Refira duas evidências experimentais que indicam a ocorrência da reação química no
processo descrito.
2+
8 Um metal M reage com o ião níquel, Ni (aq) de
uma solução aquosa de sulfato de níquel (II) mas
não reage com o ião manganês, Mn2+(aq) de uma
solução aquosa de sulfato de manganês. Qual das
seguintes opções representa, por ordem crescente, o poder oxidante dos três metais?
A. Ni, M, Mn
C. Mn, Ni, M
B. Mn, M, Ni
D. M, Ni, Mn
9 Numa atividade laboratorial, um grupo de alunos
pretendia organizar uma série eletroquímica a
partir de reações entre metais e solução aquosas
de sais contendo catiões de outros metais. Para
tal, colocaram em contacto placas de ferro (Fe),
cobre (Cu), zinco (Zn), chumbo (Pb) e magnésio
(Mg) previamente lixadas, com as soluções aquosas de sais contendo os catiões dos restantes metais. Utilizaram-se soluções de nitratos dos metais
referidos, de concentração 0,1 mol dm- 3. Os alunos organizaram os resultados obtidos na tabela
seguinte.
Metal
Ião
metálico
Zn
Fe
Pb
Cu
Mg
Zn2+
–––
Não há
reação
Não há
reação
Não há
reação
Há
reação
Fe2+
Há
reação
–––
Não há
reação
Não há
reação
Há
reação
Pb2+
Há
reação
Há
reação
–––
Não há
reação
Há
reação
Cu2+
Há
reação
Há
reação
Há
reação
–––
Há
reação
Mg2+
Não há
reação
Não há
reação
Não há
reação
Não há
reação
–––
269