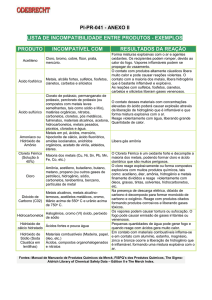
Tabela 1 - Ácidos comuns
Ácido forte (eletrólito forte)
Ácido fraco (eletrólito fraco)
HCl
Ácido clorídrico
H3PO4
Ácido fosfórico
HBr
Ácido bromídrico
H2CO3
Ácido carbônico
HI
Ácido iodídrico
CH3COOH
Ácido acético
HNO3
Ácido nítrico
H2C2O4
Ácido oxálico
HClO4
Ácido perclórico
C4H6O6
Ácido tartárico
H2SO4
Ácido sulfúrico
C6H8O7
Ácido cítrico
C9H8O4
Aspirina
Fonte: KOTZ; TREICHEL Jr., 2006.
Classificações
1- Quanto à presença ou não de oxigênio:
a) Oxiácidos ou ácidos oxigenados;
b) Hidrácidos ou ácidos não-oxigenados.
2- Quanto a quantidade de hidrogênios:
a) Monoácidos;
b) Diácidos;
c) Triácidos;
d) Tetrácidos.
3- Quanto à força:
a) Fortes;
b) Fracos;
c) Moderados.
Escala de pH
0 1 2 3 4 5 6
7
8 9 10 11 12 13 14
Ácido
neutro
Básico
Tabela 2: Escala simplificada de PH
Um dos indicadores mais comuns para os ácidos é o tornassol. O
tornassol azul muda para vermelho em presença de um ácido. Outros
indicadores podem ser citados, mas vale ressaltar que suas
características serão dependentes do pH de viragem, ou seja, a simples
mudança de cor não será suficiente para classificar a espécie como
ácida.
Tabela 3 - Alguns indicadores ácido-base
Indicador
Transição de cor
pH de viragem
Violeta de metila
Amarelo - azul
0 - 1,6
Azul de bromofenol
Amarelo - azul
3,0 - 4,6
Alaranjado de metila
Vermelho - amarelo
3,1 - 4,4
Azul de bromotimol
Amarelo - azul
6,0 - 7,6
Timolftaleína
Incolor - azul
9,4 - 10,6
Amarelo de alizarina
Amarelo - vermelho
10,1 - 12,0
Fonte: BACAN et.al., 1979.
Ácidos e metais
Reação dos ácidos com metais. A série de atividade dos metais (Tabela
4) apresenta os metais em ordem decrescente de atividade. O
hidrogênio foi propositalmente incluído na série, para que possamos
compreender a reação dos ácidos com metais. Qualquer metal acima do
hidrogênio nessa série deslocará o hidrogênio de um ácido (SACKHEIM;
LEHMAN, 2001). Os metais superiores seriam aqueles que promoveriam
tal reação com maior facilidade:
Tabela 4 - Série de atividade dos metais
K
Potássio
Ca
Cálcio
Na
Sódio
Mg
Magnésio
Al
Alumínio
Zn
Zinco
Fé
Ferro
Sn
Estanho
Pb
Chumbo
H
Hidrogênio
Cu
Cobre
Hg
Mercúrio
Ag
Prata
Au
Ouro
Para qualquer metal acima do hidrogênio, teríamos reação com ácidos,
produzindo um sal e hidrogênio gasoso. Os ácidos não podem ser
armazenados em recipientes desses metais ativos. Materiais cirúrgicos
ou dentários, geralmente de aço inoxidável, não podem ser deixados na
presença de ácidos, uma vez que estes materiais contêm ferro. Já os
metais abaixo do hidrogênio na Tabela 4, não são capazes de substituir
o hidrogênio no ácido. Ou seja, podemos esperar que a mistura de cobre
com ácido clorídrico não produza hidrogênio, e isso realmente ocorre.
A reatividade (espontânea) de certo metal com ácido (H +) oxidante para
liberar H é determinada pela posição do metal na série eletromotriz.
Quanto mais eletropositivo e combinado com condições extremas, que
combinem temperatura, superfície de contato, concentração do ácido,
dentre outras, podemos interferir na velocidade da reação entre as
espécies, como destacamos a seguir: