ATIVIDADE COMPLEMENTAR DE QUÍMICA 1 ANO-HERSCHELL-CB2014
P. AP.
periódicas e aperiódicas
A Tabela Periódica pode ser utilizada
para relacionar as propriedades dos elementos
com suas estruturas atômicas, podendo ser de
dois tipos: aperiódicas e periódicas.
Propriedades aperiódicas
z
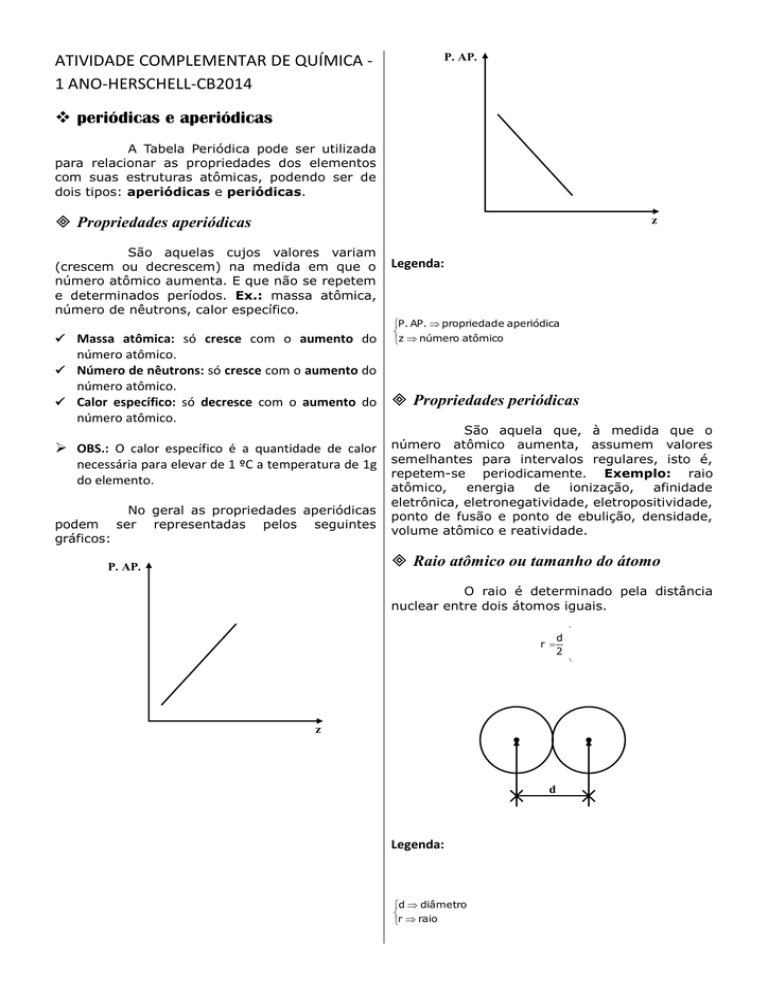
São aquelas cujos valores variam
(crescem ou decrescem) na medida em que o
número atômico aumenta. E que não se repetem
e determinados períodos. Ex.: massa atômica,
número de nêutrons, calor específico.
Massa atômica: só cresce com o aumento do
Legenda:
P. AP. propriedad e aperiódica
z número atômico
número atômico.
Número de nêutrons: só cresce com o aumento do
número atômico.
Calor específico: só decresce com o aumento do
número atômico.
Propriedades periódicas
São aquela que, à medida que o
OBS.: O calor específico é a quantidade de calor número atômico aumenta, assumem valores
necessária para elevar de 1 ºC a temperatura de 1g
do elemento.
No geral as propriedades aperiódicas
podem ser representadas pelos seguintes
gráficos:
semelhantes para intervalos regulares, isto é,
repetem-se periodicamente. Exemplo: raio
atômico,
energia
de
ionização,
afinidade
eletrônica, eletronegatividade, eletropositividade,
ponto de fusão e ponto de ebulição, densidade,
volume atômico e reatividade.
Raio atômico ou tamanho do átomo
P. AP.
O raio é determinado pela distância
nuclear entre dois átomos iguais.
r
z
d
Legenda:
d diâmetro
r raio
d
2
De maneira geral, para compararmos
o tamanho dos átomos, devemos levar em conta
dois fatores:
1)
2)
Variação da energia de ionização na Tabela
Periódica
O número de níveis (camadas);
O número de prótons (carga nuclear).
Para átomos de uma mesma família, quanto maior
o número atômico, maior o número de camadas.
Logo, maior o raio atômico, isto é, aumenta de cima
para baixo.
Para átomos de um mesmo período (famílias
diferentes), quanto maior o número atômico,
maior o número de prótons. Logo, uma maior
atração com os elétrons. Então, ocorre uma
diminuição no tamanho dos átomos, isto é,
aumenta da direita (família VIIIA) para a esquerda
(família IA).
Variação do
Periódica
raio
atômico
na
Tabela
Afinidade eletrônica ou eletroafinidade
É a energia liberada quando um
átomo isolado, no estado gasoso, recebe um
elétron.
Y(g) + 1e–
Y(1g) E
Variação da afinidade eletrônica na Tabela
Periódica
Obs.: o raio do átomo e de seus íons:
raio do átomo > raio do cátion
raio do átomo < raio do ânion
Energia ou potencial de ionização
É a energia mínima necessária para
remover um elétron de um átomo gasoso em
seu estado fundamental.
X(g) + E1
X1(g)
+ e–
X1(g)
+ E2
X(2g)
+ e–
X(2g)
+ E3
X(3g)
–
Obs.:
+e
E1 E2 E3
Eletronegatividade
É a capacidade de atrair elétrons para
perto de si, quando se encontra “ligado” a outro
átomo de elemento químico diferente, numa
substância composta.
Variação da eletronegatividade na Tabela
Periódica
É a reação entre a massa e o volume
do elemento.
d
m
v
Variação da densidade na Tabela Periódica
Obs.: os três elementos mais eletronegativos são:
flúor, oxigênio e nitrogênio (fon).
Eletropositividade ou caráter metálico
É a capacidade de um átomo perder
elétrons, originando cátion.
Variação da eletropositividade na Tabela
Periódica
Volume atômico
É o volume ocupado por 1 mol (6,02
x 1023 átomos) e ele pode ser calculado
relacionando-se a massa desse número de
átomos com a sua densidade.
V
Ponto de fusão e ebulição
m
d
Variação do volume atômico na Tabela
Periódica
Indica a passagem do elemento do
estado sólido para o líquido e do líquido para o
gasoso.
Variação dos pontos de fusão e ebulição na
Tabela Periódica
Reatividade
Está relacionada à maior ou menor
facilidade em ganhar ou perder elétrons.
Densidade (d)
Variação da reatividade na Tabela Periódica
2p6
3s2
3p6
4s2
1,97
Com relação às informações anteriores, podese afirmar que o raio atômico do elemento B
deve ser:
Exercício
01. (SCHELL)
Analise as afirmações e em seguida
marque a alternativa mais coerente.
I. “Percorrendo” a família dos alcalinos terrosos
de modo a aumentar o raio atômico, o ponto de
fusão também aumenta.
II. No 4º período da classificação periódica,
aumentando o número atômico, aumenta o
raio atômico.
III. Na família dos halogênios, aumentando a
energia
de
ionização,
aumenta
a
eletronegatividade.
a)
b)
c)
d)
e)
somente I está correta
somente II está correta
somente III está correta
somente I e III estão corretas
todas estão corretas
2)- (Cefet-PR) A tabela a seguir mostra o
símbolo hipotético de alguns elementos
químicos, suas distribuições
eletrônicas e seus raios atômicos:
Elemento Distribuição eletrônica Raio atômico
(Angstron)
A 1s2
2s2
1,13
B 1s2
2s2
2p6
3s2
x
C 1s2
2s2
a) menor que 1,13 Å e que A, B e C pertencem
à mesma família da tabela periódica..
b) menor que 1,13 Å e que A, B e C pertencem
ao mesmo período da tabela periódica.
c) menor que 1,97 Å e que A, B e C pertencem
ao mesmo período da tabela periódica.
d) maior que 1,13 Å e menor que 1,97 Å e que
A, B e C pertencem à mesma família da tabela
periódica.
e) maior que 1,13 Å e menor que 1,97 Å e que
A, B e C pertencem ao mesmo período da
tabela periódica.
3)- ) Os dados X e Y que faltam no quadro são:
Ponto de fusão (ºC) 1ª energia de ionização
(kcal/mol)
Cálcio 850 Y
Estrôncio X 131
Bário 700 120
a) X = 770; Y = 141.
b) X = 861; Y = 1430.
c) X = 1550; Y = 141.
d) X = 770; Y = 1430.
e) X = 1550; Y = 251.
Ligações químicas
A grande diversidade de substâncias
existentes na natureza deve-se à capacidade de
os átomos de um mesmo elemento ou de
elementos diferentes se combinarem entre si.
Poucos elementos, como os da família dos gases
nobres (família O ou VIIIA), aparecem na forma
de átomo isolado.
Teoria do octeto
Um grande número de átomos
adquire estabilidade eletrônica quando apresenta
8 (oito) elétrons na sua camada mais externa.
Valência
Corresponde
(combinação).
ao
poder
de
ligação
Família
Tendência a
Valência
Eletrovalência
IA ou 1
perder 1 elétron
1
1+
IIA ou 2
perder 2 elétrons
2
2+
IIIA ou 13
perder 3 elétrons
3
3+
IVA ou 14
perder ou ganhar 4 elétrons
4
4
VA ou 15
ganhar 3 elétrons
3
3–
VIA ou 16
ganhar 2 elétrons
2
2–
VIIA ou 17
ganhar 1 elétron
1
1–
Ligações químicas
São: iônica, covalente e metálica.
1. Ligação iônica ou eletrovalente ou heteropolar
Ocorre entre íons cátion (positivo) e ânion (negativo), e é caracterizada
pela existência de forças da atração eletrostática entre íons.
Esquematicamente, a ligação iônica entre os átomos A e B, genéricos,
pode ser assim representada:
Átomos
A
B
Tendência
Perder
elétron
Ganhar elétron
Ametais
Classificação
Metais
Semimetais
Hidrogênio
transferência definitiva de
Interação
Cátion
Ânion
elétrons
Ex.:
2
2
6
1
11Na 1s ) 2s 2p ) 3s )
1
2
2
6
Na 1s ) 2s 2p )
17 C
1
C
1s2 ) 2s2 2p6 ) 3s2 3p5 )
1s2 ) 2s2 2p6 ) 3s2 3p6 )
Na*
+
C
Na + C
1–
1+
Na1+C1– ou NaC
Determinação de fórmula de compostos iônicos
x+
A
y–
B
AyBx
Total de cargas positivas: y . (+x) = + xy
Total de cargas negativas: x . (–y) = –xy
das cargas: zero
Obs.: Todo composto iônico é eletricamente neutro.
Características dos compostos iônicos
São todos sólidos.
Apresentam elevados pontos de fusão e ebulição.
São bons condutores de corrente elétrica quando fundidos (líquidos) ou dissolvidos em
água.
Seu melhor solvente é a água.
Exercícios
02. (SCHELL)
O carbonato de cálcio, de fórmula molecular CaCO3, é a principal substância das
rochas calcárias e o ácido clorídrico, HC, é a principal substância do suco gástrico
(substância produzida no estômago dos seres humanos). Fazendo combinar o metal do
carbonato de cálcio com o ametal do ácido clorídrico, obtém-se:
a)
b)
c)
d)
e)
um ácido de fórmula CaC2
uma base de fórmula Ca(OH)2
um ácido de fórmula H2CO3
um sal de fórmula CaC2
um óxido de fórmula CaO
03. (SCHELL)
Alguns tipos de instrumentos musicais são fabricados com latão, que é uma liga
metálica, assim como sino de igreja, que é feito de bronze e as jóias de ouro, que também
é uma liga metálica.
Indique o elemento químico que é encontrado na constituição das três ligas metálicas
simultaneamente.
a)
b)
c)
d)
e)
zinco
cobre
ouro
ferro
estanho
“O conhecimento nos faz responsáveis.” (Che Guevara)
Boa sorte












