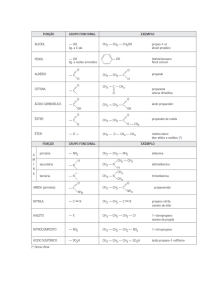
SUMÁRIO
1 INTRODUÇÃO À QUÍMICA ORGÂNICA .....................................................................................................03
1.1 Teoria ..........................................................................................................................................................03
1.2 Sessão leitura – Ciclo do Carbono .............................................................................................................06
1.3 Fixação .......................................................................................................................................................07
1.4 Pintou no ENEM .........................................................................................................................................08
1.5 Execício comentado ...................................................................................................................................10
2 HIDROCARBONETOS..................................................................................................................................11
2.1 Teoria ..........................................................................................................................................................11
2.2 Sessão leitura .............................................................................................................................................15
2.2.1 O gás natural ...........................................................................................................................................15
2.2.2 O petróleo ................................................................................................................................................15
2.3 Fixação .......................................................................................................................................................16
2.4 Pintou no ENEM .........................................................................................................................................18
2.5 Execício comentado ...................................................................................................................................18
3 FUNÇÕES ORGÂNICAS ..............................................................................................................................20
3.1 Teoria ..........................................................................................................................................................20
3.2 Sessão leitura .............................................................................................................................................24
3.2.1 Bebidas alcoólicas .................................................................................................................................. 24
3.2.2 O metanal ................................................................................................................................................25
3.2.3 A acetona .................................................................................................................................................25
3.2.4 O ácido metanoico ...................................................................................................................................25
3.2.5 O ácido acético ........................................................................................................................................25
3.2.6 Aminas: medicina e sociedade ................................................................................................................25
3.2.7 DDT – dicloro-difenil-tricloroetano ...........................................................................................................26
3.3 Fixação .......................................................................................................................................................26
3.4 Pintou no ENEM .........................................................................................................................................31
3.5 Execício comentado ...................................................................................................................................31
4 ISOMERIA .....................................................................................................................................................33
4.1 Teoria ..........................................................................................................................................................33
4.2 Sessão leitura .............................................................................................................................................35
4.3 Fixação .......................................................................................................................................................37
4.4 Pintou no ENEM .........................................................................................................................................40
4.5 Execício comentado ...................................................................................................................................41
5 PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS ..................................................................42
5.1 Teoria ..........................................................................................................................................................42
5.2 Sessão leitura ............................................................................................................................................ 43
5.3 Fixação ...................................................................................................................................................... 45
5.4 Pintou no ENEM ........................................................................................................................................ 47
5.5 Execício comentado .................................................................................................................................. 48
6 REAÇÕES ORGÂNICAS ............................................................................................................................. 49
6.1 Teoria ......................................................................................................................................................... 49
6.2 Sessão leitura – Explosivos ....................................................................................................................... 55
6.3 Fixação ...................................................................................................................................................... 56
6.4 Pintou no ENEM ........................................................................................................................................ 58
6.5 Execício comentado .................................................................................................................................. 58
Referências .......................................................................................................................................................59
3
Capítulo 1 – Introdução à Química
Hibridização:
O
Orgânica
carbono
2
admite
três
tipos
de
3
hibridização: sp, sp e sp .
a) Hibridização sp:
1.1 Teoria
Ocorre em moléculas onde o carbono apresenta
duas ligações σ e duas π.
Conceito:
É o ramo da química que estuda os
compostos que contêm carbono, denominados
― C = ou = C =.
2
b) Hibridização sp :
Ocorre em moléculas onde o carbono apresenta
compostos orgânicos.
A partir do final do século XIII, os
químicos começam a se dedicar ao estudo das
substâncias encontradas nos seres vivos. Nesta
época, acreditava-se na Teoria da Força Vital,
três ligações σ e uma π.
\
C=
/
segundo a qual os compostos orgânicos só
podiam ser produzidos por organismos vivos.
No entanto, em 1828, conseguiram
sintetizar a uréia a partir do cianato de amônio
(um composto inorgânico). Com isso, caiu por
terra a Teoria da Força Vital, e a produção de
compostos
orgânicos
cresceu
de
3
c) Hibridização sp :
Ocorre em moléculas onde o carbono apresenta
as quatro ligações σ.
│
― C ―
│
maneira
Compostos orgânicos:
exponencial.
Nos compostos orgânicos, a presença
O Carbono:
No século XIX, Kekulé percebeu que o
átomo
de
propriedades
carbono
que
apresentava
o diferenciava
certas
de outros
átomos. Essas propriedades são:
a) O carbono é tetravalente:
Como o carbono apresenta 4 elétrons na última
camada eletrônica, quando se liga a outro átomo
compartilha esses 4 elétrons formando portanto 4
ligações covalentes.
b) O carbono forma cadeias:
O átomo de carbono pode ligar-se a outros
átomos de carbono, formando cadeias com várias
disposições e tamanhos.Essa propriedade é a
principal responsável pela existência de milhares
de compostos orgânicos.
c) As 4 ligações sigma (σ) de um carbono são
iguais.
do carbono (C) é obrigatória. Suas ligações
podem
ser
representadas
das
seguintes
maneiras:
│
― C ―, = C =, ≡ C ― e = C ―.
│
│
Além
do carbono são encontrados
outros elementos como:
Hidrogênio(H): é monovalente, efetua
uma única ligação que é representada por H ―.
Nitrogênio(N):
é
trivalente
e
suas
ligações podem ser representadas por ― N ―,
= N ― e ≡ N.
Oxigênio(O): é bivalente, ― O ― e O =.
Halogênios:
flúor
(F),
cloro(Cl),
bromo(Br) e iodo(I), são todos monovalentes,
F ―, Cl ―, Br ― e I ―.
Enxofre(S): é bivalente: ― S ― e S =.
4
Representação dos compostos orgânicos:
1- Carbono primário:
Os compostos orgânicos possuem uma
É aquele ligado a nenhum ou um átomo
variedade de fórmulas utilizadas para representá-
de carbono diretamente.
los. São elas:
Estrutural:
H
H
H
H
│
│
│
│
H―C―C―H
H―C―C―H
│
│
│
│
H
H
H
H
Condensada:
2- Carbono secundário:
H3C – CH3
É aquele ligado diretamente a dois
Molecular:
átomos de carbono.
C2H6
Atualmente,
a
representação
mais
H
CH3
│
│
H ― C ― C* ― H
simplificada seria a de zigue-zague. As pontas
correspondem a CH3, a junção de dois traços ao
│
│
grupo CH2, a junção de três traços ao grupo CH e
H
H
a junção de quatro traços a um carbono
3- Carbono terciário:
quaternário. Em inglês essa nomenclatura é dita
Está ligado a três átomos de carbono.
Bond Line Formula.
H
CH3
Exemplos:
│
│
H ― C ― C* ― H
CH3
│
│
H
CH3
4- Carbono quaternário:
Está
ligado
diretamente
a
apenas
átomos de carbono.
Cadeias carbônicas:
As
cadeias
H
CH3
│
│
H ― C ― C* ― CH2 – CH3
carbônicas
possuem
algumas classificações de acordo com algumas
características.
a) Classificação do carbono na cadeia:
Os átomos de carbono numa cadeia
│
CH3
H
│
CH3
b) Classificação das cadeias carbônicas:
As
cadeias
carbônicas
podem
classificadas segundo três critérios:
podem ser classificados de acordo com o número
de átomos de carbono ligados diretamente a eles.
1) Disposição dos átomos de carbono:
ser
5
Esse nome é derivado do composto mais simples
I)
Cadeia aberta, acíclica ou alifática:
Apresenta
pelo
que apresenta esse núcleo, o benzeno (C6H6).
menos
duas
Esse
extremidades e nenhum ciclo ou anel.Se divide
forma
os
compostos
aromáticos que se subdividem em:
em:
anel
Normal, reta ou linear:
Compostos
aromáticos
mononucleares
ou
mononucleados:
Apresenta apenas carbonos primários e
Contêm um único anel benzênico.
secundários.
│
│
│
│
│
│
aromáticos
polinucleares
ou
polinucleados:
―C–C–C–C―
│
Compostos
Contêm
│
mais
de
um
anel
benzênico.Pode ser:
Polinuclear isolado, que ocorre quando
Ramificada:
os anéis não contêm átomos de carbono em
Apresenta
carbonos
terciários
e
comum e polinuclear condensado, onde os anéis
secundários.
contêm átomos de carbono em comum.
Alicíclica, não-aromática ou cicloalifática:
Não apresentam o núcleo aromático ou
anel benzênico.
II)
Cadeia fechada ou cíclica:
Não
apresenta
extremidades
e
os
átomos apresentam um ou mais ciclos.
2) Tipo de ligação entre os átomos de carbono:
Se divide em:
I)
Aromática:
Apresenta
Saturada:
Apresenta somente ligações simples
pelo
menos
um
anel
entre os átomos de carbono na cadeia.
benzênico.
II)
Anel ou núcleo benzênico é uma das
cadeias mais importantes da Química Orgânica.
Insaturada:
Apresenta pelo menos uma dupla ou
tripla ligação entre átomos de carbono na cadeia.
6
│
│
│
1.2 Sessão Leitura
-C–C=C=C│
│
Ciclo do Carbono
O carbono é o elemento químico
3) Natureza dos átomos que compõe a cadeia:
fundamental dos compostos orgânicos, cujo
ciclo consiste na assimilação (fixação) dos
I)
Homogênea:
átomos contidos nas moléculas simples de gás
É constituída apenas de átomos de
carbono.
carbônico presente na atmosfera (CO2), e
convertidos em substâncias mais elaboradas
│
(carboidratos,
―C―
│
│
│
metabolismo
│
│
│
a
fotossintético
partir
realizado
do
pelos
organismos autotróficos.
― C ―C ― C ―C ―
│
proteínas),
Parte
│
formados
são
dos
compostos
aproveitados
orgânicos
pelo
próprio
organismo produtor, e o restante da produção
incorporada à biomassa do mesmo, servindo
como fonte de nutrientes para os subsequentes
níveis
tróficos
da
consumidores:
cadeia
primários
alimentar,
os
(herbívoros),
secundários (onívoros) e terciários (todos os
II)
Heterogênea:
carnívoros), até o nível dos decompositores,
Apresenta pelo menos um heteroátomo
efetuando a degradação da matéria.
na cadeia.
Portanto, são os seres produtores os
│
│
│
│
que iniciam o ciclo do carbono, captado pelos
―C―C―O―C―C―
│
│
│
demais
│
finalizado
pelos
os nutrientes, incluindo o carbono, para o
OBS.:
átomo
diferente
carbono que esteja posicionado
átomos de carbono.
e
decompositores, devolvendo ao ambiente todos
O = heteroátomo
Heteroátomo:
organismos
de
entre dois
reinício do processo.
Lembrando
que
a
devolução
de
carbono não ocorre somente com a morte de
um
organismo
(animal
ou
vegetal),
mas
continuamente durante a vida de qualquer ser,
através da respiração.
7
1.3 Fixação
Exercícios:
1) Identifique quais são os carbonos primários,
secundários e terciários nos compostos a seguir:
4) A cadeia abaixo é:
a) Aberta, heterogênea, saturada e normal;
b) Acíclica, homogênea, insaturada e normal;
c) Aromática, homogênea, insaturada e ramificada;
d) Alifática, homogênea, insaturada e ramificada;
e) Cíclica e aromática.
5) Identifique
2) Um quimioterápico utilizado no tratamento do
câncer é a sarcomicina, cuja fórmula estrutural
pode ser representada por:
Escreva sua fórmula molecular e indique o
número de carbonos secundários presentes na
estrutura.
3) Determine
número
de
carbonos
primários,
secundários, terciários e quaternários existentes
em cada uma das estruturas a seguir e escreva
suas fórmulas moleculares:
a
cadeia
homogênea e saturada:
carbônica
ramificada,
8
6) Um grupo de compostos, denominados ácidos
1.4 Pintou no ENEM
graxos, constitui a mais importante fonte de
(ENEM
2001
–
energia na dieta do Homem. Um exemplo destes
1)
Questão
é o ácido linoleico, presente no leite humano. A
atividades
sua fórmula estrutural simplificada é:
significativamente no ciclo natural do enxofre,
CH3(CH2)4(CH)2CH2(CH)2(CH2)7COOH
alterando
Sua cadeia carbônica é classificada como:
indicadas no esquema. Ainda hoje isso ocorre,
humanas
as
quantidades
23)
Algumas
interferiram
das
substâncias
a) Aberta, normal, saturada e homogênea;
apesar do grande controle por legislação. Pode-
b) Aberta, normal, insaturada e heterogênea;
se afirmar que duas dessas interferências são
c) Aberta, ramificada, insaturada e heterogênea;
resultantes da
d) Aberta, ramificada, saturada e homogênea;
(A) queima de combustíveis em veículos pesados
e) Aberta, normal, insaturada e homogênea.
e da produção de metais a partir de sulfetos
metálicos.
7) Dê
a
hibridização
de
cada
carbono
compostos a seguir:
nos
(B) produção de metais a partir de óxidos
metálicos e da vulcanização da borracha.
(C) queima de combustíveis em veículos leves e
a)
da produção de metais a partir de óxidos
metálicos.
(D) queima de combustíveis em indústria e da
obtenção de matérias-primas a partir da água do
mar.
(E) vulcanização da borracha e da obtenção de
matérias-primas a partir da água do mar.
b)
2) 79. (ENEM 2009 .Questão 1)
c) CH3(CH2)4(CH)2CH2(CH)2(CH2)7COOH
A atmosfera terrestre é composta pelos gases
nitrogênio (N2) e oxigênio (O2), que somam cerca
de 99%, e por gases traços, entre eles o gás
d)
carbônico (CO2), vapor de água (H2O), metano
(CH4), ozônio (O3) e o óxido nitroso (N2O), que
compõem o restante 1% do ar que respiramos.
Os gases traços, por serem constituídos por pelo
Gabarito:4-d; 5- b;6-e.
menos três átomos, conseguem absorver o calor
irradiado pela Terra, aquecendo o planeta. Esse
fenômeno, que acontece há bilhões de anos, é
chamado de efeito estufa. A partir da Revolução
Industrial (século XIX), a concentração de gases
traços na atmosfera, em particular o CO2, tem
aumentado significativamente, o que resultou no
aumento da temperatura em escala global. Mais
9
recentemente, outro fator tornou-se diretamente
próprios deve ser revirado com auxílio de
envolvido no aumento da concentração de CO2
ferramentas adequadas, semanalmente, de forma
na atmosfera: o desmatamento. BROWN, I. F.;
a homogeneizá-lo. É preciso também umedecê-lo
ALECHANDRE, A. S. Conceitos básicos sobre
periodicamente. O material de restos de capina
clima, carbono, florestas e comunidades. A.G.
pode ser intercalado entre uma camada e outra
Moreira
de lixo da cozinha. Por meio desse método, o
&
S.
Schwartzman.
As
mudanças
climáticas globais e os ecossistemas brasileiros.
adubo
Brasília: Instituto de Pesquisa Ambiental da
aproximadamente dois a três meses. Como usar
Amazônia, 2000 (adaptado).
o lixo orgânico em casa? Ciência Hoje, v. 42, jun.
Considerando o texto, uma alternativa viável para
2008 (adaptado).
combater o efeito estufa é
Suponha que uma pessoa, desejosa de fazer seu
A - reduzir o calor irradiado pela Terra mediante a
próprio
substituição
procedimento descrito no texto, exceto no que se
da
produção
primária
pela
orgânico
adubo
estará
orgânico,
pronto
tenha
em
seguido
o
industrialização refrigerada.
refere ao umedecimento periódico do composto.
B - promover a queima da biomassa vegetal,
Nessa situação,
responsável pelo aumento do efeito estufa devido
A - o processo de compostagem iria produzir
à produção de CH4.
intenso mau cheiro.
C - reduzir o desmatamento, mantendo-se, assim,
B - o adubo formado seria pobre em matéria
o potencial da vegetação em absorver o CO2 da
orgânica que não foi transformada em composto.
atmosfera.
C - a falta de água no composto vai impedir que
D - aumentar a concentração atmosférica de
microrganismos
H2O,
orgânica.
molécula
capaz
de
absorver
grande
decomponham
a
matéria
quantidade de calor.
D - a falta de água no composto iria elevar a
E - remover moléculas orgânicas polares da
temperatura da mistura, o que resultaria na perda
atmosfera, diminuindo a capacidade delas de
de nutrientes essenciais.
reter calor.
E - apenas microrganismos que independem de
oxigênio poderiam agir sobre a matéria orgânica e
transformá-la em adubo.
3) 92. (ENEM 2009 .Questão 34)
O lixo orgânico de casa – constituído de restos de
4)
verduras, frutas, legumes, cascas de ovo, aparas
ocasionado pelo aumento do efeito estufa, tem
de grama, entre outros –, se for depositado nos
como uma de suas causas a disponibilização
lixões, pode contribuir para o aparecimento de
acelerada
animais e de odores indesejáveis.
atmosfera. Essa disponibilização acontece, por
Entretanto, sua reciclagem gera um excelente
exemplo, na queima de combustíveis fósseis,
adubo orgânico, que pode ser usado no cultivo de
como a gasolina, os óleos e o carvão, que libera o
hortaliças, frutíferas e plantas ornamentais. A
gás carbônico (CO2) para a atmosfera. Por outro
produção do adubo ou composto orgânico se dá
lado, a produção de metano (CH4), outro gás
por meio da compostagem, um processo simples
causador do efeito estufa, está associada à
que requer alguns cuidados especiais. O material
pecuária e à degradação de matéria orgânica em
que é acumulado diariamente em recipientes
aterros sanitários.
(ENEM/2010)O
de
átomos
aquecimento
de
carbono
global,
para
a
10
Apesar
dos
problemas
causados
pela
1.5 Exercício Comentado
disponibilização acelerada dos gases citados,
1)A substância responsável pelo aroma
eles são imprescindíveis à vida na Terra e
característico da maçã verde pode ser
importantes para a manutenção do equilíbrio
representado por:
ecológico, porque, por exemplo, o
a) metano é fonte de carbono para os organismos
fotossintetizantes.
b) metano é fonte de hidrogênio para os
organismos fotossintetizantes.
c) gás carbônico é fonte de energia para os
organismos fotossintetizantes.
d) gás carbônico é fonte de carbono inorgânico
para os organismos fotossintetizantes.
e) gás carbônico é fonte de oxigênio molecular
a)Quantos hidrogênios completam essa
molécula?
b)Escreva suas fórmulas estruturais simplificada e
a fórmula molecular.
c)Classifique os carbonos presentes na estrutura.
Solução:
a)
para os organismos heterotróficos aeróbicos.
5)(ENEM/2009)
O
ciclo
biogeoquímico
do
carbono compreende diversos compartimentos,
entre os quais a Terra, a atmosfera e os oceanos,
e
diversos
processos
transferência
de
reservatórios.
renováveis,
na
por
permitem
compostos
Os
armazenados
que
entre
estoques
forma
de
a
carbono
recursos
não
o
petróleo,
são
limitados, sendo de grande relevância que se
perceba
a
importância
da
b)
esses
de
exemplo,
8 átomos de hidrogênio
substituição
de
Ou
combustíveis fósseis por combustíveis de fontes
renováveis. A utilização de combustíveis fósseis
interfere no ciclo do carbono, pois provoca
a) aumento da porcentagem de carbono contido
na Terra.
Fórmula Molecular
C4H8O2
b) redução na taxa de fotossíntese dos vegetais
superiores.
c) aumento da produção de carboidratos de
c) Contando os carbonos ligados á apenas a
outro átomo de carbono no total, são
origem vegetal.
d) aumento na quantidade de carbono presente
na atmosfera.
e) redução da quantidade global de carbono
armazenado nos oceanos.
Gabarito: 1-A; 2-C; 3-C; 4-D; 5-D
4 carbonos primários
11
Capítulo 2 – Hidrocarbonetos:
Infixos:
Infixo
2.1 Teoria
Hidrocarbonetos
são
Tipo
de
Ligação
compostos
an
formados apenas por átomos de carbono e
simples
hidrogênio.
Fórmula geral: CXHY.
en
dupla
in
tripla
Nomenclatura:
e) Cada composto orgânico deve ter um nome
Para os hidrocarbonetos usa-se o sufixo o.
diferente.
f)
Principais grupos orgânicos:
A partir do nome deve ser possível escrever a
Grupos alquila:
fórmula do composto orgânico e vice-versa.
g) Segue as regras da IUPAC (União Internacional
Com 1 carbono:
de Química Pura e Aplicada).
― CH3 (metil)
O nome de um composto orgânico é formado por
três partes:
Com 2 carbonos:
Prefixo + Infixo + Sufixo
― CH2 ― CH3 (etil)
Prefixo: Indica o número de átomos de carbono
presentes na molécula;
Infixo: Indica o tipo de ligação entre carbonos.
Sufixo: Indica o grupo funcional.
Com 3 carbonos:
― CH2 ― CH2 ― CH3 (propil)
Prefixos:
Prefixo
― CH2 ― CH3
Númerode C
met
1
│
et
2
CH3
prop
3
but
4
pent
5
hex
6
hept
7
oct
8
non
9
dec
10
(isopropil)
Com 4 carbonos:
― CH2 ― CH2 ― CH2 ― CH3 (butil)
― CH2 ― CH ― CH3 (isobutil)
│
CH3
― CH ― CH2 ― CH3 (s-butilou sec-butil)
│
CH3
12
com um hífen o nome do grupo orgânico que
CH3
corresponde a ramificação;
│
― C ― CH3 (t-butilouterc-butil)
Para indicar a quantidade de ramificações, usar
os prefixos di, tri, tetra, etc. antes do nome do
│
grupo orgânico;
CH3
No caso de mais de uma ramificação, os escreve
em
Com 5 carbonos:
ordem
alfabética,
desconsiderando
os
prefixos;
― CH2 ― CH2 ― CH2 ― CH2 ― CH3 (pentil)
― CH2 ― CH2 ― CH ― CH3 (isopentil)
Escrever, o nome do hidrocarboneto referente a
cadeia principal.
a) Alcanos:
│
CH3
CH3
São
hidrocarbonetos
acíclicos
e
saturados, ou seja, possuem cadeias abertas e
ligações simples entre os carbonos.
│
― CH2 ― C ― CH3 (neopentil)
│
CH3
CH3
│
Fórmula geral: CnH2n+2.
OBS.: n = número de carbonos.
― C ― CH2 ― CH3 (t-pentil ou tercpentil)
│
Nomenclatura: Prefixo indicativo ao número de
CH3
carbonos + an +o.
Ramificação:
Exemplos:
Localizar a cadeia principal:
CH4 → prefixo - met → nome metano
Maior sequência de carbonos. Entre duas ou
infixo - an
mais possibilidades escolhe-se a cadeia mais
sufixo - o
ramificada.
Os átomos de carbono que não pertencem à
CH3 ― CH3 → prefixo - et → nome etano
infixo - an
cadeia principal fazem parte das ramificações;
Numerar os átomos de carbono da cadeia
sufixo– o
principal. A decisão de por qual extremidade se
Ramificação:
começa a numeração segue os critérios:
1- Cadeia insaturada: começa pela extremidade
mais próxima a insaturação;
5
4
3
│
CH3
próxima a ramificação.
Escrever o número que corresponde a localização
da ramificação na cadeia principal e separando
1
H3C ― CH2―CH2―CH―CH3
2- Cadeia saturada: começa pela extremidade mais
2
2- metilpentano
13
b) Alcenos:
São
hidrocarbonetos
acíclicos
que
d) Alcadienos:
possuem uma única dupla ligação.
São hidrocarbonetos acíclicos com duas
duplas ligações.
Fórmula geral: CnH2n.
Nomenclatura: Prefixo indicativo ao número de
Fórmula geral: CnH2n-2.
carbonos + en + o.
Indicar a localização da dupla ligação;
A numeração começa pela extremidade mais
Nomenclatura: Prefixo indicativo ao número de
carbonos + a + DIENO.
H2C = C = CH2
próxima da insatauração ligação;
Escrever essa localização antes do infixo en.
Exemplos:
Ramificação:
H2C = CH ― CH2 ― CH3 but - 1 - eno
4
3
2
1
duplas ligações;
A sua numeração começa pela extremidade mais
próxima das duas duplas ligações.
H3C ― CH2 ― CH ― CH = CH2
1
│
2
3
4
5
6
7
H3C ― CH = CH ― CH = CH ― CH ― CH3
CH3
2
A cadeia principal é aquela que possui a maior
sequência de carbonos e que contenha as duas
CH2 = CH2 eteno
5
propadieno
│
– metilpenta – 1 - eno
CH3
c)
6– metilepta - 2,4 –dieno
Alcinos:
São hidrocarbonetos acíclicos, contendo
e) Ciclanos:
uma única tripla ligação.
São hidrocarbonetos cíclicos contendo
apenas ligações simples entre os carbonos da
cadeia.
Fórmula geral: CnH2n-2.
Nomenclatura: Prefixo indicativo ao número de
carbonos + in + o.
CH ≡ CH etino
Fórmula geral: CnH2n
Ramificação:
Nomenclatura: Palavra CICLO + prefixo indicativo
ao número de carbonos do ciclo + an + o.
A nomenclatura da alcinos ramificados é
Ramificação:
semelhante a de alcenos ramificados.
6
5
4
3
2
1
menor grupo orgânico no sentido horário e anti-
H3C ― CH2 ― CH ― C ≡ C ―CH3
horário;
│
CH3
4– metilexa – 2 – ino
A numeração começa pelo carbono que possui o
Os grupos orgânicos ficam com os menores
números.
14
1,1 - dimetilciclobutano
Classificação:
f)
Ciclenos:
Mononucleares ou monocíclicos:
Possui apenas um anel benzênico.
São hidrocarbonetos cíclicos contendo
uma ligação dupla.
Fórmula geral: CnH2n-2.
Nomenclatura: Palavra CICLO + prefixo indicativo
ao número de carbonos do ciclo + en + o.
Ramificação:
Coloca-se a dupla ligação entre os números 1 e 2
benzeno
Polinucleares ou policíclicos:
Possui dois ou mais anéis benzênicos.
Se divide em:
1- Com anéis isolados:
e faz a numeração no sentido horário e antihorário;
Os grupos orgânicos ficam com os menores
números.
2- Com anéis condensados:
g) Hidrocarbonetos aromáticos:
São hidrocarbonetos que possuem pelo
menos um anel benzênico.
Naftaleno
Nomenclatura:
Citar os nomes das ramificações e
terminar com a palavra benzeno.
15
O gás natural é um combustível fóssil
não renovável, ou seja, ele irá se esgotar na
natureza.
Composto
por
uma
mistura
de
hidrocarbonetos, com destaque para o metano
(CH4), o gás natural é encontrado em jazidas ou
metilbenzeno
Prefixos orto, meta e para:
Esses prefixos são usados quando ao
anel aromático estão ligados dois grupos.
Orto: indica posição 1,2:
depósitos subterrâneos, que normalmente estão
associados
ao
petróleo,
pois
essas
duas
substâncias passam pelo mesmo processo de
transformação
orgânica
(decomposição
durante
milhares
da
de
matéria
anos)
e
se
acumulam no mesmo tipo de terreno.
Esse combustível gasoso, após ser
tratado e processado, apresenta grande teor
energético, sendo bastante aproveitado nas
indústrias para a geração de energia elétrica. Ele
também pode ser empregado no aquecimento
1,2–dimetilbenzeno ou ortodimetilbenzeno
ambiental e nas aplicações domésticas de
residências e como combustível em automóveis
Meta: indica posição 1,3:
adaptados
para
recebê-lo,
substituindo
a
gasolina, o álcool ou o diesel.
Mais “limpo” entre os combustíveis de
origem
fóssil,
o
gás
natural
emite
menos
poluentes se comparado ao petróleo e ao carvão
mineral, no entanto, ele não está totalmente
isento dos problemas ambientais, visto que sua
1,3 – dimetilbenzeno ou metadimetilbenzeno
utilização também contribui para a poluição
atmosférica e para intensificação do efeito estufa.
Para: indica posição 1,4:
(Wagner de Cerqueira e Francisco - Graduado
em Geografia - Equipe Brasil Escola
<http://www.brasilescola.com/geografia/gasnatural.htm>)
2.2.2O petróleo
O
petróleo
formou-se
na
Terra
hámilhões de anos, a partir da decomposição de
1,4 – dimetilbenzeno ou paradimetilbenzeno
pequenos
animais
vegetação
típica
de
marinhos,
regiões
plâncton
e
alagadiças.
O
petróleo acumula-se junto ao gás de petróleo,
2.2 Sessão Leitura
formando bolsões entre rochas impermeáveis ou
impregnando rochas de origem sedimentar. Tais
2.2.1 O gás natural
locais são denominados bacias.
16
Após
sua
extração,
o
petróleo
é
encaminhado para as refinarias, onde seus
componentessão
separados
através
sendo
parcialmente
Concluída
essa etapa,
ainda
resta
algum resíduo, que pode ser submetido a
Inicialmente, o petróleo é aquecido em
forno,
produçãode impermeabilizantes).
de
processos como a destilação fracionada.
um
(utilizado no asfaltamento de estradas e na
vaporizado
umapirólise ou craqueamento (cracking). Esse
processo
é
executado
em
outra
colunade
edirecionado para uma coluna de fracionamento
fracionamento e consiste na quebra de moléculas
provida de várias bandejas. A temperatura da
de
coluna varia com a altura, sendo que no topo se
menores.
encontra a menor temperatura.
cadeias
O
longas,
obtendo-semoléculas
craqueamento
aproveitamento
coluna, a temperatura diminui, permitindo queas
propiciandouma
frações voltem ao estado líquido e sejam
permitindo a obtenção de maiores quantidades
retiradas.
deGLP, gasolina e outros produtos químicos que
frações retiradas do petróleo, sua constituiçãoe
sua faixa de temperaturas de ebulição:
serão
integral
economia
transformados
do
um
À medida que os vapores sobem na
O esquema a seguir mostra algumas
quase
possibilita
petróleo,
expressiva
em
e
diversos
produtosindispensáveis em nosso dia-a-dia.
A quantidade obtida de cada tipo de
derivado de petróleo depende de sua origem,
dosrecursos da refinaria e das necessidades do
mercado consumidor em cada momento.
2.3 Fixação
Exercícios:
1- Dê a nomenclatura segundo a IUPAC dos
compostos a seguir:
CH3
│
a) H3C ― CH2― CH― CH2― CH3
CH3
│
b) H3C ― CH2 ― C ― CH2 ― CH3
│
coluna
O resíduo líquido que ficou no fundo da
CH ― CH3
é
│
levado
apresentapressão
para
inferior
outra
à
coluna
que
atmosférica,
CH3
possibilitando que as frações mais pesadas
entrem em ebulição a temperaturas mais baixas,
evitando assim a quebra de suas moléculas.
Dessa maneira, são obtidas novas
frações do resíduo líquido: óleos lubrificantes,
parafinas,graxas, óleo combustível e betume
CH2 ― CH2 ― CH3
│
c) H3C ― CH ― C ≡ C ― CH3
d) H3C ― C = CH ― CH ― CH ― CH3
17
│
H3C ― CH2
│
│
CH3 CH3
│
Indique a fórmula estrutural plana que se encaixa
CH3
o composto.
4)(UFSC) Um alcano encontrado nas folhas de
e)
repolho contém em sua fórmula 64 átomos de
Hidrogênio. O número de átomos de Carbono na
fórmula é:
a)29
b)32
c)30
d)33
e)31
f)H2C ― CH ― CH3
│
5)Dê o nome e a fórmula molecular dos seguintes
│
ciclos:
H2C ― C ― CH2 ― CH3
│
CH3
2) Escreva a fórmula estrutural dos compostos a
seguir:
a)
b)
c)
6) (FAFI-MG)
a) 2,3 – dimetilpentano
b) 5 – etil 3 – metiloctano
c) Etilciclobutano
d) Isopropilbenzeno
e) 1,3 – dimetilbenzeno
f)
I
Cicloexa – 1,1 – dieno
II
Sobre o benzeno, C6H6, estão corretas as
g) Ciclobuteno
seguintes afirmações, exceto:
h) 2,2,4 – trimetilpentano
a) Possui três pares de elétrons deslocalizados.
i)
Etilcicloexano
b) É uma molécula plana, com forma de
j)
4- metilpenta – 2 – ino
hexágono
k) etilmetilbenzeno
regular,
confirmada
por
estudos
espectroscópicos e de cristalografia por raios X.
c) Todos os ângulos de ligação valem 120°
3)Os
hidrocarbonetos
constituintes
do
são
petróleo.
os
A
principais
respeito
dos
devido à equivalência de todas as ligações
carbono-carbono.
hidrocarbonetos, cujos nomes estão relacionados
d) O benzeno não apresenta estrutura de
a seguir:
ressonância.
e)
I
– ciclopenteno
Os
seis
elétrons
p
estão
espalhados
igualmente nos seis carbonos e não localizados
II – 2-buteno
entre os pares de átomos de carbono
III – propadieno
7) (OSEC-SP) Os compostos classificados como
IV – hexano
hidrocarbonetos fazem parte de misturas que
V – 3 – heptino
compõem alguns combustíveis. Esses compostos
VI – ciclobutano
apresentam em sua constituição os elementos
químicos:
18
a) hidrogênio, carbono e oxigênio.
2) ( ENEM 2003 – Questão 42 ) Nos últimos anos,
b) Hidrogênio, carbono e nitrogênio.
o gás natural (GNV: gás natural veicular) vem
c) Hidrogênio e carbono.
sendo utilizado pela frota de veículos nacional,
d) Hidrogênio, carbono, oxigênio e nitrogênio.
por
e) Hidrogênio, carbono, oxigênio, enxofre e
agressivo do ponto de vista ambiental. O quadro
ser
viável
economicamente
e
menos
nitrogênio
compara algumas características do gás natural e
8) (RRN) Um composto orgânico cuja fórmula
da gasolina em condições ambiente.
geral é representada por C nH2n pertence à classe
Densidade
Poder Calorífico
(kg /m3)
(kJ /kg)
GNV
0,8
50.200
Gasolina
738
46.900
do:
a) Alceno ou cicloalceno.
b) Alcano ou cicloalcano.
c) Alceno ou cicloparafina.
d) Alcino ou alcadieno.
e) Alcino ou aromático.
9)Escreva
a
hidrocarboneto
fórmula
que
Apesar das vantagens no uso de GNV, sua
estrutural
apresenta
as
de
um
seguintes
utilização implica algumas adaptações técnicas,
pois,
em
condiçõesambiente,
o
volume
de
características:
combustível necessário,
a) Possui 4 C, 1 dupla ligação e 1 ramificação.
gasolina, para produzir a mesma energia, seria
b) Possui 6 C, 2 duplas ligações e 2 ramificações.
(A) muito maior, o que requer um motor muito
em
relação ao de
mais potente.
Gabarito:4- E; 6- D; 7- D; 8-C.
(B) muito maior, o que requer que ele seja
armazenado a alta pressão.
2.4 Pintou no ENEM
(C) igual, mas sua potência será muito menor.
1) ( ENEM 2004 – Questão 42 ) Há estudos que
(D) muito menor, o que o torna o veículo menos
apontam razões econômicas e ambientais para
eficiente.
que o gás natural possa vir a tornar-se, ao longo
(E) muito menor, o que facilita sua dispersão para
deste século, a principal fonte de energia em
a atmosfera.
lugar do petróleo. Justifica-se essa previsão,
entre outros motivos, porque o gás natural
(A) além de muito abundante na natureza é um
combustível renovável.
(B) tem novas jazidas sendo exploradas e é
menos poluente que o petróleo.
(C) vem sendo produzido com sucesso a partir do
carvão mineral.
(D) pode ser renovado em escala de tempo muito
inferior à do petróleo.
(E) não produz CO2 em sua queima, impedindo o
efeito estufa.
3)De acordo com o relatório “A grande sombra da
pecuária” (Livestock’s Long Shadow), feito pela
19
Organização
Agricultura
das
e
a
Nações
Unidas
Alimentação,
o
para
a
gado
é
responsável por cerca de 18% do aquecimento
global, uma contribuição maior que a do setor de
transportes. Disponível em: www.conpet.gov.br.
Acesso em: 22 jun. 2010.
A criação de gado em larga escala contribui para
o aquecimento global por meio da emissão de
a) metano durante o processo de digestão.
b) óxido nitroso durante o processo de ruminação.
c) clorofluorcarbono durante o transporte de
carne.
d) óxido nitroso durante o processo respiratório.
e) dióxido de enxofre durante o consumo de
pastagens.
Gabarito: 1-B; 2-B; 3-A.
2.5 Exercício Comentado
1) Um composto organico x foi obtido pela
substituição dos hidrogenios do metano pelos
radicais isobutil , isopropil,vinil e fenil. escreva a
formula molecular e estrutural de x.
Solução:
-4 carbonos
I
CH4------------------ - C |
Substituindo os quatro átomos de hidrogênio do
metano pelos radicais indicados, temos a
seguinte formula estrutural:
fenil
|
H3C - CH - CH2 - C - CH = CH2 vinil
|
|
CH3
CH - CH3
isobutil
|
CH3
isopropil
Logo sua fórmula molecular é : C16H24
20
Capítulo 3 – Funções Orgânicas:
Quando um álcool apresentar mais do que dois
átomos de carbono, indicamos a posição do OH
numerando a cadeia a partir da extremidade mais
3.1 Teoria
próxima do carbono que contém a hidroxila.
Exemplo:
Função orgânica é um conjunto de
5
substâncias que apresentam semelhanças em
suas
propriedades
químicas,
│
propriedades funcionais. Decorrido o fato de
O
átomo
ou
grupo
de
3
2
1
H3C ― CH ― CH2 ― CH ― CH3
chamadas
CH3
possuírem a mesma fórmula estrutural.
4
│
OH
CH3
2– metilpenta – 4 - ol
átomos
responsáveis por essas propriedades, ou seja,
que caracteriza a fórmula estrutural é chamado
grupo funcional.
a) Alcoois:
São compostos orgânicos que contêm
um ou mais grupos hidroxila (OH) ligados
OBS.: Os alcoois são constituídos por radicais de
diretamente a um carbono saturado.
hidrocarbonetos ligados a uma ou mais hidroxilas.
Fórmula geral: R – OH.
Entretanto, nunca podem ser considerados bases
Nomenclatura:
de Arrhenius (pois não liberam essa hidroxila em
Usa-se o sufixo ol.
meio aquoso).
I.U.P.A.C.: Prefixo indicativo ao número de
Classificação:
carbonos + an, en ou in + ol.
Os alcoois podem ser classificados segundo
USUAL: Palavra ALCOOL + prefixo indicativo ao
alguns critérios:
número de carbonos + ÍLICO.
1 – número de hidroxilas:
Monoalcool ou monol: possui uma hidroxila.
CH3 ― OH
Dialcool ou diol: possui duas hidroxilas.
CH2 ― CH2 ― CH3
Ramificação:
│
OH
OH
A cadeia principal é a maior sequência de
carbonos que contenha o carbono ligado a
│
Trialcool ou triol: possui três hidroxilas.
hidroxila (OH);
CH2 ― CH2 ― CH2 ― CH3
A numeração começa pela extremidade mais
│
│
│
próxima a hidroxila (OH);
OH
OH
OH
2 – Posição da hidroxila:
21
Alcool
primário:
hidroxila
ligada
a
carbono
primário.
CH3 ― CH2
│
OH
Alcool secundário: hidroxila ligada a carbono
secundário.
São compostos em que o oxigênio está
H3C ― CH ― CH3
posicionado entre dois carbonos.
│
Fórmula geral: R – O – R1.
OH
Alcool
terciário:
c) Éteres:
Nomenclatura:
hidroxila
ligada
a
carbono
terciário.
I.U.P.A.C.: Prefixo indicativo ao menor número de
carbonos + OXI + nome do hidrocarboneto
correspondente ao maior número de carbonos.
CH3
│
H3C ― C ― CH3
│
OH
Ou seja, considera-se os grupos
CH3 ― O ―
(metóxi), CH3 ― CH2 ― O ― (etóxi), etc. como
substituintes da cadeia principal.
Exemplos:
H3C ― O ― CH2 ― CH3 metóxietano
b) Fenóis:
São compostos orgânicos que possuem
a hidroxila (OH) ligada diretamente ao anel
aromático.
Fórmula geral: Ar – OH.
Nomenclatura: Palavra HIDROXI + nome do
Ou:
aromático correspondente.
Ramificação:
H3C ― O ― CH2 ― CH3 éter etílico e metílico
A numeração começa pela hidroxila no sentido
em que os grupos orgânicos fiquem com os
OBS.: Utilizar a ordem alfabética.
menores números.
Exemplo:
d) Aldeídos:
São
apresentam
compostos
o
grupo
orgânicos
funcional
que
denominado
carbonilo, também chamado de aldo, aldoxilo ou
formil.
Grupo carbonilo:
│
― C = ou ― CHO.
22
Fórmula geral: R – CHO.
Nomenclatura: Prefixo indicativo ao número de
ou in + ONA;
carbonos + an ou en + al.
Prefixo indicativo ao número de carbonos + an, en
Para indicar a localização da carbonila, numerar a
Ramificação:
cadeia principal (deve incluir o carbono da
A cadeia principal é a maior sequência de
carbonila) de forma que ela obtenha o menor
carbonos
número.
que
inclui
o
carbono
do
grupo
funcional― CHO;
Exemplos:
A numeração parte da extremidade que inclui o
grupo ― CHO.
Exemplos:
f)
Ácidos carboxílicos:
São compostos que possuem o grupo
funcional carboxila ou carbóxi.
O
4
3
2
│
CH3
CH3
\
H
2,3 - dimetilbutanal
//
―C
ou
― COOH.
\
OH
Fórmula geral: R – COOH.
e) Cetonas:
São compostos que possuem o grupo
funcional carbonila também chamado de ceto,
cetoxilo ou oxo entre carbonos.
Grupo carbonila:
Nomenclatura: Palavra ÁCIDO + prefixo indicativo
ao número de carbonos + an, en, ou in + ÓICO.
Ramificação:
ramificados.
Exemplos:
│
―C=O
Fórmula geral: R ― C ― R1
ΙΙ
O
Nomenclatura:
O
1 //
H3C ― CH ― CH ― C
│
Grupo carboxila:
Semelhante
a
dos
aldeídos
23
Flavorizantes
apresentam
sabor
e
geralmente
agradáveis.
são
substâncias
aroma
Muitos
que
característicos,
flavorizantes
pertencem à função éster. Segue abaixo dois
ésteres empregados como essências em vários
produtos alimentícios.
Exemplos:
O
4
3
2
1 //
H3C ― CH ― CH2 ― C
│
\
CH3
HO
ácido 3 - metilbutanóico
g) Ésteres:
São compostos orgânicos derivados de
ácidos
carboxílicos
pela
substituição
do
h) Aminas:
hidrogênio do grupo OH por um grupo orgânico
(R).
São compostos derivados da amônia
(NH3) pela substituição de um, dois ou três
hidrogênios por grupos orgânicos.
Fórmula geral:
R ― N ― H (amina primária)
Fórmula geral:
O
//
R―C
\
O ― R1
Nomenclatura: Nome do ácido carboxílico – ICO +
ATO + DE + nome do grupo orgânico com
terminação A.
Exemplo:
│
H
R ― N ― R’ (amina secundária)
│
H
R ― N ― R’ (amina terciária)
│
R’’
Nomenclatura: escreve-se os nomes dos grupos
ligados
ao
nitrogênio
em
seguidos da palavra AMINA.
Exemplos:
ordem
alfabética
24
Todas as bebidas alcoólicas contêm
certo teor de etanol. Podem ser classificadas em
dois grupos: bebidas destiladas e não-destiladas.
A quantidade de álcool encontrada em
uma garrafa de pinga é igual à existente em 10
garrafas de cerveja.O consumo de bebidas
alcoólicas tem se tornado um problema muito
sério em todos os países.A ingestão habitual de
i)
Amidas:
grandes quantidades de álcool causa danos
São compostos derivados dos ácidos
carboxílicos
pela
substituição
da
hidroxila
presente no grupo funcional pelos grupos:
além de provocar alterações de comportamento.
―
NH2, ― NH ou ― N ―.
│
irreversíveis ao cérebro, ao coração e ao fígado,
Os efeitos no comportamento humano
provocados
│
por
diferentes
concentrações
alcoólicas no sangue estão indicados a seguir:
0,05%: sensação de bem-estar, visão reduzida e
Grupo funcional:
euforia;
O
0,10%: deficiência de coordenação e confusão
//
mental;
―C
0,15%: grande dificuldade na coordenação e na
\
resposta a fatos externos;
N―
0,20%: depressão física e mental;
│
0,30%: fala indistinta;
0,35%: estupor;
Nomenclatura:sufixo amida
0,45%: coma alcoólico;
Exemplos:
acima de 0,45%: morte.
No Brasil, uma pessoa que apresentarn
O
íveis de etanol superiores a 0,06% é considerada
//
H―C
incapaz para dirigir um veículo. De acordo com a
metanamida
lei, nesses casos o motorista será multado, terá
\
sua habilitação para dirigir suspensa e pode
NH2
sofrer pena de detenção de 6meses a 3 anos.
3.3.2
O metanal
O metanal é o principal aldeído, sendo
conhecido
também
por
aldeído
fórmico
ou
formaldeído.Nas condições ambientes, ele é um
gás
3.2 Sessão Leitura
incolor
extremamente
irritante
para as
mucosas. Quando dissolvido em água,forma-se
uma solução cuja concentração pode ser no
3.2.1 Bebidas alcoólicas
máximo de 40% em massa, conhecida por formol
ou formalina.
25
O
formol
tem
a
propriedade
de
cheiro irritante e sabor azedo, tendo sido isolado,
desnaturar proteínas tornando-as resistentes à
pela primeira vez, a partir do vinho azedo
decomposição por bactérias. Por essa razão, ele
(vinagre) — acetum = vinagre.
é usado como fluido de embalsamamento, na
conservação de espécies biológicas e também
3.2.6 Aminas: medicina e sociedade
como anti-séptico.
O grupo amino aparece em muitos
alimentos
3.2.3 A acetona
A
e
também
em
nosso
organismo
formando as substâncias mais importantes para a
acetona
(propanona
ou
dimetil-
cetona)à temperatura ambiente é um líquido que
vida: os aminoácidos, que dão origem às
proteínas.
apresenta odor irritante e se dissolve tanto em
As primeiras vitaminas (vital + amina)
água como em solventes orgânicos; por isso, é
descobertas receberam esse nome devido à
muito utilizada como solvente de tintas,vernizes e
presença de amina. Mas nem todas as vitaminas
esmaltes.
conhecidas atualmente são aminas.
Na indústria de alimentos, sua aplicação
No século XIX verificou-se que o gosto
mais importante relaciona-se à extração de óleos
amargo das folhas e flores de algumas plantas
e gorduras de sementes, como soja,amendoim e
era devido à presença de aminas. Essas
girassol.
substâncias,
Sua comercialização é controlada pelo
Departamento
de
Entorpecentes
Federal,
ser
utilizada
por
na
da
Polícia
extração
da
cocaína,a partir das folhas da coca.
em
pequenas
naquela
época
eram
denominadas álcalis vegetais (alcalis = bases),
são
hoje
conhecidas
alcalóides.Esses
com
alcalóides,
o
nome
de
normalmente
de
estruturas complexas, apresentam propriedades
Em nosso organismo, cetonas são
encontradas
que
quantidades
biológicas
que
permitem
seu
uso
como
no
medicamentos. Porém, como muitos deles podem
sangue,fazendo parte dos chamados corpos
causar dependência física e psíquica, seu uso só
cetônicos. Nesse caso, ela é formada pela
é permitido com prescrição e acompanhamento
degradação incompleta de gorduras.
médico.
Vários
3.2.4 O ácido metanóico
É
também
conhecido
dos
alcalóides
usados
atualmente são derivados de aminas encontradas
como
ácido
fórmico, por ter sido obtido historicamente a partir
em vegetais: morfina, ephedrina e atropina.
Existem
aminas
denominadas
da maceração de formigas. É um líquido incolor,
genericamente anfetaminas, que podem ser
de cheiro irritante,que, quando injetado nos
usadas como estimulantes.A ingestão dessas
tecidos, provoca dor e irritação característica.
substâncias,
conhecidas
vulgarmente
como
Uma das principais aplicações do ácido
bolinhas, eleva o ânimo, diminui a sensação de
fórmico é como fixador de pigmentos e corantes
fadiga e reduz o apetite. Porém, como causam
em tecidos,como algodão, lã e linho.
dependência,
têm
sua
comercialização
controlada.
3.2.5 O ácido acético
O uso de anfetaminas provoca um
Também conhecido por ácido acético, é
estado denominado“psicose da anfetamina”, que
um líquido incolor à temperatura ambiente, com
se assemelha a uma crise de esquizofrenia,
26
caracterizada por alucinações visuais e auditivas
ser capaz de interromper o equilíbrio natural do
e comportamento agressivo.
meio ambiente, envenenando alimentos, como
Outra substância
de
grande
poder
estimulante queapresenta o grupo amina em sua
verduras,
carnes
e
peixes,
e,
ainda,
enfraquecendo as cascas de ovos das aves.
estrutura é a cocaína. Essa droga é obtida a partir
das folhas de um arbusto encontrado quase
exclusivamente
estímulo
nas
encostas
provocado
pelo
dos
Andes.O
da
cocaína,
uso
3.3 Fixação
caracterizado por euforia, loquacidade, aumento
Exercícios:
da atividade motora e sensação de prazer, tem
1)Dê a nomenclatura segundo a IUPAC dos
duração aproximada de 30 minutos. Segue-se
compostos a seguir:
uma intensa depressão. Assim, o padrão de
dependência evolui de uso ocasional para uso
compulsivo, em doses crescentes, o que pode
a) H3C ― C = CH ― CH ―
│
levar à morte por overdose.Durante vários anos o
suprimento para consumo ilegal dessa droga
CH ― CH3
H3C ―
CH2
│
│
CH3OH
OH
consistia em um sal denominado cloridrato, que
era consumido por inalação nasal ou por via
b) H2C ― CH ― C = CH ― CHO
endovenosa, com ouso de seringas — o que
c)H2C ― CH ― C = CH ― CHO
provoca marcas e envolve muitos riscos, como a
│
transmissão da Aids, quando o consumo é feito
CH2 ― CH3
em grupo. A inalação produz uma sensação de
euforia menos intensa, causa rinite e necrose da
d)H3C ― CH ― CH2 ― COOH
│
mucosa e do septo nasal.
O
uso
dramaticamente
da
nos
cocaína
últimos
aumentou
anos,
CH3
pela
introdução no mercado de uma nova forma, muito
e)H3C ― CH2 ― O ― CH2 ― CH2 ― CH2 ― CH3
mais barata: o crack — uma mistura do cloridrato
com bicarbonato de sódio. As conseqüências do
O
uso de crack são muito mais intensas. Alguns
ΙΙ
estudos indicam que a recuperação de um
f) H3C ― CH2 ― C ― CH2 ― CH ― CH2 ― CH3
│
consumidor de crack é praticamente nula.
CH3
3.2.7 DDT — dicloro-difenil-tricloroetano
O
O DDT é um dos mais conhecidos
inseticidas
de
baixo
inicialmente na época
//
utilizado
g)H3C ― CH2 ― CH2 ― C
da Segunda Guerra
\
custo.
Foi
O ― CH2 ― CH2 ― CH3
Mundial para controlar doenças transmitidas por
insetos, como malária, tifo e febre amarela. Em
h)H3C ― C ― N ― H
muitas partes do mundo, seu uso foi proibido por
ΙΙΙ
apresentar efeito acumulativo no organismo e por
O
H
27
2) Escreva a fórmula estrutural dos compostos a
seguir:
a) 2 – metilbutano – 2 – ol
a) cetona
b) 1 – metilcicloexanol
b) aldeído
c) 2 – metilpentano – 3 ona
c) ácido
d) 2 – metilcicloexanona
d) éster
e) 2,3 – dimetilpentanal
e) éter.
f)
5) (PUCRS/1-2000) 9) Considerando a estrutura
Propanoato de etila
g) Propanoato de metila
do ácido salicílico, usado na preparação do
h) Ácido 2 – metilpropanóico
salicilato de sódio, analgésico e antipirético,
i)
Etoxietano
selecione a alternativa que apresenta as palavras
j)
Ciclopropanona
que completam corretamente as lacunas no texto
k) 1 - Metoxibutano
a seguir.
l)
O ácido salicílico pode ser considerado uma
Butanamida
m) Isobutilamina
molécula de ________ com um grupo
n) Metilpropilamina
________.
o) Etildimetilamina
p) 2 – metilpropanamida
3) (Univ). S. Judas Tadeu - (SP) O manitol é um
tipo
de
açúcar
utilizado
na
fabricação
de
condensadores de eletrólitos secos, que são
utilizados em rádios, videocassetes e televisores;
por isso, em tais aparelhos, podem aparecer
alguns insetos, principalmente formigas. Se a
fórmula estrutural é:
a) aldeído fenólico
b) cetona carbonila
c) fenol carboxila
d) alcool
e) éster
Qual o nome oficial desse açúcar?
6) (PUCRS/2-2001) A cerveja é fabricada a partir
a) Hexanol
dos grãos de cevada. Seu sabor amargo deve-se
b) Hexanol-1,6
à adição das folhas de lúpulo, que contêm uma
c) 1,2,3-Hexanotriol
substância chamada mirceno, de fórmula
d) 1,2,3,4-tetra-Hidróxi-Hexano
e) 1,2,3,4,5,6-Hexanohexol
4) A fórmula abaixo se refere a um composto que
pertence à função:
Essa substância pode ser classificada como
a) alcool.
b) ácido carboxílico.
c) aminoácido.
28
d) hidrocarboneto.
9)substância utilizada no tratamento de infecções
e) aldeído.
bacterianas. As funções 1, 2, 3 e 4 marcadas na
7) A aspoxicilina, abaixo representada, é uma
estrutura são, respectivamente:
citrato de sildenafil, cuja estrutura é representada
na figura:
a) amida, fenol, amina, ácido carboxílico.
b) amida, amina, alcool, éster.
As funções orgânicas I e II, circuladas na
c) amina, fenol, amida, aldeído.
estrutura do citrato de sildenafil, são:
d) amina, álcool, nitrila, ácido carboxílico.
a) cetona e amina.
e) amida, nitrila, fenol, éster.
b) cetona e amida.
10) O composto antibacteriano ácido oxalínico é
c) éter e amina.
representado pela fórmula estrutural:
d) éter e amida.
e) éster e amida.
8) O aspartame, estrutura representada a seguir, é
uma substância que tem sabor doce ao paladar.
Pequenas quantidades dessa substância são
suficientes para causar a doçura aos alimentos
preparados, já que esta é cerca de duzentas
e apresenta as seguintes funções:
vezes mais doce do que a sacarose.
a) éster, cetona, amina e éter
b) éter, cetona, amina e ácido carboxílico
c) éster, amida, amina e ácido carboxílico
d) éster, amina, fenol e cetona
e) éter, amida, éster e amina
11)Os xampus, muito utilizados para limpar e
embelezar os cabelos, de modo geral, contêm em
As funções orgânicas presentes na molécula
desse adoçante são, apenas,
a) éter, amida, amina e cetona.
b) éter, amida, amina e ácido carboxílico.
c) aldeído, amida, amina e ácido carboxílico.
d) éster, amida, amina e cetona.
e) éster, amida, amina e ácido carboxílico.
sua
constituição,
no
substâncias: detergente,
mínimo,
as
corante,
essência e ácido cítrico (regula o pH).
seguintes
bactericida,
29
As funções orgânicas, presentes na fórmula estrutural
do ácido mencionado, são:
b) amida, alqueno, alcool, amina, fenol.
c) amina, fenol, aldeído, éter, alcool.
a) cetona e alcool
d) cetona, alcool, amida, amina, alqueno.
(b) alcool e aldeído
e) amida, cetona, éter, alcool, amina.
c) ácido carboxílico e alcool
14)Associe os nomes comerciais de alguns
d) ácido carboxílico e aldeído
compostos
e) cetona e éster
condensadas na coluna de cima com os nomes
12) Observe a estrutura da muscona:
oficiais na coluna de baixo.
orgânicos
e
suas
fórmulas
I. Formol (CH2O)
II. Acetileno
III. Vinagre (CH3 – COOH)
IV. Glicerina (CH2OH – CHOH – CH2OH)
(P) Propanotriol
Esta
substância
é
utilizada
em
indústrias
(Q) Ácido etanóico
farmacêuticas, alimentícias e cosméticas, tendo
(R) Metanal
sua maior aplicação em perfumaria. É o princípio
(S) Fenil amina
ativo
(T) Etino
de
uma
secreção glandular externa
produzida por uma espécie de veado que habita a
A associação correta entre as duas colunas é
Ásia Central: os almiscareiros .
a) I-P, II-T, II-Q, IV-R
Os machos dessa espécie produzem a muscona
b) I-Q, II-R, II-T, IV-P
(almíscar), com a finalidade de atrair as fêmeas
c) I-Q, II-T, III-P, IV-R
na época do acasalamento. Em perfumaria, a sua
d) I-R, II-T, III-Q, IV-P
principal aplicação é como fixador de essências.
e) I-S, II-R, III-P, IV-Q
Marque a alternativa que corresponde à função
orgânica que caracteriza a muscona:
a) Ácido carboxílico
15)(ENEM 2011)
A bile é produzida pelo fígado, armazenada na
b) Aldeído
vesícula biliar e tem papel fundamental na
c) Cetona
digestão de lipídeos. Os sais biliares são
d) Éter
esteroides sintetizados no fígado a partir do
e) Fenol
colesterol, e sua rota de síntese envolve várias
13) O acebutolol pertence a uma classe de fármacos
etapas. Partindo do ácido cólico representado na
utilizada no tratamento da hipertensão. Estão
figura, ocorre a formação dos ácidos glicocólico e
presentes na estrutura do acebutolol as seguintes
taurocólico; o prefixo glico- significa a presença
funções:
de um resíduo do aminoácido glicina e o prefixo
tauro-, do aminoácido taurina.
a) éster, alcool, amina, amida, alqueno.
30
substituído pelo enxofre; e Tipo C, no qual dois
oxigênios são substituídos por enxofre.
BAIRD, C. Química Ambiental. Bookmam, 2005.
Um exemplo de pesticida organofosforado Tipo
B, que apresenta grupo etoxi em sua fórmula
estrutural, está representado em:
ácido cólico
UCKO, D.A. Química para as Ciências da Saúde:
uma
Introdução à Química Geral, Orgânica e Biológica. São Paulo:
Manole, 1992 (adaptado).
A combinação entre o ácido cólico e a glicina ou
taurina origina a função amida, formada pela
reação entre o grupo amina desses aminoácidos
e o grupo
a) carboxila do ácido cólico.
b) aldeído do ácido cólico.
c) hidroxila do ácido cólico.
d) cetona do ácido cólico.
17) (ENEM 2009) Sabões são sais de ácidos
e) éster do ácido cólico.
carboxílicos de cadeia longa utilizados com a
finalidade de facilitar, durante processos de
16) (ENEM 2010)
lavagem, a remoção de substâncias de baixa
Os pesticidas modernos são divididos em várias
classes,
entre
as
organofosforados,
quais
materiais
se
destacam
que
os
apresentam
solubiblidade em água, por exemplo, óleos e
gorduras. A figura a seguir representa a estrutura
de uma molécula de sabão.
efeito tóxico agudo para os seres humanos.
Esses pesticidas contêm um átomo central de
fósforo ao qual estão ligados outros átomos ou
grupo de átomos como oxigênio, enxofre, grupos
Em solução, os ânions do sabão podem
metoxi ou etoxi, ou um radical orgânico de cadeia
hidrolisar a água e, desse modo, formar o ácido
longa. Os organosfosforados são divididos em
carboxílico correspondente. Por exemplo, para o
três subclasses: Tipo A, na qual o enxofre não se
estereato de sódio, é estabelecido o seguinte
incorpora na molécula; Tipo B, na qual o
equilíbrio:
oxigênio, que faz dupla ligação com fósforo, é
–
CH3(CH2)16COO +H2O↔CH3(CH2)16COOH+OH
–
31
Uma vez que o ácido carboxílico formado é pouco
solúvel em água e menos eficiente na remoção
de gorduras, o pH do meio deve ser controlado de
maneira a evitar que o equilíbrio acima seja
deslocado para a direita.
Com base nas informações do texto, é correto
concluir que os sabões atuam de maneira
a) mais eficiente em pH básico.
b) mais eficiente em pH ácido.
c) mais eficiente em pH neutro.
2) (ENEM/2010) Os pesticidas modernos são
d) eficiente em qualquer faixa de pH.
divididos em várias classes, entre as quais se
e) mais eficiente em pH ácido ou neutro.
destacam os organofosforados, materiais que
Gabarito:3 - e; 4 - e; 5 - c; 6 - d; 7 - c; 8 - e; 9 - a;
10 - b; 11 - c; 12 - c; 13 - e; 14 - d, 15 - a; 16– e;
apresentam efeito tóxico agudo para os seres
humanos. Esses pesticidas contêm um átomo
central de fósforo ao qual estão ligados outros
17–a.
átomos ou grupo de átomos como oxigênio,
enxofre, grupos metoxi ou etoxi, ou um radical
3.4 Pintou no ENEM
orgânico de cadeia longa. Os organofosforados
1) (ENEM 2009 .Questão 36) O uso de protetores
solares em situações de grande exposição aos
raios solares como, por exemplo, nas praias,é de
grande importância para a saúde. As moléculas
ativas de um protetor apresentam, usualmente,
anéis
aromáticos
conjugados
com
grupos
carbonila, pois esses sistemas são capazes de
absorver a radiação ultravioleta mais nociva aos
seres humanos. A conjugação é definida como a
ocorrência de alternância entre ligações simples e
duplas em uma molécula. Outra propriedade das
moléculas em questão é apresentar, em uma de
suas extremidades, uma parte apolar responsável
por reduzir a solubilidade do composto em água,
o que impede sua rápida remoção quando do
contato com a água.
De acordo com as considerações do texto, qual
das moléculas apresentadas a seguir é a mais
adequada para funcionar como molécula ativa de
protetores solares?
são divididos em três subclasses: Tipo A, na qual
o enxofre não se incorpora na molécula; Tipo B,
na qual o oxigênio, que faz dupla ligação com
fósforo, é substituído pelo enxofre; e Tipo C, no
qual dois oxigênios são substituídos por enxofre.
BAIRD, C. Química Ambiental. Bookman, 2005.
Um exemplo de pesticida organofosforado Tipo B,
que apresenta grupo etoxi em sua fórmula
estrutural, está representado em:
32
Na representação do polímero I, observa-se a
unidade da cadeia polimérica que se repete n
vezes para a formação da macromolécula. Essa
unidade polimérica apresenta um grupo funcional
classificado como
a) amina.
d) hidrocarboneto.
b) amida.
e) éster.
c) aldeído.
Solução
O grupo funcional presente na unidade
polimérica é a amida, que é caracterizada por
uma carbonila (oxigênio) ligada diretamente
a um átomo de nitrogênio (ligação peptídica).
Gabarito: 1-E; 2-E.
3.5 Exercício comentado
Recentemente, pesquisadores criaram um
algodão que é capaz de capturar elevadas
quantidades de água do ar. Eles revestiram
fibras naturais de algodão com o polímero I,
que tem a propriedade de sofrer transições
rápidas e reversíveis em resposta a
mudanças de temperatura. Assim, as fibras
revestidas funcionam como uma “esponja de
algodão”. Abaixo dos 34 °C as fibras do
algodão revestido se abrem, coletando a
umidade do ar. Quando a temperatura sobe,
os poros do tecido se fecham, liberando toda
a água retida em seu interior - uma água
totalmente pura, sem traços do material
sintético.
Alternativa b
33
Capítulo 4 – Isomeria:
3) Isomeria de posição:
Os
isômeros
pertencem
à
mesma
função química, possuem a mesma cadeia
4.1 Teoria
Isômeros são dois ou mais compostos
diferentes que apresentam a mesma fórmula
carbônica, mas diferem pela posição de uma
ramificação ou insaturação.
molecular
O
diferença
fenômeno
nas
da
propriedades
isomeria
dos
causa
compostos
isômeros.
A
isomeria
pode
ser
dividida
em
isomeria plana e espacial.
a) Isomeria Plana ou constitucional:
Ocorre quando os isômeros podem ser
diferenciados observando as fórmulas estruturais
planas.
Classificação:
Classificar os isômeros é dizer qual a
principal diferença entre eles.
4) Isomeria de compensação ou metameria:
1) Isomeria de função:
Ocorre quando os isômeros pertencem
a funções químicas diferentes. São chamados de
isômeros funcionais ou isômeros de função.
Os
isômeros
pertencem
à
mesma
função química, possuem a mesma cadeia
carbônica, mas diferem pela posição de um
heteroátomo.
2) Isomeria de cadeia ou núcleo:
Ocorre quando os isômeros pertencem
a mesma função, mas possuem as cadeias
carbônicas diferentes.
Cadeia
não-ramificada
Cadeia
ramificada
5) Tautomeria:
É um caso particular da isomeria
funcional. Os
dois
isômeros coexistem
em
34
equilíbrio químico dinâmico. Os isômeros são
chamados tautômeros. Os casos mais comuns
ocorrem entre:
Aldeído e enol:
cis- 1,2 – dicloroeteno
trans – 1,2 – dicloroeteno
Condição para isomeria geométrica na
presença de dupla ligação:
Equilíbrio aldo-enólico
Cetona e enol:
R1
R2
\
/
C=C
/
\
R3
R4
R1 ≠ R3 e R2 ≠ R4
b) Isomeria Espacial ou estereoisomeria:
Ocorre quando as diferenças entre os
isômeros só podem ser explicadas pelas fórmulas
1.2) Em compostos cíclicos:
Também
estruturais espaciais. (As fórmulas estruturais
planas são as mesmas).
são
diferenciados
pelos
prefixos cis e trans.
Se divide em isomeria geométrica e
óptica.
1) Isomeria geométrica ou cis-trans:
Ocorre em dois casos:
2) Isomeria óptica:
1.1) Em compostos com ligações duplas:
Ocorre quando a diferença entre os
isômeros está na disposição geométrica dos
grupos ligados aos carbonos que fazem parte da
dupla ligação.
São diferenciados pelos prefixos cis e
trans.
Composto cis: Quando os maiores grupos de
cada carbono estão do mesmo lado da linha
imaginária que passa pela dupla ligação.
Composto trans: Quando os maiores grupos
ligados a cada carbono da dupla ligação estão em
lados opostos da linha imaginária que passa pela
ligação dupla.
Todos
os
isômeros
possuem
propriedades físicas diferentes, tais como PF, PE
e densidade, mas os isômeros ópticos não
possuem esta diferença, ou seja, as propriedades
físicas dos isômeros ópticos são as mesmas.
Então o que os
possível
fazem serem diferentes? É
diferenciá-los?
Sim,
é
possível
diferenciá-los, mas quando eles estão frente à luz
polarizada. Luz polarizada é um conjunto de
ondas eletromagnéticas que se propagam em
apenas
uma
direção.
Uma
lâmpada
incandescente é um exemplo de fonte de luz não
polarizada, pois a luz é emitida em todas as
direções. É possível polarizar luz não polarizada,
35
bastando utilizar um polarizador, que terá função
│
de direcionar apenas uma direção da luz.
d
Exemplos:
Esta seta de duas pontas significa a
propagação
da
onda
eletromagnética
(luz
polarizada) vista de frente.
Isômeros
ópticos(enantiômeros):
Os
isômeros ópticos são capazes de desviar a luz
polarizada, por isso o nome isômeros ópticos (a
diferença está numa propriedade óptica) Caso o
isômero
óptico
provoque
um
giro
da
luz
polarizada no sentido horário, o enantiômero é
denominado dextrorrotatório (D, +). Caso o
enantiômero provoque o giro da luz polarizada no
sentido anti-horário, o composto é chamado
levorrotatório (L, -). O fato de um composto
provocar o giro da luz polarizada faz com que ele
possua atividade óptica.
Atividade óptica só é possível em
moléculas assimétricas, ou seja, moléculas que
possuem carbono quiral ou estereocentro. O
carbono quiral é o carbono que faz quatro
ligações simples e onde esses quatro ligantes são
diferentes.
Carbono quiral (condição):
Temos que o isômero dextrorrotatório
desviará o plano da luz de + a, enquanto o
isômero levorrotatório desviará o plano daluz de –
a. Temos ainda a mistura racêmica (D + L = +a –
a
a=0) que é opticamente inativa, ou seja, não
│
b―C―c
a≠b≠c≠d
desvia o plano da luz polarizada.
36
Mistura
quantidades
racêmica
iguais
de
é
a
mistura
uma
de
imagens de uma molécula são produzidas. Uma
substância
vez prontas, é difícil separá-las. Os ganhadores
levorrotatória e seu enantiômero dextrorrotatório.
do Nobel criaram catalisadores —substâncias que
OBS.:
apressam as reações químicas — que levam
Para uma molécula com n carbonos assimétricos
especificamente à imagem desejada.
diferentes:
Segundo
Número de isômeros ópticos ativos: 2
Número de misturas racêmicas: 2
Compostos
enantioméricos,
n
a
Sociedade
Química
Americana, o mercadomundial para remédios
n-1
desenvolvidos a partir dessapesquisa básica
um
é
imagem
chega hoje a R$ 370 bilhões.
Ao
especular do outro, ou seja, um é imagem
inventar
maneiras
seletivas
de
refletida do outro. No entanto, eles não são
sintetizar compostos químicos, eliminando a
superponíveis. Um exemplo disso, são as mãos,
versão quiralinde seja da, Knowles, Noyori e
direita e esquerda. Uma é a imagem especular da
Sharpless permitiram a produção de:
outra, porém elas não são superponíveis. Tente
• l-dopa, medicamento usado para tratar mal de
verificar este fato com suas mãos, coloque uma
Parkinson;
na frente da outra. (Uma será a imagem da
•
outra). Agora tente colocar uma sobre a outra. As
problemas cardíacos;
mãos não são superponíveis, ou seja, os dedos
• antibióticos;
polegares não ficam um sobre o outro. Considere
• adoçantes e flavorizantes artificiais;
isto como um exemplo para entender o fato da
• inseticidas.
beta-bloqueadores,
drogas
usadas
contra
assimetria molecular
PERIGO:
4.2 Sessão Leitura
No caso de remédios, moléculas quirais podem
Uma Química de aplicações práticas,
ser muito perigosas.
com papel fundamental na criação de novos
Foi o caso da talidomida: só uma das versões
remédios,foi premiada com o Nobel de 2001. Os
servia para tratar náuseas de mulheres grávidas;
vencedores são o japonês Ryoji Noyori e os
a forma espelhada causou muitas deformações
americanos
em fetos humanos, nos anos 60.
William
Knowles
e
K.
Barry
Sharpless.Os cientistas criaram métodos que
permitem, numa reação química, obter um
O composto limoneno dá origem a dois
produto puro e específico. E esse produto pode
aromas diversos – o s-limoneno (levogira) origina
ser, por exemplo, um medicamento contra o mal
cheiro de limão e o r-limoneno (dextrogira), cheiro
de Parkinsonou um remédio para o coração.
de laranja:
A maioria das moléculas da vida existe,
na verdade, em duas formas: uma é como se
fosse a imagem da outra no espelho. São as
moléculas quirais.Apesar de as duas formas
serem quase idênticas, a diferença sutil muda
inteiramente o efeito da substância.
No caso do adoçante aspartame, por
exemplo, uma das imagens é doce; a outra,
amarga.Numa reação química normal, as duas
37
b) etoxietano, 2-propanol e metoxietano.
c) isopropanol, 1-propanol e metoxietano.
d) metoxietano, isopropanol e 1-propanol.
e) 2-propanol, metoxietano e 1-propanol.
3) O odor de muitos vegetais, como o louro, a
cânfora, o cedro, a losna, e a cor de outros, como
a cenoura e o tomate, são devidos à presença de
terpenoides (terpenos).
Os terpenos são o resultado da união de duas ou
mais unidades do isopreno, como se pode ver a
seguir:
Em relação ao isopreno, podemos afirmar que
4.3 Fixação
a) a nomenclatura do isopreno, segundo a IUPAC,
é 2-metil-1-buteno.
b) o
Exercícios:
isopreno
não
apresenta
carbonos
insaturados.
c) o isopreno é isômero de cadeia do 4-metil-2-
1) A respeito dos seguintes compostos, pode-se
afirmar que
pentino.
d) segundo a IUPAC (União Internacional de
Química Pura e Aplicada), a nomenclatura do
isopreno é 2-metil-1,3-butadieno.
e) o isopreno pode apresentar isômeros de
cadeia, funcionais e tautômeros.
a) são isômeros de posição.
4) O butanoato de etila é um líquido incolor,
b) são metâmeros.
empregado como essência artificial em algumas
(c) são isômeros funcionais.
frutas, como, por exemplo, o abacaxi e a banana,
d) ambos são ácidos carboxílicos.
sendo isômero do ácido hexanoico. O tipo de
e) o composto I é um ácido carboxílico, e o
isomeria plana presente entre o butanoato de etila
composto II é um éter.
2) As substâncias A, B e C têm a mesma
fórmula molecular (C3H8O). O componente A tem
apenas um hidrogênio ligado a um carbono
secundário e é isômero de posição de C. Tanto A
quanto C são isômeros de função de B. As
substâncias A, B e C são, respectivamente,
a) 1-propanol, 2-propanol e metoxietano.
e o ácido hexanoico é de
a) cadeia.
b) posição.
c) função.
d) metameria.
e) tautomeria.
5) Com a fórmula molecular C7H8O existem vários
compostos aromáticos, como, por exemplo,
38
NÃO é correto afirmar que _________ são
isômeros de __________.
a) I e II; posição
Considerando os compostos acima, afirma-se
que:
b) I e III; cadeia
c) II e III; função
I. "X" pertence à função química éter.
d) II e IV; cadeia
II. "Y" apresenta cadeia carbônica heterogênea.
III. "Z" apresenta isômeros de posição.
e) I, III e IV; cadeia
8)Em uma aula de química orgânica, o professor
IV. "X", "Y" e "Z" apresentam em comum o grupo
benzila.
escreveu no quadro a fórmula C4H8O e perguntou
a quatro alunos que composto tal fórmula poderia
Pela análise das afirmativas, conclui-se que
representar. As respostas foram
somente estão corretas
a) I e II
b) I e III
c) II e IV
d) I, III e IV
e) II, III e IV
6) Assinale a alternativa que relaciona corretamente
o par de isômeros dados com o tipo de isomeria
O professor considerou certas as respostas
dadas pelos alunos
que apresenta.
a) 1 e 2
b) 1 e 3
c) 2 e 4
d) 3 e 4
e) 1, 2 e 3
9) Para responder à questão, analise as afirmativas
a seguir.
I. Propanal é um isômero do ácido propanoico.
II. Ácido propanoico é um isômero do etanoato de
metila.
III. Etil-metil-éter é um isômero do 2-propanol.
3)
Considerando
os
numerados de I a IV
compostos
orgânicos
IV. Propanal é um isômero do 1-propanol.
Pela análise das afirmativas, conclui-se que
somente estão corretas
a) I e III
b) II e III
c) II e IV
d) I, II e III
e) II, III e IV
10) A proteína do leite apresenta uma composição
variada em aminoácidos essenciais, isto é,
aminoácidos que o organismo necessita na sua
39
dieta, por não ter capacidade de sintetizar a partir
e) tautomeria e posição.
de outras estruturas orgânicas. A tabela a seguir
13) Indique em quais casos é possível haver
apresenta
a
composição
em
aminoácidos
essenciais no leite de vaca.
isomeria geométrica:
a)
b)BrCH ― CHCl
c)H3C ― CH = C ― CH3
│
CH2 ― CH3
d)
Dos aminoácidos relacionados, podemos afirmar
que
e)1,2-diclorociclobutano
a) isoleucina e valina são isômeros de cadeia e, por
apresentarem carbono assimétrico ambos são
f)dimetilciclobutano
opticamente ativos.
b) leucina e isoleucina são isômeros de posição e,
por
terem
carbono
assimétrico,
apresentam
isomeria óptica.
c) leucina e valina são isômeros de função e, por
apresentarem carbono assimétrico, ambos têm
um par de enantiomeros.
d) leucina e isoleucina são isômeros de função e
não são opticamente ativos.
e) valina e isoleucina são isômeros de cadeia,
porém somente a valina é opticamente ativa.
11) São isômeros de função:
a) butano e metilpropano;
b) etanol e éter dimetílico;
c) pentano-2-ona e pentanal;
d) butano-2-ol e butanal;
e) pentanal e pentano-2-ol.
12) Entre os hidrocarbonetos há os seguintes tipos
de isomeria:
14) Para os compostos do exercício anterior, nos
casos em que o composto apresente isomeria
geométrica, representar os seus isômeros.
15)(UFF VESTIBULAR 2005)
Se você sofreu com as espinhas na adolescência
e ficou com o rosto marcado por cicatrizes,
chegou a hora de se ver livre delas. A
reconstituição química para cicatrizes da pele é
um
c) posição e cadeia;
d) metameria e cadeia;
avançado,
realizado
em
consultório médico, que dispensa anestesia. Com
um estilete especial, aplica-se uma pequena
quantidade de ácido tricloroacético (ATA) a 100%,
em cada cicatriz. A substância estimula a
produção de um colágeno e promove um
preenchimento de dentro para fora. É muito mais
poderoso e eficaz do que os peelings tradicionais,
que trabalham com o ATA com, no máximo, 40%
de concentração. A fórmula estrutural do ATA é:
a) função e posição;
b) função e cadeia;
procedimento
Cl
│
Cl ― C ― COOH
│
40
Cl
Assinale a opção correta.
a) Identifica-se entre outras as funções fenol e
Assim sendo, marque a opção correta:
amina.
b) Existem, entre outros, três átomos de carbono
a) O ATA á opticamente ativo e apresenta
isômeros cis e trans
assimétrico (carbono quiral).
c) Verifica-se a existência de cadeia carbônica
b) O ATA é opticamente ativo
alifática insaturada.
c) O ATA é constituído por uma mistura racêmica
d) Existem dois isômeros geométricos para a DOPA.
d) O ATA é opticamente inativo
e) Verifica-se a existência de três átomos de
e) O ATA apresenta, apenas, isomeria cis – trans
carbono primário e de dois átomos de carbono
secundário.
16) (UFF VESTIBULAR 2011)
18) (FUVEST 2012)As fórmulas estruturais de
a) Considere o composto orgânico de fórmula
molecular C2H2Cl2.
alguns
componentes
de
óleos
essenciais,
responsáveis pelo aroma de certas ervas e flores,
1) Represente a fórmula estrutural de todos os
são:
isômeros.
2) Dê a nomenclatura IUPAC de cada um dos
isômeros.
b) Disponha
os
compostos
abaixo
em
ordem
crescente de solubilidade em água e justifique
Dentre esses compostos, são isômeros:
sua resposta.
Ácido etanoico, tetracloreto de carbono e éter
a) anetol e linalol;
etílico.
b) eugenol e linalol;
17) (UFF VESTIBULAR 2008)
A adrenalina é uma substância produzida no
organismo humano capaz de afetar o batimento
cardíaco, a metabolização e a respiração. Muitas
substâncias
preparadas
em
laboratório
são
usadas
indevidamente
como
estimulantes para a prática de esportes e para
causar um estado de euforia no usuário de
drogas em festas raves. A DOPA é uma
substância
intermediária
na
biossíntese
adrenalina.
Observe a estrutura da DOPA.
d) linalol e citronelal;
e) eugenol e anetol.
têm
estruturas semelhantes à adrenalina e em muitos
casos
c) citronelal e eugenol;
da
19)Em 2000, durante pesquisa sobre a Achatina
spp,
uma
das
espécies
do
escargot,
um
pesquisador se feriu. Aproveitou-se o acidente
para testar a propriedade cicatrizante do muco do
animal, aplicando-o sobre o ferimento. Em 2010,
uma década depois, em função de uma nova
pesquisa, aplicou-se o muco sobre mamas de
vacas, antes e depois da ordenha, constatandose que, além de cicatrizante, o muco elimina
agentes infecciosos e hidrata, pois contém
alantoína(C4H6N4O3). Sua fórmula estrutural é a
seguinte:
DOPA
41
Pode-se identificar na estrutura da alantoína a
presença de
a) halogênio e função amida.
b) função cetona e função éster.
2
3
c) carbono sp e carbono sp .
3
d) carbono sp e carbono sp .
e) função cetona e anel aromático.
Gabarito:1- c; 2- e; 3- d; 4- c; 5- b; 6- c; 7- c; 8- b;
9- b; 10- b; 11-a; 12-c; 13- b, c, e, f; 15-d; 17-a;
18- d; 19-c.
4.4 Pintou no ENEM
1)
(ENEM/2010)Vários
materiais,
quando
queimados, podem levar à formação de dioxinas,
um compostos do grupo dos organoclorados.
Mesmo
quando
incineradores,
há
a
queima
liberação
de
ocorre
em
substâncias
tóxica dos 75 isômeros de compostos clorados de
dibenzo-p-dioxina existentes. FADINI, P. S.;
FADINI, A. A. B. Lixo: desafios e compromissos.
Cadernos Temáticos de Química Nova na Escola,
São Paulo, n. 1, maio 2001 (adaptado).
Com base no texto e na estrutura apresentada, as
propriedades químicas das dioxinas que
permitem sua bioacumulação nos organismos
estão relacionadas ao seu caráter
a) básico, pois a eliminação de materiais alcalinos
é mais lenta do que a dos ácidos.
b) ácido, pois a eliminação de materiais ácidos é
mais lenta do que a dos alcalinos.
c) redutor, pois a eliminação de materiais
redutores é mais lenta do que a dos oxidantes.
d) lipofílico, pois a eliminação de materiais
lipossolúveis é mais lenta do que a dos
hidrossolúveis.
e) hidrofílico, pois a eliminação de materiais
hidrosolúveis é mais lenta do que a dos
lipossolúveis.
Gabarito: 1-D
Exercicio Comentado
1)Assinale
a
alternativa
que
relaciona
corretamente o par de isômeros dados com o tipo
de isomeria que apresenta.
derivadas da dioxina no meio ambiente. Tais
compostos
são
produzidos
em
baixas
concentrações, como resíduos da queima de
matéria orgânica em presença de produtos que
contenham cloro. Como consequência de seu
amplo espalhamento no meio ambiente, bem
como de suas propriedades estruturais, as
dioxinas sofrem magnificação trófica na cadeia
alimentar. Mais de 90% da exposição humana às
dioxinas é atribuída aos alimentos contaminados
ingeridos. A estrutura típica de uma dioxina está
apresentada a seguir:
A molécula do 2,3,7,8-TCDD é popularmente
conhecida pelo nome ‘dioxina’, sendo a mais
Solucão:
A alternativa a é de cadeis, a altrnativa b é de
posição a alternativa d é de funcão e a
alternativa e é de posição logo a alternativa
correta é:
Alternativa”c”
42
Capítulo 5 – Propriedades Físicas dos
Compostos Orgânicos
doadoras de par de elétrons.Na teoria de ácidobase de Lewis, o próton
não é o único ácido,
muitas outras espécies também são ácidas.
5.1 Teoria
A Definição de Arrhenius de Ácidos e Bases
5.1.1 Ácidos e bases orgânicos
Ácidos são compostos em solução
Os ácidos e as bases constituem duas
classes
muito
importantes
em
aquosa que ionizam, produzindo como íon
compostos
positivo, apenas o cátion hidrogênio (H ) ou, mais
químicos, inclusive porque reagem facilmente
corretamente, o íon H3O , denominado íon
entre si. Na química orgânica existem várias
hidrônio ou hidroxônio.
+
+
funções com caráter ácido mais ou menos
acentuados;
as
principais
são
os
Bases ou hidróxidos são compostos
ácidos
que, por dissociação iônica, liberam, como íon
carboxílicos, os fenóis e os alcoóis. As principais
negativo,
bases orgânicas são as aminas.
também chamado de hidroxila.
apenas
o
ânion
hidróxido
-
(OH ),
Ordem de acidez (força ácida):
Efeito indutivo:
Álcool < água < fenol < ácido carboxílico
Pode facilitar ou dificultar a ionização do
ácido.
Esta
classificação
é
baseada
na
-
Efeito indutivo negativo (I ):
quantidade de íons H+ liberados pelo ácido em
Os grupos eletroatraentes atraem a
meio a uma reação. Quanto mais H+ mais forte
nuvem eletrônica da molécula em suas direções,
será o ácido.
com isso a ligação O ― H é enfraquecida e se
quebra com maior facilidade. Então já que mais
A Definição de Bnmsted-Lowry de Ácidos e
+
H é liberado para o meio, a força do ácido é
Bases
aumentada.
Grupos eletroatraentes: ― F, ― Cl, ― Br, ― I, ―
De acordo com a teoria de Bnmsted-
NO2, ― OH, ― CN, ― SO3H,
Lowry, um ácido é uma substância que pode doar
(ou perder) um próton, e uma base,é uma
substância que pode aceitar (ou remover) um
próton.
― COOH.
+
Efeito indutivo positivo (I ):
Os grupos eletrorrepelentes possuem
pouca tendência em atrair elétrons, assim há o
A molécula ou íon que se forma quando
fortalecimento da ligação O ― H, e se torna mais
um ácldo perde seu próton é chamado de base
difícil a saída do hidrogênio. Com isso a força do
conjugada desseácido. Já a molécula ou íon que
ácido diminui.
se forma quando uma base aceita um próton é
Grupos eletroatraentes: ― CH3, ― CH2CH3, ―
chamado de ácido conjugado dessa base.
CH2CH2CH3.
A Definição de Lewis de Ácidos e Bases
Ácidos são definidos como receptores
de par de elétrons e bases são definidas como
a) Ácidos carboxílicos:
43
São ácidos de Arrhenius, e ao se
dissolverem em água ionizam-se, formando íons
carboxilato.
Como qualquer efeito elétrico, o efeito
indutivo diminui com o aumento da distância.
Quanto mais afastado do grupo substituinte,
menor a influência sobre a acidez. Os efeitos são
O
O
//
aditivos, quanto maior a quantidade de grupos
//
H3C ― C
→
\
←
substituintes, mais forte a influência sobre a
H3 C ― C + H
+
acidez.
\
OH
O
-
b) Fenóis:
Os ácidos orgânicos são ácidos fracos,
ou seja, apresentam pequeno grau de ionização.
Também
são ácidos de Arrhenius.
Reage com uma base gerando um sal orgânico.
É interessante notar que o efeito indutivo pode
facilitar ou dificultar a ionização do ácido,
tornando-o
mais
forte
ou
mais
fraco,
respectivamente. Os grupos eletrorrepelentes
ligados
à
carboxila
empurram
elétrons,
Da mesma forma que nos ácidos
aumentando a densidade eletrônica do oxigênio
+
da hidroxila. Assim a formação do H é dificultada
carboxílicos, o efeito indutivo pode aumentar ou
e
diminuir a força ácida.
a
força
do
átomo
diminui.
Os
grupos
eletroatraentes retiram elétrons da carboxila,
c) Alcoois:
diminuindo a densidade eletrônica do oxigênio da
hidroxila. Isso dificulta a manutenção da ligação
São compostos anfóteros.
O ― H, tornando-a mais fraca, porque o oxigênio
Quanto maior a polarização da ligação
precisa retirar o elétron do hidrogênio. A força do
C ― OH na direção de OH, maior a capacidade
ácido aumenta.
de formar OH Quanto maior a quantidade de
-.
radicais ligados ao carbono do grupo funcional,
maior a sua densidade eletrônica, maior a
polarização da ligação C ― OH sobre a hidroxila.
O ácido metanóico é mais forte que o
etanóico; este é mais forte que o propanóico e
assim por diante.
A reação entre um ácido carboxílico e
uma base gera um sal orgânico.
Como o grupo alquila apresenta efeito
indutivo positivo, que diminui a acidez, pode-se
dizer que:
44
Alcool 3º< Alcool 2º< Alcool 1º< Metanol
d) Aminas:
São bases de Lewis, pois apresentam
um par de elétrons não compartilhado no átomo
de nitrogênio.
As condições que enriquecem
o nitrogênio em elétrons provocam um aumento
de basicidade. Como os grupos alquila têm
Analisando as substâncias formadas
exatamente esse efeito, notamos que as aminas
com o mesmo tipo de interação intermolecular,
primárias são bases mais fortes que a amônia. As
verificaremos que:
aminas secundárias apresentam dois grupos R
Quanto maior for o tamanho da molécula,
doadores de elétrons e, por isso, são bases mais
maior será a sua temperatura de ebulição.
fortes que as aminas primárias. As aminas
Se
verificarmos
substâncias
terciárias possuem três grupos R, o que poderia
apresentam
moléculas
nos levar a concluir serem estas as mais básicas.
aproximadamente igual, porém com diferentes
Isto, porém, não ocorre. A existência de três
tipos de interação intermolecular, verificaremos
grupos alquila R, muito maiores que o hidrogênio,
que:
de
que
tamanho
em volta do nitrogênio, deixa “pouco espaço” livre
Quanto maior for a intensidade das forças
para aproximação de um ácido de Lewis e
intermoleculares,maior
formação de ligação dativa característica. Este
temperatura de ebulição.
será
a
sua
de
Para que se possa estabelecer essa
impedimento espacial ou impedimento estérico.
relação, deve-se considerar a ordem crescente da
Assim, para aminas alifáticas temos:
intensidade das interações, que é dada por:
fenômeno
é
conhecido
pelo
nome
dipolo induzidodipolo induzido
Amina 3ª < Amônia < Amina 1ª < Amina 2ª
As
aminas
aromáticas
são
pontes de
< dipolo-dipolo <
Série
bases
a
hidrogênio
heteróloga:
substâncias
que
diferentes
funções
que
fraquíssimas (ainda mais fracas que as aminas
pertencem
e
alifáticas terciárias). Como sabemos, o par de
apresentam o mesmo número de carbonos.
Série isóloga: apresentam o mesmo
elétrons não compartilhado do nitrogênio é o
número de átomos de carbono, diferindo apenas
responsável pela basicidade.
na sua insaturação
5.1.2 Temperatura de ebulição
São dois os fatores que influem nas
temperaturas
de
ebulição:
o
tamanho
5.1.3 Solubilidade
das
A solubilidade dos compostos orgânicos
moléculas e os tipos de interação intermolecular.
também
depende
intermoleculares.Assim,
apresentam
os
mesmos
das
forças
substâncias
tipos
de
que
força
45
intermolecular tendem a se dissolver entre si.
5.3 Fixação
Generalizando, temos:
Líquidos apolares tendem a se dissolver em
1) A seguir, temos cinco compostos orgânicos.
Indique qual deles é o mais solúvel em água e
justifique sua resposta.
líquidos apolares.
Líquidos polares tendem a se dissolver em
líquidos polares.
O etanol, embora seja considerado um
a)
Br2
b)
CO2
c)
H3C ─ CH2 ─ CH2 ─ CH2 ─ CH2 ─ CH3
d)
H3C ─ CH2 ─ OH
solvente polar, apresenta uma parte polar (— OH)
e outra apolar (CH). Devido a essa característica,
se dissolve tanto em água (solvente polar) como
em gasolina (solvente apolar).
Pode-se notar que, à medida que
aumenta a cadeia carbônica do álcool, sua
solubilidade
em
conseqüência,
água
diminui.
um
aumento
ocorre
Como
de
sua
solubilidade em solventes apolares (gasolina,
óleos etc.).
5.2 Sessão Leitura
e)
CH2
/
H2C
CH2
│
│
H2 C
CH2
/
CH2
2) Indique, em cada item a seguir, a substância
que possui maior ponto de ebulição:
O
óleo
de
cozinha
possui
uma
solubilidade muito pequena em água, primeiro
porque o óleo é apolar e a água é polar, segundo
a)
CH4 ou CH3OH
b)
CH3 CH2CH3 ou CH3CH3
c)
CH3 CH2 CH3 ou CH3CHCH3
│
OH
porque as moléculas de água se atraem e se
agrupam com muita força (por ligação de
hidrogênio)
e
as
moléculas
de
óleo
não
conseguem ficar entre duas moléculas de água
vizinhas.
É
por
hidrocarboneto
solubilidade
em
isso
que
apolar
água.
o
benzeno,
líquido,
As
tem
suas
um
baixa
ligações
3) Qual dos compostos abaixo é mais solúvel em
água?
a)
Pentano
b)
Éter comum
c)
Metanol
d)
Tetracloreto de carbono
e)
Benzeno
intermoleculares são dipolo instantâneo-dipolo
induzido, que são mais fracas do que as ligações
de hidrogênio que as moléculas de água realizam
entre si. Portanto, o benzeno não consegue
separar as moléculas de água e interagir com
elas. (Disponível em:
<http://www.mundoeducacao.com/quimica/solubili
dade-dos-compostos-organicos.htm> Acesso em
14 de maio de 2014)
4) (Cesgranrio-RJ) "Uma blitz de fiscais da ANP
(Agência Nacional de Petróleo) (...) interditou
46
19 postos de combustíveis em São Paulo (...), 14
deles por venda de gasolina adulterada." Jornal do
Brasil, 09/09/98.
c)
aumento do número de interações intermoleculares
do tipo Van der Waals.
d)
A gasolina, composta basicamente por uma mistura
de alcanos na faixa de C6a C12 ‚ átomos de carbono,
pode ser facilmente adulterada com substâncias
mais baratas do que ela. De acordo com a regra de
que "semelhante dissolve semelhante", assinale a
opção que contém a única substância que, ao ser
adicionada à gasolina, irá formar uma mistura
heterogênea.
a) Água
Maiores pontos de ebulição devido ao
Menores pontos de ebulição devido à
diminuição do número de interações
intermoleculares do tipo Van der Waals.
e)
Menores pontos de ebulição, pois o aumento
da cadeia carbônica diminui a polaridade do grupo
OH.
6)
(UFC-CE)
c) Hexano
atividade
bactericida
de
determinados compostos fenólicos deve-se, em
parte,
b) Hexanol
A
à
atuação
desses
compostos
como
detergentes, que solubilizam e destroem a
membrana celular fosfolipídica das bactérias.
Quanto menor for a solubilidade dos compostos
d) Benzeno
fenólicos
em
água,
maior
será
a
ação
antisséptica. Com relação às solubilidades dos
e) 2-decanona
5) (UFRS-RS) O gráfico a seguir apresenta os
compostos fenólicos I, II e III, em água, identifique
a opção correta:
dados de massa molecular (M) X ponto de ebulição
(P.E.) para os quatro primeiros termos da série
homóloga dos álcoois primários.
a) I é mais solúvel que II e II é mais solúvel que III.
b) I é menos solúvel que II e II é menos solúvel que
III.
c) II é menos solúvel que I e I é menos solúvel que
III.
d) II é mais solúvel que I e I é mais solúvel que III.
Analisando-se os dados apresentados, verifica-se
e) I, II e III têm, individualmente, a mesma
que os álcoois com massa molecular mais elevada
solubilidade.
apresentam:
a)
Maiores pontos de ebulição devido à formação
Gabarito:
de pontes de hidrogênio intermoleculares.
1) Alternativa “d”. O etanol (H3C ─ CH2 ─ OH),
b)
conhecido como álcool etílico, dissolve-se em
Maiores pontos de ebulição devido à
polaridade do grupo OH.
água em quaisquer proporções. Suas moléculas
são polares, assim como as moléculas de água, e
a presença do grupo OH possibilita ligações de
47
hidrogênio entre as moléculas de etanol e de
água, contribuindo para a miscibilidade de uma
substância na outra.
2) a)
CH3OH: A presença do grupo OH possibilita
ligações de hidrogênio entre as moléculas,
dificultando a mudança de estado físico e resultando
num maior ponto de ebulição.
A molécula do 2,3,7,8-TCDD é popularmente
b)
CH3 CH2CH3: Quanto maior a massa molar,
maior o ponto de ebulição.
conhecida pelo nome ‘dioxina’, sendo a mais
tóxica dos 75 isômeros de compostos clorados de
c)
CH3CHCH3: Mesmo motivo apresentado na
letra a.
│
OH
dibenzo-p-dioxina existentes.
FADINI, P. S.; FADINI, A. A. B. Lixo: desafios e
compromissos. Cadernos Temáticos de
Química Nova na Escola, São Paulo, n. 1, maio
3) Alternativa “c”. Apenas o metanol (CH3OH) é
2001 (adaptado).
polar como a água.
Com base no texto e na estrutura apresentada, as
propriedades
4-A; 5-A; 6-A
químicas
das
dioxinas
que
permitem sua bioacumulação nos organismos
estão relacionadas ao seu caráter
a) básico, pois a eliminação de materiais alcalinos
5.4 Pintou no ENEM
é mais lenta do que a dos ácidos.
1)
(ENEM/2010)
Vários
materiais,
quando
b) ácido, pois a eliminação de materiais ácidos é
queimados, podem levar à formação de dioxinas,
mais lenta do que a dos alcalinos.
um compostos do grupo dos organoclorados.
c) redutor, pois a eliminação de materiais
Mesmo
redutores é mais lenta do que a dos oxidantes.
quando
a
queima
ocorre
em
substâncias
d) lipofílico, pois a eliminação de materiais
derivadas da dioxina no meio ambiente. Tais
lipossolúveis é mais lenta do que a dos
compostos
hidrossolúveis.
incineradores,
há
liberação
são
produzidos
de
em
baixas
concentrações, como resíduos da queima de
e) hidrofílico, pois a eliminação de materiais
matéria orgânica em presença de produtos que
hidrosolúveis é mais lenta do que a dos
contenham cloro. Como consequência de seu
lipossolúveis.
amplo espalhamento no meio ambiente, bem
como de suas propriedades estruturais, as
2) (ENEM/2012) Em uma planície, ocorreu um
dioxinas sofrem magnificação trófica na cadeia
acidente
alimentar. Mais de 90% da exposição humana às
derramamento de grande quantidade de um
dioxinas é atribuída aos alimentos contaminados
hidrocarboneto que se apresenta na forma
ingeridos. A estrutura típica de uma dioxina está
pastosa à temperatura ambiente. Um químico
apresentada a seguir:
ambiental utilizou uma quantidade apropriada de
ambiental
em
decorrência
do
uma solução de para-dodecil-benzenossulfonato
de sódio, um agente tensoativo sintético, para
diminuir os impactos desse acidente.
48
Essa intervenção produz resultados positivos
para o ambiente porque
a) promove uma reação de substituição no
hidrocarboneto,
tornando-o
menos
letal
ao
ambiente.
b) a hidrólise do para-dodecil-benzenossulfonato
Polar/DD/Solúvel (éter etílico)
de sódio produz energia térmica suficiente para
vaporizar o hidrocarboneto.
c) a mistura desses reagentes
provoca a
combustão do hidrocarboneto, o que diminui a
quantidade dessa substância na natureza.
Solução:
d) a solução de para-dodecil-benzenossulfonato
possibilita a solubilização do hidrocarboneto.
e)
o
reagente
adicionado
provoca
uma
solidificação do hidrocarboneto, o que facilita sua
retirada do ambiente.
Gabarito: 1-D; 2-D; 3-C
5.5 Exercício comentado:
1)Três líquidos puros apresentam as
propriedades relacionadas na tabela:
Líqido
A
B
C
Ponto de ebulição (ºC)
36,2
34,6
117,7
Solubilidade em
água 9G/100 CM3)
0,036
7,5
7,9
Utilizando essas propriedades, associe cada um
dos líquidos às substâncias: n-butanol,
C4H9OH; n-pentano, C5H12; e éter etílico
(C2H5)2O. Explique o raciocínio usado na
identificação.
Polar/LH/Solúvel (n-butanol)
Apolar/DDI/Praticamente insolúvel(n-pentano)
O n-pentano por ser praticamente insolúvel em
água é a substância A.
Como o n butanol apresenta ligações de
hidrogênio, ele deve ser o composto de maior
PE(LH são forças intermoleculares mais fortes)ou
seja a subtâcia C; por exclusão o éter etílico é a
substância B
49
(S). Quando um reagente eletrófilo combina-se
com um substrato, temos uma reação eletrofílica.
Capítulo 6 – Reações Orgânicas:
Reagente nucleófilo:
É um reagente que apresenta um par de
6.1 Teoria
elétrons disponível para efetuar uma ligação e
que, por isso, procura ligar-se a um átomo capaz
Cisão ou ruptura das ligações: Uma
de aceitar esses elétrons. O reagente nucleofílico
ligação covalente sempre é formada por um par
é um reagente que cede elétrons.
de elétrons. Se essa ligação for desfeita, esses
Existem
elétrons podem apresentar destinos diferentes,
químicas
agentes como calor, luz, solventes, etc.
homólise denominam-se radicais livres. Esses
ocorrer
com
estas
nula
e,
ou grupo de átomos.
1) Alcanos:
por
Os alcanos possuem baixa tendência de
apresentarem elétron desemparelhado, são muito
reagir, mas sob condições vigorosas (luz de
instáveis e reativos.
podem
molécula orgânica é substituído por outro átomo
entre os átomos ligantes. Os resultantes de uma
elétrica
que
Um átomo ou grupo de átomos de uma
elétrons da ligação são igualmente repartidos
carga
de
a) Reações de substituição:
A ruptura ocorre de modo que os
têm
milhões
substâncias é enorme.
Cisão homolítica ou homólise:
radicais
natureza
substâncias orgânicas. A quantidade de reações
dependendo dos elementos que se ligam e de
na
frequência específica e
Cisão heterolítica ou heterólise:
A ruptura ocorre de modo que os
elétrons da ligação ficam com apenas um dos
átomos ligantes. Os resultantes de uma heterólise
são cátions e ânions. Esses íons formados
calor), eles sofrem
reações de substituição.
Halogenação:
É a reação entre um alcano e um
halogênio, onde um átomo de hidrogênio do
alcano é substituído por um halogênio.
podem ser estáveis ou muito instáveis, sendo que
Ordem de reatividade:
maior instabilidade significa maior capacidade de
reação.
Classificação dos reagentes:
Os reagentes que se combinam com os
compostos orgânicos podem ser classificados
como eletrofílicos ou nucleofílicos, conforme sua
capacidade de utilizar ou fornecer elétrons para o
reagente orgânico.
Reagente Eletrófilo:
É um reagente que se apresenta com
deficiência de elétrons e que, por isso, procura
ligar-se a um átomo capaz de oferecer-lhe
elétrons. O reagente eletrófilo é um reagente que
F2 > Cl2 > Br2 > I2
Reações com flúor (F2) são muito
perigosas
devido
a
alta
reatividade
elemento e com o iodo (I2) são lentas.
Exemplos:
CH4+Cl2 →CH3 ― Cl + HCl
CH3 ―CH3+Br2― CH3 ― CH2 ― Br + HBr
A
halogenação
de
alcanos
reagente é normalmente denominado substrato
pode
produzir isômeros, em caso do alcano possuir
mais de uma possibilidade de átomos de
hidrogênio a serem substituídos.
procura elétrons.
O composto orgânico que recebe o
deste
Ordem de reatividade:
50
A alquilação e a acilação de FriadelH
H
C
Crafts foram descobertas em 1877 pelo francês
│
│
│
Charles Friedel e pelo americano James Crafts. E
H―C―H < C―C―C < C―C―C
│
│
│
H
H
H
nos dois casos, o AlCl3 são usados como
catalisadores.
Nitração:
Reação entre um alcano e o ácido
nítrico (HNO3).
Dirigênciadasubstituiçãonosaromáticos:
Alguns
Neste processo, um hidrogênio (H) é
ao
anel
produto formado seja uma mistura dos isômeros
CH4 + HO ― NO2 → H3C ― NO2+ HOH
orto e para ou apenas o produtona posição meta.
Sulfonação:
Grupos orto-para dirigentes: ― F, ― Cl, ― Br, ―
É a reação entre um alcano e o ácido
I, ― OH, ― NH2, ― CH3 , ― CH2 ― CH3.
sulfúrico (H2SO4).
Grupos meta-dirigentes: ― COH, ― COOH,
CH4 + HO ― SO3H → H3C ― SO3H+ HOH
O
ΙΙ
2) Aromáticos:
ligados
aromático dirigem a substituição para que o
substituído por um grupo – NO2.
grupos
― NO2, ― SO3H, ― CN, ― C ― CH3.
Halogenação:
É catalisada por AlCl3, FeCl3 ou FeBr3.
b) Reações de adição:
Ocorrem quando um átomo proveniente
de uma substância orgânica ou inorgânica se
adiciona à uma substância orgânica.
São caracterizadas pela quebra das
Nitração:
ligações duplas e triplas.
É catalisada por H2SO4 concentrado.
Hidrogenação catalítica:
Ocorre em alcenos e alcinos. O gás
Sulfonação:
É catalisada por H2SO4 fumegante, ou
seja, contem SO3 dissolvido.
hidrogênio (H2) é adicionado com a ajuda de um
catalisador. Pode ser usado o metal níquel (Ni),
platina (Pt ou paládio (Pd).
Também podemos chamar esta reação
de reação de Sabatier-Senderens. Constitui um
meio de obter alcanos a partir de alcenos.
Acilação de Friedel-Crafts:
Um hidrogênio é substituído por um
grupo acila.
Alquilação de Friedel-Crafts:
Um hidrogênio é substituído por um
grupo alquila.
Na indústria química de alimentos é
muito conhecida. Serve de base para a produção
de margarinas a partir de óleos vegetais.
Os óleos vegetais possuem ligações
duplas. A reação de adição, hidrogenação
catalítica, transforma esses óleos, que são
líquidos em gorduras, que é sólida.
51
Alceno:
Adição de HCl, HBr ou HI. Os próprios
+
Ni
íons H liberados pelo haleto de hidrogênio são
H2C = CH2+ H ― H → H3C ― CH3
usados como catalisadores.
∆
Alcenos:
H2C = CH2 + H ― Cl → H2C ― CH2
Alcino: Pode sofrer uma ou duas adições,
│
│
dependendo da quantidade de reagente.
H
Cl
Ni
Alcinos:
HC ≡ CH + H ― H → H2C = CH2 (proporção de
HC ≡ CH + H ― Cl → HC = CH
∆
1:1)
Ni
Adição de halogênio (Cl2 ou Br2) ao
Cl
│
│
H
Cl
Adição de água:
Também chamada de hidratação. Esta
alceno, alcadieno ou alcino. O produto é um dihaleto vicinal, pois os átomos de halogênios estão
H
H2C = C = CH2+ H ― Cl → H2C ― C = CH2
∆
Halogenação:
│
Alcadienos:
H2C = CH2 + H ― H → H3C ― CH3 (proporção de
1:2)
│
+
reação é catalisada por ácido (H ). Obtém ácidos
a partir de alcenos.
posicionados em carbonos vizinhos.
Alceno:
Não necessita de catalisadores.
H+
H2C = CH2+ H ― OH→ H2C ― CH2
Alceno:
H2C = CH2 + Cl ― Cl → H2C ― CH2
Alcino:
Segue
os
│
│
Cl
Cl
mesmos
da
OH
Não acontece a segunda adição, nem
fato de ser o produto formado na primeira adição
│
ser um enol, que por ser instávelse transforma em
Br
aldeído
Alcadieno:
H2C = C = CH2+ Cl ― Cl → H2C ― C = CH2
│
│
ou
cetona,
alcino
│
H
OH
Regra de Markovnikov:
│
H2C = C = CH2 + 2 Cl ― Cl → H2C ― C ― CH2
Adição de haletos de hidrogênio (HX):
do
utilizado.
│
Cl Cl
│
dependendo
HC ≡ CH + H ― OH → HC = CH
Cl Cl
H
mesmo utilizando excesso de água. Devido ao
HC ≡ CH + Br ― Br → HC = CH
Br
│
Alcino:
moldes
hidrogenação.
│
│
│
│
Cl
Cl
”Nas reações de adição de HX (X =
halogênio) ou H2O, o hidrogênio é adicionado ao
carbono mais hidrogenado da ligação dupla.”
52
Esta regra serve somente para o cloro.
Eliminação de Halogenidretos:
Para o bromo, serve a regra Antimarkovnikov,
Halogenidretos, como HCl, HBr e HI
que é o inverso da Markovnikov.
podem ser eliminados a partir de um haleto de
Markovnikov:
alquila, catalisado por uma base, que pode ser o
H3C – CH = CH2 + H ― Cl → H3C ― CH ― CH2
KOH e um álcool.
│
│
Cl
H
Exemplo:
H3C – CH = CH2+ H ― OH → H3C ― CH ― CH2
│
│
OH
H
Eliminação de Água:
Antimarkovnikov:
A desidratação intramolecular de álcool
catalisada por ácido sulfúrico concentrado e calor
H3C – CH = CH2 + H – Br → H3C – CH - CH2
Esta regra também
│
│
H
Br
(170°C) ocorre com a eliminação de água e
alceno.
é válida para
alcinos.
c) Reações de eliminação:
Outra desidratação que pode ocorrer é a
São as reações onde alguns átomos ou
intermolecular de dois álcoois formando éter e
grupo de átomos são eliminados da molécula
eliminando água. A reação deve ser catalisada
orgânica.
por ácido sulfúrico concentrado e calor (140°C).
É o inverso das reações de adição. Têm
grande importância para a indústria química, na
produção de polietileno que é a matéria-prima
Então:
para a obtenção de plásticos.
1 molécula alcool = desidratação intramolecular =
Eliminação de Hidrogênio ou Desidrogenação:
alceno
A partir de alcano é possível obter um
alceno, catalisado por calor.
2 moléculas alcool = desidratação intermolecular
= éter
A Reação de saponificação também é
Exemplo:
conhecida como hidrólise alcalina, através dela é
que se torna possível o feitio do sabão. Falando
quimicamente, seria a mistura de um éster
(proveniente de um ácido graxo) e uma base
Eliminação de Halogênio ou De-Halogenação:
Di-haletos vicinais reagindo com zinco
(hidróxido de sódio) para se obter sabão (sal
orgânico).
catalisado por um alcool formam alcenos.
Exemplo:
A equação abaixo demonstra este processo:
Éster + base forte → sabão + glicerol
Praticamente todos os ésteres são retirados de
óleos e gorduras, daí o porquê das donas de casa
53
usarem o óleo comestível para o feitio do sabão
caseiro.
Equação
genérica
da
hidrólise
alcalina:
Com ácido, observa-se a forma do éster
marcado, e não água, contendo assim O – 18.
Para acelerar a reação, usa-se o ácido
A equação acima representa a hidrólise
como catalisador.
alcalina de um óleo (glicerídeo). Dizemos que é
uma hidrólise em razão da presença de água
(H2O) e que é alcalina pela presença da base
NaOH (soda cáustica). O símbolo ∆ indica que
houve aquecimento durante o processo.
Produtos da reação de Saponificação:
sabão e glicerol (alcool).
Reação de esterificação
Há basicamente dois tipos de hidrólise
de ésteres: ácida e básica.
A reação de esterificação é considerada
A hidrólise ácida ocorre em meio ácido e
uma reação reversível de alcool junto com um
ácido orgânico ou inorgânico, produzindo éster e
é um processo reversível, gerando um alcool e
água.
um ácido carboxílico:
R ― COO ― R1+HOH
Já quando areação é inversa, ela é
R-COOH + HO ― R1
A hidrólise básica, ou saponificação, é
denominada hidrólise do éster.
realizada em meio básico. Trata-se de um
processo irreversível, gerando alcool e um sal de
ácido carboxílico:
-
+
R―COO―R1+BOH(aq) → R―COO B + HO―R1
Onde BOH é uma base, por exemplo,
KOH.
O equilíbrio pode ser deslocado para o
lado
do
éster,
desidratante.
quando
Durante
o
se
junta
com
experimento
o
d) Reações de oxidação:
ficou
comprovado que na reação de esterificação o
As
oxigênio do grupo OH do álcool continua na
reações
de
oxidação
das
substâncias orgânicas devem ser catalisadas por
molécula do éster e o oxigênio do grupo OH do
um agente oxidante.
ácido é eliminado sob a forma de H2O (água),
Alcenos:
produzindo a reação de um álcool marcado:
Oxidação branda do alceno:
54
Conhecida
como
di-hidroxilação
do
Há quebra da ligação dupla causada
alceno.
pelo ozônio (O3). Necessita de pó de zinco e deve
O agente oxidante causa uma adição à
ser feita em meio aquoso. O alceno é quebrado
ligação dupla, com entrada de uma hidroxila em
na ligação dupla e um átomo de oxigênio é
cada um dos carbonos da dupla ligação.
adicionado a cada lado da dupla ligação.
O3
Um agente oxidante muito utilizado é o
H3C ― C = CH ― CH3
permanganato de potássio (KMnO4) em solução
diluída e fria, em meio neutro ou levemente
│
básico.
CH3
OH
CH3
Forma-se cetona e aldeído.
CH3
Alcoois:
Em contato com um agente oxidante, os
Oxidação energética de alcenos:
diferentes tipos de alcoois se comportam de
Reação com um agente oxidante que
formas distintas.
seja capaz de quebrar a molécula na ligação
dupla.
Oxidantes
K2CrO7/ H
enérgicos:
KMnO4/H
+
Oxidação de alcoois primários:
Os alcoois primários se oxidam com
e
+
agentes
energéticos,
como
o
de potássio (K2CrO7), em meio sulfúrico. O
[O]
H3C ― C = CH ― CH3 →H3C ― C = O
produto desta oxidação é um aldeído. Com maior
│
enérgico
CH3
oxidantes
permanganato de potássio (KMnO4) e o dicromato
Ligação dupla no meio da cadeia:
│
CH3
H
│
H2O
│
H2O/ Zn
│
│
H3C―C = CH―CH3 → H3C―CH―CH―CH3
│
H3 C ― C = O
+ O = C ― CH3 + HOOH
OH
│
[O] brando
→
quantidade de agente oxidante, obtemos um
CH3
ácido carboxílico.
Esta reação explica porque o vinho fica
com gosto de vinagre quando deixamos muito
O = C ― CH3
+
tempo em contato com o ar (oxigênio). O alcool
│
sofre uma oxidação e transforma-se em vinagre,
OH
que é um ácido carboxílico.
Forma-se cetona e ácido carboxílico.
H
Ligação dupla na ponta da cadeia:
│
[O]
H3C ― CH = CH2
Enérgico
│
OH
+ O = C ― OH → CO2 + H2O
│
OH
Ozonólise:
│
│
│
[O]
OH
→H3C ― C=O
[O]
OH
H3C ― C ― H →H3C ― C = O→H3C ― C = O
O CH2 terminal se transforma em ácido
carbônico, que se decompõe em CO2 e H2O.
H
Oxidação de alcoois secundários:
Obtêm como produtos as cetonas.
OH
CH3
│
I
[O]
H3C ― C ― CH3→ H3C ― C = O → Não reage.
│
OH
55
ligação.Assim,
Oxidação de alcoois terciários:
a
diferença
entre
a
energia
liberada na formação das novas ligações e a
consumida para quebrar as ligações que existem
no explosivo é muito grande.
OH
│
b) Sua decomposição deve ser muito rápida.
[O]
H3C ― C ― CH3 → Não reage
c) Os produtos da decomposição devem ser
│
gases.A formação e a expansão muito rápida dos
CH3
gases
criam
uma
onda
de
choque
que
acompanha a detonação do explosivo.
d) O explosivo deve ser suficientemente estável
para que possamos determinar o momento de
6.2 Sessão Leitura
sua explosão.
A combinação desses fatores leva à
Explosivos
Muitas
das
reações
que
liberam
produção de uma enorme quantidade de calor e
grandes quantidades de energia são reações de
gases,possibilitando
óxido-redução.Por
desejados.
exemplo:
as
reações
de
exemplo
de
combustão
completa
os
objetivos
Entre eles, os mais comuns são:
combustão de hidrocarbonetos e de álcoois. Veja
um
atingir
de
hidrocarboneto:
C8H18(g)+ 25/2 O2(g) -> 8 CO2(g)+ 9H2O(v)
Uma vez iniciada a reação, o oxigênio
rapidamente oxida os átomos de carbono.
Nos
explosivos,
freqüentemente
Trinitrotolueno
encontramos, no mesmo composto, tanto agentes
HMX
(his majesty’s explosive)
oxidantes como agentes redutores. Por exemplo,
a nitroglicerina contém átomos de carbono que
são oxidados formando CO2 e também átomos de
nitrogênio que são reduzidos formando N2:
4 C3H5(NO3)3 (l) ---> 6 N2 (g) + O2(g) + 12 CO2(g)
+ 10 H2O (v)
RDX
Os explosivos de interesse na área
(research department explosive)
militar e na área de construção civil são
compostos orgânicos formados por C, H e
geralmente apresentam os grupos NO2 e O NO2.
O RDX pode ser misturado a ceras ou a
polímeros sintéticos para produzir os explosivos
plásticos.
Porém, qualquer explosivo deve apresentar as
seguintes características:
6.3 Fixação
a) Devem sofrer uma decomposição muito
exotérmica.Para que isso ocorra, é necessário
que o explosivo apresente ligações fracas entre
seus átomos e que forme produtos com ligações
fortes,
isto
é,
com
elevada
energia
de
Exercícios:
1) Das ligações abaixo, qual terá maior tendência
a sofrer ruptura heterolítica?
a) CH3 – H.
56
b) CH3 – CH3.
d) SO3H, NO2, COOH.
c) CH3 – NO2.
e) CH3, Cl, NH2.
d) CH3 – NH2.
6) (UFSE) A mononitração do tolueno (metil-
e) CH3 – F.
benzeno) produz, além de água:
2)Indique,
entre
os
reagentes
abaixo,
o
a) somente o-nitrotolueno.
eletrofílico:
b) somente m-nitrotolueno.
a) NH3.
c) somente p-nitrotolueno.
b) HCN.
d) mistura de o-nitrotolueno e p-nitrotolueno.
+
c) H3O .
e) mistura de o-nitrotolueno e m-nitrotolueno.
d) ROH.
7) O grupo amino (― NH2), ligado ao anel
e) H2O.
benzênico, nas reações de substituição aromática
3) Entre as afirmativas citadas abaixo a única
é orientador:
falsa é:
a) apenas orto.
a) Radicais livres são átomos ou grupos de
b) meta e para.
átomos que possuem pelo menos um elétron
c) apenas meta.
livre.
d) orto e meta.
b) Cisão homolítica (ou homólise) corresponde a
e) orto e para.
uma quebra de ligação, em que cada átomo fica
8) Os lipídeos podem ser classificados como
com seus elétrons, formando radicais livres.
óleos
c) Um carbono carregado negativamente é
chamado de carboânion ou íon carbânion.
d)
Na
cisão
heterolítica
o
átomo
ou
gorduras:
nos
óleos
predominam
cadeias insaturadas e nas gorduras predominam
cadeias saturadas. Com base nessa afirmação,
mais
um
óleo
é
transformado
em
gordura,
eletronegativo fica com o par de elétrons antes
respectivamente, através de um processo, no
compartilhado, formando-se assim íons.
qual ocorre reação de:
e) Reagente eletrófilo é toda espécie química
a) saponificação
que, cedendo um par de elétrons, é capaz de
b) hidrólise ácida
formar uma nova ligação.
c) esterificação
4) A monocloração de um alcano, em presença
d) desidratação
de luz ultravioleta, produziu os compostos 1-cloro-
e) hidrogenação
2-metil-propano
9) Na hidrogenação catalítica do propeno, obtém-
e
2-cloro-2-metil-propano.
O
nome do alcano é:
se:
a) isopropano.
a) propino, cuja fórmula geral é CnH2n – 2.
b) metil-butano.
b) ciclopropano.
c) metano.
c) propano.
d) butano.
d) propadieno.
e) metil-propano.
e) 2-propanol.
5) Das alternativas a seguir, a que contém
10) Com respeito à equação:
somente grupos orientadores META é:
X + HBr →C6H13Br
a) NO2, Cl, Br.
Pode-se afirmar que X é um:
b) CH3, NO2, COOH.
a) alcano e a reação é de adição.
c) CHO, NH2, CH3.
b) alceno e a reação de substituição.
57
c) alceno e a reação é de adição eletrofílica.
15) (Unitau-SP) Para que a oxidação de uma
d) alcano e a reação é de substituição eletrofílica.
substância orgânica com “n” átomos de carbono
e) alceno e a reação é de substituição.
por molécula forneça uma cetona com igual
11) A adição do brometo de hidrogênio ao 3,4-
número de átomos de carbono, essa substância
dimetil-2-penteno forma o composto:
pode ser um:
a) 2-bromo-4-metil-hexano.
a) aldeído.
b) 2-bromo-3-etil-pentano.
b) ácido carboxílico.
c) 3-bromo-2,3-dimetil-pentano.
c) alcool terciário.
d) 3-bromo-3-metil-hexano.
d) alcool secundário.
e) 3-bromo-3,4-dimetil-pentano.
e) alcool primário.
12)(Fuvest-SP) Dois hidrocarbonetos insaturados,
16) A reação de ozonólise dos alcenos produzirá
que
como produto moléculas de:
são
isômeros,
foram
submetidos,
separadamente, à hidrogenação catalítica. Cada
a) dialcoois ou ácidos carboxílicos.
um deles reagiu com H2 na proporção, em mols,
b) alcoois ou fenóis.
de
um
c) cetonas ou aldeídos.
Os
d) cetonas ou ácidos carboxílicos.
1:1,
obtendo-se,
hidrocarboneto
hidrocarbonetos
de
que
em
cada
fórmula
foram
caso,
C4H10.
hidrogenados
e) alcoois ou ácidos carboxílicos.
poderiam ser:
17) O reativo de Baeyer é utilizado para
a) 1-butino e 1-buteno.
diferenciar ciclanos de:
b) 1,3-butadieno e ciclobutano.
a) alcano.
c) 2-buteno e 2-metil-propeno.
b) alceno.
d) 2-butino e 1-buteno.
c) ácido carboxílico.
e) 2-buteno e 2-metil-propano.
d) éter.
13) Na desidratação intramolecular do etanol
e) éster.
obtém-se:
18) (ENEM 2010) No ano de 2004, diversas
a) eteno.
mortes
b) propeno.
zoológico de São Paulo foram evidenciadas.
c) etoxietano (éter dietílico).
Estudos
d) metoximetano (éter dimetílico).
intoxicação
e) 2-buteno.
conhecido como composto 1080 e ilegalmente
14) (Covest-2002) Álcoois não são utilizados
comercializado como raticida. O monofluoracetato
somente como combustíveis, mas também na
de
produção de derivados do petróleo, como, por
monofluoracético
exemplo, alquenos. Qual dos álcoois abaixo
mamíferos bloqueando o ciclo de Krebs, que
produzirá propeno a partir da desidratação em
pode levar à parada da respiração celular
meio ácido?
oxidativa e ao acúmulo de amônia na circulação.
de animais
por
técnicos
sódio
por
é
envenenamento no
apontam
suspeita
monofluoracetato
um
e
derivado
age
no
sódio,
do
organismo
a) 2-metil-2-propanol.
b) etanol.
c) 2-propanol.
d) 2-butanol.
e) 2-metil-1-propanol.
de
de
monofuoracetato de sódio
ácido
dos
58
c) Perda
de
íons
hidroxila
do
ácido
monofluoracético, com liberação de hidróxido de
Disponível em: http://www1.folha.uol.com.br. Acesso em: 05
ago. 2010 (adaptado).
sódio.
d) Neutralização do ácido monofluoracético usando
O monofluoracetato de sódio pode ser obtido pela
hidróxido de sódio, com liberação de água.
e) Substituição dos íons hidrogênio por sódio na
a) Desidratação do ácido monofluoracético, com
do
do
ácido
monofluoracético,
sem
formação de água.
liberação de água.
b) Hidrólise
estrutura
ácido
monofluoracético,
sem
formação de água.
a) Dê o nome oficial (IUPAC) e a fórmula estrutural
19) (UFJF VESTIBULAR 2010) Os resíduos de
do produto da reação entre o brometo de
origem industrial apresentam riscos à saúde
etilmagnésio e o propanal, seguida de adição de
pública e ao meio ambiente, exigindo tratamento
água.
e disposições especiais em função de suas
b) Que composto carbonílico deve reagir com o
características. Dentre esses resíduos, podemos
brometo de etilmagnésio para formar 3-metil- 3-
citar
hexanol?
alguns
óleos
lubrificantes
contendo
hidrocarbonetos saturados e o tíner (uma mistura
c) Considerando a obtenção apenas do produto
de álcoois, ésteres, cetonas e hidrocarbonetos
monossubstituído, represente a estrutura das
aromáticos). Sobre esses resíduos, assinale a
substâncias A, B,C das equações abaixo:
letra que apresenta uma afirmativa INCORRETA.
FeBr
3
a) Os hidrocarbonetos saturados, presentes em
óleos lubrificantes, não reagem em presença de
1)Benzeno + Br2→ A + HBr
cloro e ácido de Lewis (AlCl3), porém podem
2)Benzeno + H3C – Cl →AlCl3 B + HCl
sofrer reação em presença de cloro e luz
3)Benzeno + C → AlCl3 C6H5 – CO – CH2 – CH3 +
ultravioleta;
HCl
b)A acetona pode ser obtida a partir do álcool
isopropílico, usando-se um oxidante como o
permanganato de potássio;
Gabarito: 1-e; 2- c; 3- e; 4- a; 5- d; 6- d; 7- c; 8- e;
c) O acetato de etila, um dos componentes do
9- c; 10- c; 11- e; 12- c; 13- a; 14- c; 15- d; 16- c;
tíner, pode ser obtido a partir da esterificação do
17-b; 18 – d; 19 - d
ácido acético em presença de etanol;
d) A desidratação do n – pentanol, em presença
de ácido sulfúrico diluído e de aquecimento, pode
levar ao 1 – pentenol;
e) A ozonólise do 2 – metil – 2,5 – heptadieno, em
presença de água e zinco, pode fornecer uma
molécula
acetaldeído
de
acetona,
e
uma
uma
molécula
molécula
propanodialdeído.
20) (UFF VESTIBULAR 2011)
de
de
1,36.4 Pintou no ENEM
59
1) (ENEM 2007 .Questão 56)
1)Indique o nome do produto orgânico formado na
Todas as reações químicas de um ser
reação de substituição entre benzeno e bromo:
vivo seguem um programa operado por uma
central de informações. A meta desse programa é
a) dibromobenzeno
a auto-replicação de todos os componentes do
sistema, incluindo-se a duplicação do próprio
programa ou mais precisamente do material no
b) hexabromociclo-hexano
c) bromobenzeno
qual o programa está inscrito. Cada reprodução
pode estar associada a pequenas modificações
d) 1,2-dibromociclo-hex-3,5-dieno
do programa. M. O. Murphy e l. O’neill (Orgs.). O
que é vida? 50 anos depois — especulações
sobre o futuro da biologia. São Paulo: UNESP.
e) metilpropanobenzeno
Solução:
1997 (com adaptações).
São indispensáveis à execução do
“programa”
mencionado
acima
processos
relacionados a metabolismo, autoreplicação e
mutação,
que
podem
ser
exemplificados,
Reação de substituição bromação do benzeno
respectivamente, por:
(A) fotossíntese, respiração e alterações
na seqüência de bases nitrogenadas do código
genético.
(B) duplicação do RNA, pareamento de
bases nitrogenadas e digestão de constituintes
dos alimentos.
(C)
excreção
de
compostos
nitrogenados, respiração celular e digestão de
constituintes dos alimentos.
(D) respiração celular, duplicação do
DNA e alterações na seqüência de bases
nitrogenadas do código genético.
(E) fotossíntese, duplicação do DNA e
excreção de compostos nitrogenados.
Gabarito: 1-D
Exercício Comentado
Logo resposta alternativa“c”
60
Referências
FELTRE, R.Fundamentos da química: Volume único. 3ª. São Paulo:Moderna,2001.
SOLOMONS, T.W.G.Química orgânica I: Volume 1. 7ª. Rio de Janeiro:LTC, 2000.
TITO;CANTO.Química na abordagem do cotidiano. 2ª Ed. Volume 3. Moderna.
FELTRE.Química Orgânica. 5ª edição. Volume 3. Moderna.
USBERCO, João.Química: Volume único.São Paulo : Saraiva, 2002.
Apostila do curso pré-vestibular do Colégio Imaculada Conceição – 2007.
Brasil Escola. Disponível em:<www.brasilescola.com>. Acesso em 10 mar. 2015.
Portal de Química. Disponível em:<www.soq.com.br>. Acesso em: 25 fev. 2015.
Química. Prof. João Neto. Disponível em:<www.projoaoneto.com.br>; Acesso em: 23 fev. 2015.