Formulação e
Nomenclatura de
Compostos Inorgânicos
Compostos iônicos
• Regra geral:
Nomenclatura: (nome do ânion) de (nome do cátion)
Exemplos: Brometo de sódio, sulfato de potássio, cianeto de
lítio, cloreto de cálcio
Formulação:
x
y
M A M y Ax
Ácidos
Função dos compostos inorgânicos
que, em água, se ionizam, liberando
H+ como único próton
Ácidos binários
• São compostos por hidrogênio + ânion
• Nomenclatura: ácido (nome do ânion)ídrico
Ácido clorídrico
HI
HBr
Ácido sulfídrico
Ácido fluorídrico
No Tratado Elementar da Química,
Lavoisier escreveu...
• “Embora não se tenha chegado nem a compor nem a
decompor o ácido que se retira do sal marinho, não se
pode duvidar, entretanto, que ele é formado, como
todos os outros, da reunião de uma base acidificável
com o oxigênio. Chamamos essa base desconhecida de
base muriática, da palavra latina muria, dada
antigamente ao sal marinho.”
• Oxigênio Oxi = ácido, gênio = gênese, geração
Ácidos ternários - Oxiácidos
• Ácidos que possuem um elemento principal ligado a oxigênio
hidrogênio
– Oxiácidos -chave: Ácido + (nome do elemento)ico
H2SO4
HNO3
H3PO4
H2CO3
HCℓO3
Derivados dos oxiácidos-chave
• Adição de um átomo de oxigênio
– Ácido + per(+nome do ácido).
HCℓO4 - Ácido perclórico
• Remoção de um átomo de oxigênio
– Ácido + nome do elemento(+oso)
HNO2 : Ácido nitroso
H 2 SO3 : Ácido sulfuroso
HClO2 : Ácido cloroso
• Remoção de dois átomos de oxigênio
– Ácido + (hipo)nome do elemento(+oso)
HCℓO: Ácido hipocloroso
Bases
Função inorgânica dos compostos
que, em água, se dissociam,
liberando OH- como único ânion
x
y
M A M y Ax
• Bases – hidroxila (hidróxido) como ânion, ligado a um
cátion de metal.
– Hidróxido de + nome do metal
NaOH : Hidróxido de sódio
KOH :
Ba (OH ) 2 :
Fe(OH )3 :
Au (OH )3 :
CuOH :
Zn(OH ) 2 :
NH 4OH :
Sais
Função inorgânica dos compostos que,
em água, se dissociam, liberando pelo
menos um ânion diferente de OH- e um
cátion diferente de H+
Sais binários
M x A y M y Ax
• Nome do cátion + nome do ânion(eto)
NaCℓ
Brometo de prata
Cloreto de cálcio
FeS
KCN
Iodeto de ferro (III)
Sais ternários
M x A y M y Ax
• Possuem ânions derivados dos oxiácidos. Trocar terminações:
– “ico” por “ato”
Sulfato
Carbonato
Nitrato
Fostato
– “oso” por “ito”
Sulfito
Nitrito
Hipoclorito
Sais
M x A y M y Ax
(nome do ânion) de (nome do cátion)
Cloreto de bário
Na2SO4
Fluoreto de magnésio
FeCℓ2
Nitrato de prata
Fosfato de magnésio
CaCO3
KNO2
Óxidos
São compostos binários cujo ânion é
o oxigênio
Óxidos Iônicos
• Nomenclatura: óxido de (nome do metal)
Óxido de cálcio
Na2O
Óxido de ferro (III)
FeO
• Óxidos de elementos da família 1 A e 2 A são básicos.
Ou seja, em água, formam os respectivos hidróxidos
Compostos Moleculares
• Não existe uma regra geral para a formulação, mas para a
nomenclatura, utilizam-se os prefixos para indicar a atomicidade
dos elementos
Prefixo
Significado
Mono
1
Di
2
Tri
3
Tetra
4
Penta
5
Hexa
6
Hepta
7
Octa
8
Nona
9
Deca
10
Óxidos moleculares
Monóxido de carbono
Dióxido de carbono
Pentóxido de difósforo
Trióxido de enxofre
Decóxido de tetrafósforo
Compostos moleculares
Ax By
• Atenção para os seguintes nomes de hidretos
moleculares:
NH 3 :
Amônia
H 2O :
Água
PH 3 :
Fosfina
SiH 4 :
Silano
H 2O2 :
Peróxido de hidrogênio
Casos Especiais
NH
e
NH
3
4
• Amônia e Amônio:
– Hidróxido de amônio, cloreto de amônio, fosfato de amônio
NH 4OH , NH 4Cl , NH 4 3 PO4
• Cromato, Dicromato: CrO42 e Cr2O72
– Cromato de sódio, dicromato de potássio, cromato de bário,
dicromato de amônio...
Na2CrO4 , K2Cr2O7 , BaCrO4 , NH 4 2 Cr2O7
• Sais hidratados
– Adicionar “prefixo grego + hidratado após o nome do sal.
CuSO4 .5H 2O
LiF .H 2O
CaCl2 .2H 2O
Casos Especiais
• Peróxidos:
O22
– Só ocorre com cátions das famílias IA e IIA.
Na2O2 : Peróxido de sódio
K 2O2 : Peróxido de potássio
CaO2 : Peróxido de cálcio
SnO2 : Óxido de estanho
• Oxiácidos ionizados parcialmente:
– Bicarbonato = hidrogenocarbonato HCO3
– Bisulfito = hidrogenosulfito HSO
3
•
MnO
4
Permanganato:
– Permanganato de potássio KMnO4
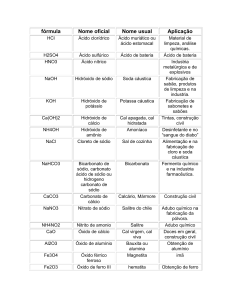
Fórmula
Nome ordinário
Nome IUPAC
H2O
Água
Óxido de diidrogênio
H2O2
Água-oxigenada
Peróxido de hidrogênio
CO2
Gelo-seco
Dióxido de carbono
NaCl
Sal de cozinha(marinho)
Cloreto de sódio
N2O
Gás hilariante, óxido nitroso
Monóxido de dinitrôgênio
CaCO3
Calcário, mármore
Carbonato de cálcio
CaO
Cal virgem (viva)
Óxido de cálcio
Ca(OH)2
Cal queimada (apagada)
Hidróxido de cálcio
Mg(OH)2
Leite de Magnésia
Hidróxido de magnésio
CaSO4
Gesso
Sulfato de cálcio
Na2CO3
Soda
Carbonato de sódio
NH4OH
Amoníaco
Hidróxido de amônio
KNO3/NaNO3
Salitre/Salitre do Chile
Nitrato de potássio/ de sódio
HCl
Ácido Muriático
Ácido Clorídrico
NO
Óxido nítrico
Monóxido de nitrogênio