QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
Pós-Graduação – Instituto de Química – USP – 2012
1ª Lista de Exercícios
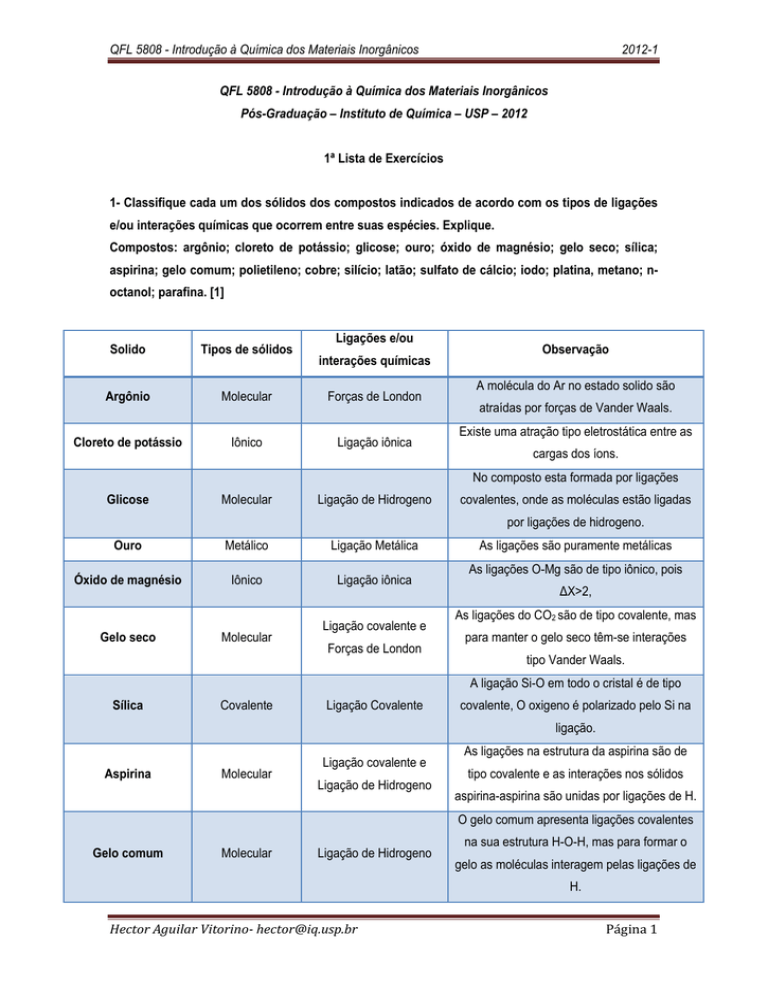
1- Classifique cada um dos sólidos dos compostos indicados de acordo com os tipos de ligações
e/ou interações químicas que ocorrem entre suas espécies. Explique.
Compostos: argônio; cloreto de potássio; glicose; ouro; óxido de magnésio; gelo seco; sílica;
aspirina; gelo comum; polietileno; cobre; silício; latão; sulfato de cálcio; iodo; platina, metano; noctanol; parafina. [1]
Ligações e/ou
Solido
Tipos de sólidos
Argônio
Molecular
Forças de London
Cloreto de potássio
Iônico
Ligação iônica
interações químicas
Observação
A molécula do Ar no estado solido são
atraídas por forças de Vander Waals.
Existe uma atração tipo eletrostática entre as
cargas dos íons.
No composto esta formada por ligações
Glicose
Molecular
Ligação de Hidrogeno
covalentes, onde as moléculas estão ligadas
por ligações de hidrogeno.
Ouro
Metálico
Ligação Metálica
Óxido de magnésio
Iônico
Ligação iônica
Gelo seco
Molecular
Ligação covalente e
Forças de London
As ligações são puramente metálicas
As ligações O-Mg são de tipo iônico, pois
ΔX>2,
As ligações do CO2 são de tipo covalente, mas
para manter o gelo seco têm-se interações
tipo Vander Waals.
A ligação Si-O em todo o cristal é de tipo
Sílica
Covalente
Ligação Covalente
covalente, O oxigeno é polarizado pelo Si na
ligação.
Aspirina
Molecular
Ligação covalente e
Ligação de Hidrogeno
As ligações na estrutura da aspirina são de
tipo covalente e as interações nos sólidos
aspirina-aspirina são unidas por ligações de H.
O gelo comum apresenta ligações covalentes
Gelo comum
Molecular
Ligação de Hidrogeno
na sua estrutura H-O-H, mas para formar o
gelo as moléculas interagem pelas ligações de
H.
Hector Aguilar Vitorino- [email protected]
Página 1
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
Polietileno
Cobre
Covalente e
Molecular
Metálico
Forças de London
Ligação Metálica
2012-1
O polietileno, interatuam entre eles por forcas
de tipo Vander Waals.
As ligações em toda a estrutura são
puramente metálicas.
As interações entre Si-Si (ΔX=0), na toda sua
Silício
Covalente
Ligação Covalente
estrutura apresentam ligações de tipo
covalente.
Latão
Metálico
Ligação Metálica
Na liga metálica, as interações entre Cu-Zn
são de tipo metálico.
A ligação entre o sulfato (anion, que tem
Sulfato de cálcio
Iônico
Ligação iônica
ligações covalentes) e o cálcio (cátion) tem
atração tipo eletrostática ou iônica.
Iodo
Molecular
Ligação covalente
Forças de London
O iodo apresenta ligações I-I no estado solido
e interações de tipo Vander Waals entre
moléculas.
A platina por ser metal, apresenta ligações de
Platina
Metálico
Ligação Metálica
tipo metálico na toda sua estrutura (mar de
elétrons)
O metano esta formado por ligações de tipo
Metano
Molecular
Ligações covalentes e
covalente, mas as interações entre moléculas
Forças de London
por ser apolares apresentam interações de
Vander Waals.
N-octanol
Parafina.
Molecular
Molecular
Ligações covalentes e
forcas de London
Ligações covalentes
Forças de London
O n-octanol apresenta forcas de dispersão,
interações dipolo-dipolo e ligações de
hidrogeno.
A parafina apresenta ligações covalentes, mas
entre as moléculas apresenta interações tipo
dispersão.
Tabela 1: tipos de sólidos, interações e ligações químicas que tem.
2- Um sal MX, cristalizado a partir de uma solução aquosa, forma cristais cúbicos que apresentam
arranjo cúbico de faces centradas. Entretanto, a partir de uma solução aquosa contendo pequena
quantidade de um composto orgânico, observou-se a formação de cristais octaédricos. Com base
apenas nestes dados, é possível afirmar que neste experimento obteve-se um polimorfo do
mesmo sal? Justifique. [2,3]
Hector Aguilar Vitorino- [email protected]
Página 2
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
Cabe ressaltar que podem existir mais de um hábito cristalino de um mesmo polimorfo, principalmente
quando se mudam as condições de cristalização. Assim como diferente habito cristalino para diferentes
polimorfos.
Figura1: Pode-se partir de um arranjo cúbico (mesmo polimorfo) e obter diferentes formas (habito cristalino) de
cristais.
Observar que a estrutura cristalina esta estreitamente relacionada com o polimorfismo e a morfologia do
solido esta relacionado com a morfologia.
Cabe resaltar que o polimorfismo tem-se a mesma composição, mas cristalizam com estruturas
diferentes. Diferem quanto ao arranjo espacial dos átomos e quanto às suas propriedades físicas e
químicas.
O polimorfismo depende de as condições de pressão e temperatura, uma variação de estes pode mudar
o arranjo da cela, mas o habito cristalino depende de condições de cristalização, como o cambio de
solventes (as misturas do mesmo).
Dos dados, partimos de um arranjo cúbico (um polimorfo) com um habito cristalino cúbico a partir de uma
solução aquosa e ao usar para a cristalização uma pequena quantidade de solvente orgânico, observamse cristais octaedricos (diferente habito cristalino), mas não comenta do arranjo final da estrutura do
cristal.
Porem as condições de cristalização não forem de pressão e temperatura, mais só de ´´solvente´´, podese tratar de um mesmo polimorfo, mas com diferente habito cristalino. Assim é possível afirmar que não
se obtêm outro polimorfo do mesmo sal, só um diferente habito cristalino da mesma sal.
3- O carbonato de cálcio, presente na natureza e em sistemas biológicos, é um composto
relevante na área de biomineralização. É encontrado nas formas de calcita, em que o íon Ca2+
apresenta número de coordenação 6, e aragonita, na qual o número de coordenação do cátion é
Hector Aguilar Vitorino- [email protected]
Página 3
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
igual a 9. Indique qual das estruturas abaixo deve corresponder a cada uma destas formas
cristalinas. Explique qual é a denominação que recebem as formas calcita e aragonita, no que diz
respeito às suas estruturas. Justifique as suas respostas.[5]
Grupo da calcita (CaCO3): A estrutura da calcita é derivada da estrutura da halita distorcida, com Ca2+
(NC= 6) no lugar de Na+ e CO32- no lugar de Cl-.). Cada O2- liga-se a 2 Ca2+ e um C. Devido ao formato
não esférico do arranjo, o radical CO32- distorce a cela unitária cúbica da halita em uma cela romboédrica
(sistema trigonal). (Ver Fig. 2)
Oxigênio – verde
Carbono – azul
Cálcio – vermelho
Figura 2: Estrutura da calcita: sistema hexagonal (romboédrico)
Grupo da aragonita (CaCO3): A estrutura da aragonita (polimorfo de alta pressão da calcita) baseia-se
num arranjo ortorrômbico, onde o Ca2+ está em coordenação 9 e o CO32- em coordenação trigonal planar,
como na calcita.
z
y
x
Figura 3: Estrutura da aragonita - CaCO3 :Na aragonita o NC do Ca2+ é 9. Os ânions (CO3)2- arranjam-se em
camadas perpendiculares ao eixo z, alternando a direção em cada camada, dando origem ao hábito
pseudohexagonal da aragonita, mas ela é classificada como ortorrômbica.
4- Considere as três formas alotrópicas do carbono: diamante, grafite, fulereno (C60). [10,11]
a) Desenhe as suas respectivas estruturas cristalinas;
Hector Aguilar Vitorino- [email protected]
Página 4
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
Diamante
Grafite
2012-1
Fulereno (C60).
Figura4: estruturas cristalinas do diamante,grafite e Fulereno.
Em relação aos compostos presente nas figuras pode-se mencionar:
a) As ligações presentes no Fulereno estão mais tencionadas devido à forma esférica.
b) Esses compostos são alótropos formados por átomos de carbono.
c) A grafita e o Fulereno apresentam elétrons π(pi) na estrutura.
d) A grafita possui uma estrutura organizada em camadas, o que explica a sua capacidade como
lubrificante.
b) Explique que tipos de ligação e geometria apresentam os átomos de carbono em cada uma
delas;
Diamante: A dureza do diamante resulta da sua estrutura cristalina covalente, na qual, cada átomo de
carbono está ligado covalentemente a quatro outros, situados nos vértices de um tetraedro. A ligação C –
C tem comprimento 1,54Å e ângulo de 109,5°. A característica que difere os diamantes de outras formas
alotrópicas, é o fato de cada átomo de carbono estar hibridizado em sp³, e encontrar-se ligado a outros 4
átomos de carbono por meio de ligações covalentes em um arranjo tridimensional tetraédrico.
Grafite: O grafite é composto por infinitas camadas de átomos de carbono hibridizados em sp². No
grafite, os átomos de carbono estão arranjados em camadas e cada átomo está circundado por outros
três, com os quais forma ligações simples ou duplas. As camadas, chamada de folha de grafeno, um
átomo de carbono se liga a 3 outros átomos, formando um arranjo planar de hexágonos fundidos,, são
mantidas juntas por forças de dispersão de London. O comprimento da ligação carbono – carbono nas
camadas é de 1,42Å e a distância entre as camadas ou folhas de grafeno é de 3,4Å.
Fulereno (C60): são moléculas estruturadas na forma de “gaiolas”, ou seja, elas têm a forma fechada em
si. Os fulerenos são constituídos por uma rede formada por pentágonos e hexágonos, fechando assim a
“esfera”. Cada carbono de um fulereno está hibridizado em sp² e forma ligações sigma (ligação simples)
com três outros átomos de carbono, restando um elétron de cada carbono, que fica deslocalizado num
sistema de orbitais moleculares que atribui à molécula o caráter aromático.
Hector Aguilar Vitorino- [email protected]
Página 5
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
c) Classifique os respectivos sólidos cristalinos com relação à natureza das interações químicas e
justifique;
O diamante e fulereno (C60), são sólidos cristalinos que apresentam ligações de tipo covalente, alem das
suas diferentes estruturas, porem são denominados sólidos covalentes.
O grafite, é um solido cristalino que apresenta numa camada ( grafeno) ligações tipo covalente e as
interações que manter unidos a estas são de tipo dispersão de London, porem é denominado um solido
cristalino tipo covalente e molecular.
Ligação tipo covalente sp2
Interação tipo forças de
London
Figura5: Interações que apresenta o grafite.
d) Como se podem explicar as seguintes diferenças nas propriedades físicas desses alótropos:
diamante é duro (usado como ferramenta de corte) e grafite é mole (usado como lubrificante); o
diamante e a grafite apresentam pontos de fusão acima de 3000 oC enquanto o fulereno (C60) se
funde à temperatura abaixo de 300oC; o fulereno é solúvel em solventes orgânicos ao contrário
dos outros dois alótropos.
O grafite é composto de extensas camadas de átomos de carbono, que formam folhas com anéis unidos
mais ou menos como uma tela. Essas "telas" de carbono deslizam facilmente umas sobre as outras, e ao
escrever com um lápis de grafite o rastro deixado é feito dessas camadas, que vão se espalhando
quando o lápis é atritado com o papel. Essa mesma propriedade "deslizante" do grafite permite que ele
seja usado como lubrificante, especialmente em altas temperaturas - já que o material resiste a mais de
3000 oC antes de começar a fundir. Pelo mesmo motivo e também por conduzir eletricidade com razoável
facilidade, o grafite pode ser usado como eletrodo para fornos elétricos, onde conduz corrente elétrica
suficiente para fundir metais.
A estrutura cristalina do diamante é completamente diferente. Cada átomo de carbono possui quatro
átomos vizinhos, aos quais está fortemente ligado, formando o conjunto uma estrutura tridimensional
extremamente dura e resistente. Porem apresenta alto ponto de fusão.
Hector Aguilar Vitorino- [email protected]
Página 6
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
A estrutura dos fulerenos é formada pela ligação das bordas de uma folha de grafeno. Desse modo, os
carbonos continuam unidos por fortes ligações sp2, como no grafeno, entretanto a curvatura trigonal das
ligações leva a formação de uma estrutura pseudo sp³. Existem literacoes dipolo-dipolo e ligacoes pi
entre as moleculas de fulereno.
São solúveis em solventes orgânicos; devido a curvatura, os anéis benzeno do C60 estão sobtensão, e
seu conteúdo energético em relação a grafite e 10,16 kcal.g-1 por átomo de carbono. Os elétrons
remanescentes de cada carbono esta deslocalizado em um sistema de orbitais moleculares que fornece o
caráter AROMATICO global da molécula.
5- O SiO2 pode ser observado como material monocristalino (quartzo), policristalino (rochas) ou
amorfo (vidro). Pergunta-se; a) Em que diferem os sólidos policristalinos, monocristalinos e
amorfos? b) Faça um desenho esquemático genérico mostrando as diferenças, ao nível de
cristalização, entre os três; c) O que são fronteiras de grãos? [4,6,7,8]
Os materiais sólidos podem ser classificados de acordo com a regularidade na qual seus átomos,
moléculas ou íons se dispõem em relação aos seus vizinhos. Na estrutura monocristalina, todos os
átomos ocupam posições regulares no espaço, que se repetem indefinidamente, Formando uma estrutura
que pode ser obtida pela repetição tridimensional de um padrão chamado de célula unitária. Quando os
átomos ocupam posições regulares sem se repetirem indefinidamente, mas apenas em pequenas regiões
temos uma estrutura policristalina. Aumentando o grau de desordem ao extremo temos o que é chamado
de material amorfo. Neste caso, não há regularidade nenhuma nas posições ocupadas pelos átomos.
Assim, podemos classificar os sólidos em materiais monocristalinos, policristalinos e amorfos.
Figura 6: diferentes crescimentos de cristal, monocristalino, policristalino e amorfo.
Quando materiais apresentam arranjos periódicos e repetidos de átomos são ditos cristalinos, caso
contrário, são denominados de não cristalinos ou amorfos. Material policristalino: Quando materiais
Hector Aguilar Vitorino- [email protected]
Página 7
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
apresentam arranjos periódicos e repetidos de átomos oriundos de diversos núcleos de solidificação que
se encontraram de forma aleatória durante o processo.
Figura7: contorno de grão no de um cristal.
Os contornos de grão são regiões separando cristais de diferentes orientações em um material
policristalino.
6- O gelo é menos denso do que a água líquida, em contraste com a maioria dos sólidos que são
mais densos do que as suas correspondentes substâncias líquidas. Explique: [19,20]
a) Por que a molécula de água não apresenta estrutura linear (H-O-H)
A molécula de água é constituída por dois átomos de hidrogênio ligados a um de oxigênio, com uma
estrutura tetraédrica. O átomo de oxigênio partilha dois dos seus seis elétrons de valência com os átomos
de hidrogênio para formar as ligações covalentes entre oxigênio e hidrogênio. Como resultado, o
hidrogênio tem a sua camada de valência completa e dedicada à ligação. O átomo de oxigênio possui
dois pares de elétrons de valência que não participam então em ligações, mas que produzem uma zona
de carga negativa que tende a repelir ligeiramente os átomos de hidrogênio. Por esta razão, a molécula
de água não é linear, formando antes um ângulo com aproximadamente 104,5º.
Figura8: geometria da água.
Hector Aguilar Vitorino- [email protected]
Página 8
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
Se a água tivesse estrutura linear H – O – H, o dipolo parcial devido a uma ligação H – O anularia o outro
da segunda ligação O – H, e então o dipolo total seria nulo, mais a molécula da água é polar.
b) Como estas moléculas interagem entre si no estado sólido
Em estado liquido a forma angular é responsável pela formação de ligações de hidrogeno entre uma
molécula da água com as outras que estão ao seu redor. Além disso, outro fator que ocasiona as ligações
de hidrogeno é que a molécula de água é polar, Isto é, há uma diferença de eletronegatividade entre o
oxigeno que constitui o polo negativo e os hidrogênios polos positivos.
Figura 9: Interação que apresenta a água no estado liquida.
De fato, os sólidos são geralmente mais densos do que os líquidos dos quais provêm. Porque quanto
mais baixas são as temperaturas, menor é a agitação térmica das moléculas, mais fortes e duradouras
são as ligações entre elas e mais próximas ficam. Daí que existam mais moléculas por unidade de
volume e, portanto, maior será a densidade. Assim, a parte sólida em contacto com o líquido vai ao fundo.
O gelo tem uma estrutura cristalina regular em que foram feitas todas as ligações de hidrogênios
possíveis. No gelo cada molécula de água está rodeada por quatro moléculas de água ligadas por
ligações de hidrogênio formando uma estrutura hexagonal. Esta estrutura aberta permite a sua expansão
em vez da condensação.
Hector Aguilar Vitorino- [email protected]
Página 9
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
Figura10: Interação que apresenta a água no estado solido (gelo).
c) Como se explica, em termos estruturais, que a água sólida é menos densa do que a água
líquida?
Com a água acontecem coisas mesmo “esquisitas”: à medida que a sua temperatura baixa até aos 4 oC ,
aumenta, de fato, a sua densidade, mas se continuar a baixar, a densidade baixa de novo. Assim os 4 oC
são a temperatura a que a água é mais densa. Acima ou abaixo dela a densidade é inferior.
No gelo, a água está numa estrutura altamente regular de malha hexagonal, deixando um espaço livre no
centro de cada hexágono (por isso o gelo flutua sobre a água líquida). Com a fusão, a água passa a uma
malha quadrangular com um espaço central menor, o que explica o motivo porque a água líquida ocupa
menos espaço que o gelo. Esta situação é invulgar, pois na fusão há um aumento da energia das
moléculas e a maior parte dos líquidos tem as suas moléculas mais afastadas que os sólidos.
7- Os metais podem formar soluções sólidas (ligas) substitucionais ou intersticiais. Quais dos
pares de metais: (a) Na e K; (b) K e Rb; (c) Cu e Au; (d) Cu e Zn poderiam formar ligas
substitucionais? Justifique.[12]
Metais
Rádios atômicos
Diferença entre os
(Å)
raios atômicos
Na
1,91
K
2,35
K
2,35
Rb
2,48
Cu
1,28
Au
1,44
Cu
1,28
Zn
1,38
23% (> 15%)
13%
12.5%
7.8%
EN
Estrutura
Tipo de liga
cristalina
0,93
CCC
Não formam solução solida (não
0,82
CCC
forma liga substitucional)
0,82
CCC
0,82
CCC
1,90
CCC
2,54
CCC
1,90
CCC*
Solução solida intersticial (Latão)
1,65
Hexagonal*
*não tem o mesmo arranjo cristalino.
Solução solida substitucionais
Solução solida substitucionais
Tabela 2: Determinação de tipo do solido: substitucional e intersticial.
Hector Aguilar Vitorino- [email protected]
Página 10
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
8- Para cada sólido indicado, complete as colunas da tabela abaixo:[9,15]
Geometria ao
Geometria ao
No de cátions/ célula
No de ânions/
redor do cátion
redor do anion
unitária
célula unitária
Sólido
NC cátion
NC do ânion
CsCl
8
8
Cúbico
Cúbico
1
(1/8)x8=1
NaCl
6
6
Octaedrica
Octaedrica
1 + 12(1/4) = 4
8(1/8) + 6(1/2) = 4
CaF2
8
4
Cúbico
Tetraédrica
1x8=8
(1/2)x6=3
ZnS (b)
4
4
Tetraédrica
Tetraédrica
1x4=4
(1/8)x8 + (1/2)x6=4
ZnS (w)
4
4
Tetraédrica
Tetraédrica
4
4
Tabela 3: Determinação de NC, geometria ao redor dos íons e numero do íon na célula unitária.
9- Determine quantas fórmulas mínimas existem por célula unitária do ZnS para os polimorfos: (a)
blenda; (b) wurtzita. Justifique. [15]
Figura11: Estrutura da blenda (acima) e Estrutura da wurtzita (embaixo)
Da tabela 3 do problema 8 tem-se as relações de NC para a Blenda e Wurtzita respeito ao cátion Zn e
anion S, então pode-se determinar as relações das formulas mínimas de estas:
Como tem-se uma relação de 8:8 para a Blenda e Wurtzita, onde as relações mínimas são 1:1, e as
formulas mínimas são ZnS.
Hector Aguilar Vitorino- [email protected]
Página 11
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
10- Considere a célula unitária para um arranjo cúbico simples: a) desenhe este arranjo; b)
descreva as posições ocupadas e as posições vazias; c) calcule as porcentagens de volume
ocupado e vazio. [13,16]
(a)
(b)
(c)
Figura 12. Representação de uma célula unitária CS: (a) posições dos átomos; (b) arranjo atômico; (c) átomos no
interior da célula unitária.
Nesse arranjo atômico, existe apenas um átomo em cada vértice do cubo. Na estrutura CS, o parâmetro
de rede, definido por a, corresponde ao tamanho da aresta desse cubo, ou seja, a=2r, onde r é o raio
atômico. A figura 12 mostra a representação esquemática de tal célula cristalina.
Para o calculo da porcentagem do volume ocupado e por átomos em uma estrutura cristalina,
determinamos o fator de empacotamento (F.E.), que é dado por:
Onde:
N = Número de átomos que efetivamente ocupam a célula;
VA = Volume do átomo (4/3.π.r3);
r = Raio do átomo;
VC = Volume da célula unitária.
O número de átomos que estão efetivamente em uma célula cúbica simples é resultado da soma dos
átomos presentes em seus vértices.
Número de vértices = 8
Número de átomos por vértice = 1/8
Número total de átomos = 8. 1/8 = 1
Volume ocupado por átomos (VA) = 1. Volume de 1 átomo = 4/3.π.r3
Volume da célula unitária,
VC = a = (2r)3 = 8r3
Fator de Empacotamento
Hector Aguilar Vitorino- [email protected]
Página 12
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
Ou seja, apenas 52% desta célula unitária são preenchidos por átomos. Devido ao baixo índice de
ocupação desta célula, os metais não apresentam este tipo de arranjo. Uma única exceção é o polônio
(Po).
11- O alumínio metálico apresenta diversas aplicações importantes em razão de sua baixa
densidade (2,7 g cm-3). Determine a dimensão de sua célula unitária (em pm) sabendo que o metal
cristaliza num arranjo cúbico de faces centradas. [13,14,16]
O arranjo cúbico de face centrada caracteriza-se por exibir os mesmos átomos nos vértices, nos
encontrados outros dois arranjos cúbicos anteriores, e mais um átomo em cada face do cubo. A estrutura
cúbica de face centrada é a estrutura do alumínio, cálcio, chumbo, níquel, cobre, platina, prata, ouro, etc.
A figura 13 apresenta um diagrama esquemático desta estrutura. O parâmetro de rede no caso da
estrutura CFC pode ser obtido através da diagonal da face, que tem o tamanho de quatro átomos.
Usando novamente as relações de um triângulo retângulo, é possível relacionar o parâmetro de rede com
o raio atômico, ou seja:
a2+ a2 =( 4r) 2
4r
a
(a)
(b)
(c)
Figura 13. Representação esquemática de uma célula unitária CFC: (a) posições atômicas; (b) arranjo
atômico; (c) átomos dentro da célula unitária.
O número de átomos que estão efetivamente em uma célula cúbica de face centrada é resultado da soma
dos átomos presentes em seus vértices, mais aqueles localizados em suas faces.
Número de vértices = 8
Número de átomos por vértice = 1/8
Número de faces = 6
Hector Aguilar Vitorino- [email protected]
Página 13
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
Número de átomos por face = 1/2
Número total de átomos = 8.1/8 + 6.1/2 = 4
Volume ocupado por átomos (VA) = 4xVolume de 1 átomo = 16/3.π.r3
Volume da célula unitária,
Da densidade tem-se:
12- Um metal M cristaliza num arranjo cúbico de corpo centrado. Responda que metal é este,
sabendo que a dimensão de sua célula unitária é 286,6 pm e sua densidade é igual a 7.874 kg m-3.
[13,14,16]
O número de átomos que estão efetivamente em uma célula cúbica de corpo centrado é resultado da
soma dos átomos presentes em seus vértices, mais aquele localizado em seu centro.
Número de vértices = 8
Número de átomos por vértice = 1/8
Número total de átomos = 8.1/8 + 1 = 2
Volume ocupado por átomos (VA) = 2xVolume de 1 átomo = 8/3.π.r3
Volume da célula unitária,
Hector Aguilar Vitorino- [email protected]
Página 14
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
(Fe)
Da massa atômica do ferro é próxima a 55,847, então se pode deduzir que o metal M é o Ferro.
r
a
(a)
(b)
(c)
Figura 14. Representação de uma célula unitária CCC: (a) posições dos átomos; (b) arranjo atômico; (c)
átomos no interior da célula unitária.
13- Um cristal de fulereno apresenta arranjo cúbico de faces centradas e densidade 1,6 g cm-3.
Calcule o raio, em ângstrons, de uma buckyball (molécula C60). [13,14,16]
Da figura do problema 11, se tem:
r
Número de vértices = 8
Número de moléculas de fulereno por vértice = 1/8
Número de faces = 6
Número de fulereno por face = 1/2
Número total de fulerenos = (8.1/8 + 6.1/2)x60 = 4x60
14- Qual é a fórmula de um composto que possui íons cloreto num arranjo cúbico de faces
centradas e íons M em 1/2 dos interstícios tetraédricos? [12,17,18]
Hector Aguilar Vitorino- [email protected]
Página 15
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
Fig15. Intersticio tetraédrico. En el caso de que cuatro átomos iguales se coloquen en contacto, de modo
que sus centros formen un tetraedro, el espacio vacío que dejan los átomos en el centro se conoce con el
nombre de intersticio tetraédrico.[18]
Figura 16. Representação de uma célula unitária CCF, que tem os cátions (metálicos) nos interstícios tetraédricos,
sal com formula M8Cl4. [program ChemDraw Ultra 10.0]
Figura 17. Relação de rádios iônicos para a denominação do interstício tetraédrico.[12]
Da figura 18 pode-se determinar a formula que possui íons cloreto num arranjo cúbico de faces centradas
e íons M em 1/2 dos interstícios tetraédricos.
Da célula unitária tem-se:
Numero de anions (Cl-) = 4
Numero de cátions (M+)=8
Hector Aguilar Vitorino- [email protected]
Página 16
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
Mas os cátions só ocupam a metade dos interstícios, então o numero de cátions na célula e 4.
Então a formula do cloreto de metal é: M4Cl4 formula mais simples:MCl
Anion (r-)
Cátion (r+)
Figura 18. Representação de uma célula unitária CCF, que tem os cátions (metálicos) nos interstícios tetraédricos,
sal com formula M4Cl4. [program ChemDraw Ultra 10.0]
Da figura 18, pode-se determinar a relação dos raios iônicos para comprovar o tipo de interstício que apresenta.
Fazendo os cálculos, obtem-se:
Hector Aguilar Vitorino- [email protected]
, com numero de coordenação 4 , tetraédrico.
Página 17
QFL 5808 - Introdução à Química dos Materiais Inorgânicos
2012-1
REFERENCIAS BIBLIOGRÁFICAS
1. T.L. Brown, H.E. LeMay Jr., B.E. Bursten e J.R. Burdge, Química – a ciência central, PearsonPrentice Hall, São Paulo, 9ª. ed., 2005.
2. Denise de Oliveira Silva, Material didactico 2012-I (arquivo: QFL5808_2_EstrSólidosA_2012)
3. http://www.ebah.com.br/content/ABAAAAPt4AI/monografia-polimorfismo (acessada em abril 2012)
4. http://www.fisica.ufc.br/lapolc/lapolc2007/index-br.html (acessada em abril 2012)
5. http://www.fluidforce.com.mx/calcita_vs_aragonito.html(acessada em abril 2012)
6. Klein Jr., C.; Hurlbut, S., 1993, Manual of Mineralogy. 21st ed., John Wiley & Sons.
7.
http://www.esc.cam.ac.uk/IA_Mat&Min.html – texto excelente de Simon Redfern do Department of
Earth Science, University of Cambrige (UK). (acessada em abril 2012)
8.
http://Mineral.gly.bris.ac.uk/Mineralogy – Curso de Mineralogia de David M. Sherman, Dept. of Earth
Sciences, University of Bristol, Bristol, UK. (acessada em abril 2012)
9.
http://www2.uah.es/edejesus/resumenes/IQI/tema_4.pdf(acessada em abril 2012)
10. http://es.wikipedia.org/wiki/Fullereno(acessada em abril 2012)
11. http://www.cdlmadrid.org/cdl/archivospdf/ciencias/estructuras-carbono.pdf(acessada em abril 2012)
12. Denise de Oliveira Silva ,Material didactico, 2012-I ( Arquivo QFL5808_2_EstrSólidosB_2012 )
13. http://www.joinville.udesc.br/portal/professores/daniela/materiais/Aula_3___Estrutura_Cristalina.pdf(a
cessada em abril 2012)
14. Raymond Chang, Química General, 11va edición, 2009, 345-360.
15. Lesley Smart, Elaine Moore, Solid State Chemestry and Introduction, 3ª edição, 2005, pag 40-43.
16. http://www.trajanocamargo.com.br/arquivos/metalurgia/Estrutura_Cristalina_materialdeapoio2.pdf
(acessada em abril 2012)
17. http://marcoscassi.dominiotemporario.com/eng/index.php/painel/ciencia-dos-materiais/797-estruturas-
cristalinas-reticulado-cristalino.html (acessada em abril 2012)
18. http://www.esi2.us.es/IMM2/ec/intersticios.html (acessada em abril 2012)
19. http://ministerioteescucha.blogspot.com.br/2010/12/fenomenologia-de-la-constancia-de-la.html (acessada em
abril 2012)
20. http://ambienteysociedadenvicentelopez.blogspot.com.br/(acessada em abril 2012)
Hector Aguilar Vitorino- [email protected]
Página 18












