DETECÇÃO MOLECULAR DE Dengue vírus E OUTRAS ARBOVIROSES
CIRCULANTES, EM PACIENTES SINTOMÁTICOS, NO ESTADO DO PIAUÍ.
Felipe Daniel Cardoso (bolsista do PIBIC/CNPq); Gustavo Portela Ferreira (Orientador,
Departamento de Biomedicina – UFPI)
INTRODUÇÃO
É estimado que a dengue acometa aproximadamente 390 milhões de indivíduos anualmente (BHATT
et al., 2013) resultando em uma variedade de manifestações clínicas que são inicialmente comuns à
outras arboviroses como CHIKV e ZIKV. Entretanto a evolução clínica tende a ser diferente, podendo
o DENV levar o paciente a óbito por choque hipovolêmico, o CHIKV causar artrite debilitante e crônica
e para o ZIKV é sugerido causar malformação congênita em neonatos. Por serem transmitidos pelo
mesmo vetor, estas arboviroses podem circular concomitantemente e portanto um diagnóstico
diferencial na fase inicial da doença é fundamental para um melhor prognóstico.
Testes sorológicos são comumente utilizados em rotinas laboratoriais, entretanto são susceptíveis à
resultados cruzados e eficazes principalmente na fase tardia da doença, o que pode levar um mal
prognóstico ao paciente. Técnicas de diagnóstico na fase aguda da doença são necessários, sendo os
métodos moleculares os mais sensíveis e específicos. Além da detecção precoce do agente viral, esta
técnica pode gerar informações quanto à história natural do vírus e também é fundamental para
acompanhamento da emergência/reemergência de novos vírus na comunidade.
METODOLOGIA
Amostras de pacientes vivenciando sintomas como febre, artralgia, exantema e cefaleia associado à
diagnóstico positivo para captura de antígeno dengue NS1 ou anticorpos IgM/IgG foram selecionadas
para extração e purificação de RNA viral utilizando o kit comercial QIAGEN® QIAamp Viral RNA Mini
Kit. O RNA purificado foi então convertido em cDNA através da técnica de transcrição reversa utilizando
Random Hexamers. O cDNA foi submetido à diferentes variações da técnica de PCR para amplificação
e avaliação da presença de genoma viral. Essas técnicas diferenciam essencialmente na parte do
genoma que amplificam e foram utilizados iniciadores de referência na literatura científica, como os
descritos por Chao et al (2007) para detecção de vírus do gênero Flavivirus, os descritos por Lanciotti
et al (1992), Rocha et al (2012) e Figueiredo et al (2014) para detecção e tipagem do DENV. Também
foram selecionadas amostras negativas para DENV em testes sorológicos, mas que apresentaram
sintomatologia clássica para arboviroses, para detecção de anticorpos IgM específicos para CHIKV
utilizando-se o kit OnSite Chikungunya IgM Combo Rapid Test (CTK Biotech, Estados Unidos) de
acordo com as recomendações do fabricante
RESULTADOS E DISCUSSÃO
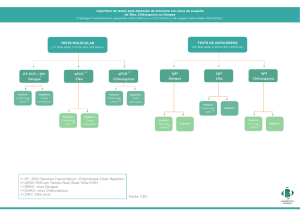
O RNA viral de 50 amostras foi extraído e testadas em todas as reações moleculares descritas,
entretanto as amostras 30, 65, 66 e 279 foram positivas em pelo menos uma das metodologias
descritas. A amostra 30 foi positiva para Flavivirus e embora tenha sido positiva para DENV através da
captura de NS1 esta amostra não foi positiva para DENV por PCR e captura de anticorpos IgG/IgM.
Apesar da especificidade da captura de NS1, resultados falsos positivos já foram descritos em
infecções por ZIKV e CHIKV (BLACKSELL et al., 2011; GYURECH et al., 2016) e mais testes são
necessários para confirmação do agente etiológico. A amostra 65 foi positiva para DENV2 através da
reação descrita por Lanciotti et al (1992) o que corrobora com os resultados sorológicos positivos para
IgM/IgG e captura de NS1. Este paciente desenvolveu quadros de paralisia associados à infecção por
DENV2. Complicações neurológicas como encefalite, meningite, paralisia e síndrome de Guillain-Barré
decorrentes de infecções por DENV são raras, mas há casos descritos na literatura científica
(OLIVEIRA et al., 2016; LY et al., 2015;). A amostra 66 foi positiva através da amplificação do gene E
para DENV1, corroborando com sorologia positiva para DENV, através da captura de IgM e antígeno
NS1. A amostra 279 foi positiva para Flavivirus e DENV1 em testes moleculares, e embora as amostras
66 e 279 apresentem a mesma faixa etária, nesta amostra houveram sintomas mais severos com
manifestações hemorrágicas possivelmente por ser uma infecção secundária, enquanto os resultados
da amostra 66 sugerem infecção primária. Em testes sorológicos, a amostra 66 foi positiva para captura
de anticorpos IgM e antígeno NS1 para DENV, sugerindo infecção primária, enquanto não há resultado
de captura de anticorpos na amostra 279 o que não descarta infecção secundária. Conforme dados da
literatura, exposições subsequentes à um diferente sorotipo de DENV poderiam agravar o quadro
clínico do paciente (HALSTEAD, 2015) pois anticorpos específicos para um sorotipo facilitariam a
entrada de partículas virais de um sorotipo diferente nas células fagocíticas.
Foram selecionadas 57 amostras para avaliação de infecção recente por o CHIKV, destas as amostras
10, 14 e 118 foram positivas para captura de IgM. Enquanto não há dados clínicos quanto a amostra
10, a amostra 14 apresentou sintomas clássicos desta arbovirose, negativando tanto em testes
sorológicos quanto em moleculares para o DENV. A amostra 118 foi positiva para CHIKV na captura
de IgM e negativa em testes sorológicos para DENV. Este paciente apresentou encefalite, uma
manifestação clínica associada à CHIKV incomum, mas já descrita em outros países (CROSBY et al.,
2016; ZAMBRANO et al., 2016) e que no Brasil a única associação com distúrbio neurológico foi
publicada recentemente em um recém-nascido com encefalite (BANDEIRA et al., 2016). Ainda é
necessário confirmação molecular da infecção que proporcionará mais informações quanto à linhagem
viral, assim como correlacionar com a evolução clínica do paciente.
CONCLUSÃO
Os resultados moleculares encontrados confirmam a circulação dos sorotipos 1 e 2 do DENV no estado,
assim como sugere a circulação de outro flavivírus. Através dos resultados sorológicos, também é
possível sugerir a circulação concomitante de CHIKV. Como observado, dois dos pacientes
apresentaram alterações neurológicas associadas à infecção por DENV e, possivelmente CHIKV,
embora seja necessário realizar testes moleculares confirmatórios para o agente causal CHIKV, os
dados mostram a necessidade do estudo da prevalência dessas arboviroses como causadoras de
alterações neurológicas.
APOIO
Universidade Federal do Piauí, Prefeitura Municipal de Parnaíba edital Mac-Doubles 001/2014, FAPEPI
e CNPq.
Palavras-chave: Arbovírus. PCR. Chikungunya.
REFERÊNCIAS BIBLIOGRÁFICAS
BANDEIRA, A. C. et al. Neonatal encephalitis due to Chikungunya vertical transmission: First report in
Brazil. IDCases, v. 5, p. 57–59, 2016
BHATT, S. et al. The global distribution and burden of dengue. Nature, v. 496, n. 7446, p. 504–507,
2013.
BLACKSELL, S. D. et al. Evaluation of Six Commercial Point-of-Care Tests for Diagnosis of Acute
Dengue Infections : the Need for Combining NS1 Antigen and IgM / IgG Antibody Detection To Achieve
Acceptable Levels of Accuracy. Clinical and Vaccine Immunology, v. 18, n. 12, p. 2095–2101, 2011.
CHAO, D. Y.; DAVIS, B. S.; CHANG, G. J. J. Development of multiplex real-time reverse transcriptase
PCR assays for detecting eight medically important flaviviruses in mosquitoes. Journal of Clinical
Microbiology, v. 45, n. 2, p. 584–589, 2007.
CROSBY, L. et al. Severe manifestations of Chikungunya virus in critically ill patients during the 20132014 Caribbean outbreak. International Journal of Infectious Diseases, v. 48, p. 78–80, 2016.
FIGUEIREDO, L. B. et al. Dengue virus 2 American-Asian genotype identified during the 2006/2007
outbreak in Piauí, Brazil reveals a Caribbean route of introduction and dissemination of dengue virus in
Brazil. PLoS ONE, v. 9, n. 8, p. 1–11, 2014.
GYURECH, D. et al. False positive dengue NS1 antigen test in a traveller with an acute Zika virus
infection imported into Switzerland. Swiss Medical Weekly, n. 146, p. w14296, 2016.
HALSTEAD, S. B. Pathogenesis of Dengue: Dawn of a New Era. F1000Research, v. 4(F1000 Faculty
Rev):1353, 2015.
LANCIOTTI, R. S. et al. Rapid detection and typing of dengue viruses from clinical samples by using
reverse transcriptase-polymerase chain reaction. Journal of Clinical Microbiology, v. 30, n. 3, p. 545–
551, 1992.
LY, M. H. P. et al. Isolation of dengue serotype 3 virus from the cerebrospinal fluid of an encephalitis
patient in Hai Phong, Vietnam in 2013. Journal of Clinical Virology, v. 70, p. 93–96, 2015.
OLIVEIRA, D. B. et al. Case Report Infection of the central nervous system with dengue virus 3 genotype
I causing neurological manifestations in Brazil. Revista da Sociedade Brasileira de Medicina
Tropical, v. 49, p. 125–129, 2016.
ROCHA, E. S. O. et al. Recombinant envelope protein-based enzyme immunoassay for IgG antibodies
is comparable to neutralization tests for epidemiological studies of dengue infection. Journal of
Virological Methods, v. 187, n. 1, p. 114–120, 2013.
ZAMBRANO, H. et al. Zika Virus and Chikungunya Virus CoInfections: A Series of Three Cases from a
Single Center in Ecuador. The American Journal of Tropical Medicine and Hygiene, 2016.