Olimpíada Pernambucana de Química
Etapa Final da Olimpíada Pernambucana de Química – Modalidade III
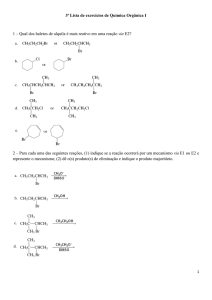
01. A baquelite é um polímero de condensação, formado pela reação de fenol com formaldeído, ocorrendo
“eliminação” de uma substância composta, sendo bastante utilizada em utensílios domésticos e materiais
elétricos.
O produto de eliminação para formação da baquelite, indicado na equação acima, é:
a) o etanol.
c) a água.
e) o próprio
b) o gás carbônico.
d) o próprio fenol.
(
(
(
(
(
) Combustível
) Detergente
) Tecidos
) Pesticidas
) Aromatizante
d) IV, I, III, V, II
e) II, V, I, IV, III
03. O flúor-18 é um radioisótopo produzido num acelerador cíclotron, com meia-vida de menos de duas
horas. Associado ao Fluordesoxiglucose, ou FDG, o radioelemento revela, pela emissão de pósitrons, as áreas
do organismo com metabolismo intenso de glicose, como o cérebro, o coração e os tumores, ainda que em
estágio muito inicial. Quando um átomo de flúor-18 emite um pósitron, o átomo resultante será um isótopo
do elemento químico:
a) cloro.
b) flúor.
c) neônio.
d) oxigênio.
e) nitrogênio.
04. O óxido nítrico é muito utilizado na fabricação de suplementos alimentares devido ser um radical livre,
gasoso. Este ao reagir com hidrogênio gasoso, produz nitrogênio e vapor de água de acordo com a reação
abaixo:
2 NO (g) + 2 H2 (g) ↔ N2 (g) + 2 H2O (g)
Acredita-se que essa reação ocorra em duas etapas:
2 NO + H2 ↔ N2O + H2O (lenta)
N2O + H2 ↔ N2 + H2O (rápida)
De acordo com esse mecanismo, a expressão da velocidade da reação é:
a) v = k [NO]2[H2].
c) v = k [NO][H2].
e) v = k [N2][H2O]2
b) v = k [NO2][H2O].
d) v = k [N2][H2O].
05. Duas amostras de um mesmo gás foram submetidos a um dado teste, à temperatura constante:
Neste estudo, os dados obtidos para a pressão e volume das amostras, comprovam a lei determinada por:
a) Boyle
b) Gay-Lussac
c) Avogadro
d) Proust
e) Lavoisier
Olimpíada Pernambucana de Química – Modalidade III
02. Associe cada classe de composto orgânico à sua aplicação.
I) Octano
II) Butanoato de sódio
III) Poliéster
IV) Deltametrina
V) Butanoato de etila
Os números na segunda coluna, lidos de cima para baixo, são:
a) I, II, III, IV, V
b) V, I, III, IV, II
c) III, I, II, V, IV
formaldeído.
06. Pode-se classificar uma solução aquosa de ácido sulfúrico 1,0 molar como sendo boa condutora de
corrente elétrica. Porém, ao se adicionar gradativamente a esta solução, uma solução aquosa de hidróxido de
bário, Ba(OH)2, a condutividade elétrica vai diminuindo, tornando-se praticamente zero quando todo ácido é
neutralizado pela base adicionada. Sobre o descrito, é correto afirmar que:
a) a reação entre o ácido e a base leva a um sal solúvel em água;
b) a condutividade diminui porque a base usada é muito fraca e não tende a se dissociar em água;
c) o sal insolúvel formado é o sulfeto de bário;
d) a condutividade diminui porque não há íons livres na solução, o que indica que o sal formado é
pouco solúvel em água;
e) a reação que ocorre entre o ácido e a base é um exemplo de reação de neutralização parcial.
08. Sobre a naftalina, analise as afirmações abaixo e indique verdadeiro ou falso:
( ) Em condições ambientes, passa rapidamente do estado sólido para o gasoso.
( ) Sublimação é um fenômeno químico.
( ) As forças atrativas entre as moléculas de naftalina devem ser fracas.
( ) A mudança de estado físico que acontece na naftalina é chamada de evaporação.
( ) Naftalina não pode ser obtida na forma líquida.
09. Numa certa embalagem de açúcar lê-se: “não contém produtos químicos”. Indique falso ou verdadeiro:
( ) a afirmação indica a ausência de agrotóxico.
( ) deve indicar que o açúcar não é transgênico.
( ) o açúcar deve conter mais de 3 elementos químicos.
( ) a afirmação é incoerente, pois deve conter pelo menos a água, um produto químico presente em todos os
alimentos.
( ) leite materno é o único alimento que não contém produtos químicos.
10. Assinale V ou F
( ) Metais alcalinos não possuem afinidade eletrônica, já que todos tendem a doar elétrons.
( ) A eletronegatividade mede a tendência de um átomo em atrair elétron.
( ) O elemento mais eletronegativo da tabela periódica é o flúor.
( ) O elemento que possui menor eletronegatividade é o frâncio.
( ) Quanto menor o átomo tanto maior será sua eletronegatividade.
11. Indique falso ou verdadeiro. São características de ácidos:
( ) reagem com metais, como magnésio e zinco, formando o gás hidrogênio.
( ) quando misturado a bases perdem suas propriedades.
( ) suas soluções tem presença de íons livres, portanto, conduzem energia elétrica
( ) são escorregadios em contato com a pele.
( ) quando puro pode ser encontrado em estados sólido ou líquido.
Olimpíada Pernambucana de Química – Modalidade III
07. Sabendo que cada metal se encontra em presença de uma solução 1,0 Molar do seu sulfato e que o
magnésio cede elétrons mais facilmente que o cromo, esquematize a seguinte pilha: Mg0, Mg2+/Cr3+, Cr0.
Assinale V ou F:
( ) A reação iônica global que representa a pilha é 2 Cr3+ + 3 Mg0 ↔ 3 Mg2+ + 2 Cr0.
( ) A semi-reação de oxidação é 2 Cr3+ + 6e− ↔ Cr0.
( ) Os elétrons fluem pelo fio que liga os dois eletrodos, no sentido da placa de magnésio para a placa de
cromo.
( ) Após um certo tempo de funcionamento da pilha, o eletrodo de magnésio será parcialmente consumido.
( ) Após um certo tempo de funcionamento da pilha, a solução de Cr2(SO4)3 terá aumentada sua
concentração em íons Cr3+.
12. Uma garrafa de vidro cheia de água, fechada, após algum tempo no congelador, se quebrou. Indique
falso ou verdadeiro:
( ) ao congelar, as moléculas de água cessam seus movimentos rotacionais, translacionais e vibracionais.
( ) a água líquida se transformou em gelo, aumentando sua densidade, provocando a quebra da garrafa.
( ) a garrafa se que quebrou porque o vidro é amorfo e o gelo cristalino.
( ) o vidro é um sólido amorfo que se contrai de maneira desigual, quebrando ao atingir 0ºC
( ) como a água não é pura, ao diminuir a temperatura, ocorreu uma reação com aumento da pressão
interna da garrafa.
13. Assinale V ou F
( ) O ouro é dourado. Então seus átomos são dourados.
( ) Uma substância macia não pode ser feita de moléculas rígidas.
( ) Por definição, uma substância pura possui pontos de fusão e ebulição constantes. Entretanto, como não é
possível obter uma substância 100% pura, nunca obteremos “pontos de fusão e ebulição constantes”.
( ) O balanceamento da equação química garante a representação da Lei de Conservação das Massas.
( ) Quando o prego enferruja, sua massa aumenta.
15. Com relação às forças intermoleculares, indique falso ou verdadeiro:
( ) Os constituintes das essências dos perfumes tem baixa polaridade elétrica, por isso são dissolvidos em
álcool.
( ) As substâncias gordurosas são apolares e são removidas pelos detergentes por meio da interação da
extremidade iônica de suas estruturas com as gorduras.
( ) A polaridade de uma molécula é consequência de sua geometria e da diferença de eletronegatividade
entre os átomos ligantes.
( ) A ligação C – O na molécula de gás carbônico é apolar.
( ) Um sólido molecular apolar é bastante solúvel nos solventes polares
16. Misturando-se volumes iguais de uma solução de ácido sulfúrico com pH = 1,0 e de hidróxido de lítio com
pH = 13,0 em um balão volumétrico, obtém-se uma solução que apresenta pH igual a quanto?
17. Em um sistema, certa massa de gás oxigênio (O2) ocupa um volume de 5 mL, com uma pressão de 2 atm.
Qual deverá ser o novo volume dessa massa gasosa se ela for submetida a uma transformação isotérmica até
que a pressão passe a valer 760 mmHg? (resposta em mL)
18. Supondo que você saiba contar 1 molécula por segundo, calcule quantos anos você demoraria para
contar as moléculas existentes em 1 litro copo de de água. Dados: 1 mol de água = 18g.
19. Se quisermos preparar um tampão de pH=9,00, quantos moles de NH4Cl devem ser adicionados a 2,0 L
de solução de NH3 0,10M? Multiplique o resultado em mol por 100. (Dados: Constante de dissociação do
NH3(Kb=1,8 x 10–5)
20. Determine a soma do número de partículas alfa e beta emitidas pelo 238U para produzir o 206Pb.
Olimpíada Pernambucana de Química – Modalidade III
14. Assinale V ou F
( ) Numa mistura homogênea seus componentes só podem ser separados por processos químicos.
( ) Água oxigenada se decompõe sob ação de luz.
( ) Dimitri Mendeleev descobriu o germânio.
( ) Al é utilizado na fabricação de fogos de artifício
( ) Cgrafite , Cdiamante e C60 são formas alotrópicas do carbono, mas existem muitas outras.
Olimpíada Pernambucana de Química – Modalidade III