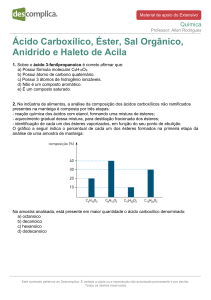
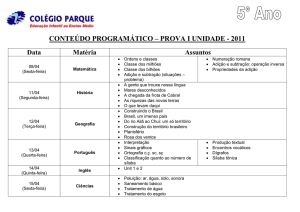
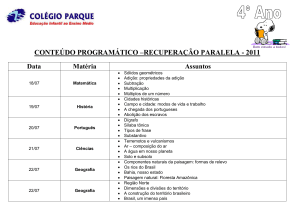
Prof. MGM D’Oca
_______________________________PPGQTA
______________________________________
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Reações de Substituição: Hidrólise de Esteres
Ésteres podem ser hidrolisados em solução básica ou ácida. Em solução
ácida, a reação é reversível. A posição do equilíbrio depende da
concentração relativa de água e o álcool. Em solução aquosa, ocorre
hidrólise. Em solução alcoólica, o equilíbrio é deslocado em favor do éster.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Hidrólise de Ésteres: Mecanismos
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Hidrólise de Ésteres: Mecanismos
Estudos mecanisticos mostram a dependência da concentração dos íons
hidrogênios ou íons hidróxido e estudos isotopicos comprovam que a ligação
acila-oxigênio, não a ligação alquil-oxigênio, que é clivada durante a
hidrólise.
Efeitos do substituintes influenciam em vários pontos do mecanismo da
hidrólise de ésteres. Na reação catalisada por base, substituintes
retiradores (EWG) no grupo acil ou alcoxi facilitam a hidrólise. Se o grupo
carbonila é conjugado com grupos doadores (ERG), reatividade é diminuída
pela estabilização do estado fundamental.
R. A. McClelland, J. Am. Chem. Soc. 106, 7579 (1984).
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Hidrólise de Ésteres: Efeitos dos Substituintes
Como fenóis são ácidos mais fortes que os álcoois, suas bases
conjugadas são melhores grupos abandonadores que íons alcóxido.
Ésteres arilicos são hidrolisados mais rapidamente do que os ésteres
alquílicos.
Estes efeitos substituintes podem observados para o mecanismo de
BAC2 observando o efeito dos substituintes em cada etapa do mecanismo.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Hidrólise de Ésteres: Mecanismo AAL1
Mudanças estruturais no ester podem deslocar a hidrólise deste através de
outros mecanismos. Quando o éster é derivado de um álcool terciário, a
hidrólise ácida geralmente ocorre por um mecanismo envolvendo a quebra da
ligação oxigênio-alquila. A mudança no mecanismo é devido a estabilidade do
carbocátion terciário que pode ser formado por esta quebra, levando a
formação de alcenos ou álcoois. Esse mecanismo é denominado AAL1,
indicando a clivagem da ligação alquil-oxigênio e sendo unimolecular.
Este mecanismo permite que ésteres terciários possam ser hidrolisados
seletivamente.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Hidrólise de Ésteres: Catálise Nucleofilica
A hidrólise de ésteres também pode ocorrer por catálise nucleofílica. Se um
dos reagentes é um nucleófilo mais eficaz do que a água na reação com o
grupo carbonila a reação de transferência de acila pode formar um novo
derivado acila. Se este intermediário acila é mais reativo este é rapidamente
atacado pela água do que o éster original, levando a hidrólise. Exemplo: Uso
de imidazol como catalisador Nu-
Ânions carboxilatos também podem servir como catalisadores nucleofílicos,
neste caso, um anidrido é o intermediário reativo.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Catalise Intramolecular de Esteres
O caso da hidrólise de éster intramolecular tem sido estudado
extensivamente para o ácido acetilsalicílico (aspirina) e seus derivados. Os
dados cinéticos mostram que o ânion é hidrolisado mais rapidamente do que
as espécies neutras, indicando que o grupo carboxilato é envolvido na reação
de alguma forma. Neste caso podemos considerar três mecanismos.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Transesterificação de Ésteres
Ésteres reagem com álcoois em solução ácida ou básica, a troca de grupos
alcoxi (intercâmbio de éster) ocorre por um mecanismo que é igual ao da
hidrólise. O álcool ou alcóxido atua como o nucleófilo. Em contraste com a
hidrólise, a reação de alcoólise é reversível em soluções ácidas e básicas. O
intermediário chave é o aduto tetraédrico. Seu destino é determinado
principalmente pela nucleofilidade (basicidade relativa) dos dois grupos alcoxi.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Aminolise de Ésteres
Ésteres reagem com amônia e aminas para levar a amidas. O mecanismo
envolve ataque nucleofílico de amina no grupo carbonila, seguido por
expulsão do grupo alcoxi do intermediário tetraédrico.
Com bons grupos abandonadores como fenóis ou trifluoroethanol, a
etapa lenta é a expulsão do oxigênio. Com grupos abandonadores mais
pobres, a formação do intermediário tetraédrico ocorre somente após a
formação da espécie aniônica B.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Aminolise de Ésteres
A amina pode ajudar na desprotonação do intermediário zwitteriônico
tetraédrico. A desprotonação deste intermediário aumenta a densidade de
elétrons no nitrogênio e favorece a expulsão de um íon alcóxido.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Aminólise de Ésteres
O pH da solução é fundamental na determinação do curso da reação. Em
solução básica, eliminação de oxigênio é dominante, porque o substituinte de
nitrogênio desprotonated é um grupo de saída muito pobre e também ajuda para
facilitar a eliminação do alcóxido pela doação de elétrons. Em solução ácida, o
nitrogênio protonado é um grupo abandonador melhor e também perde sua
capacidade de ajudar na eliminação do alcóxido. Nestas circunstâncias, é
favorecida a eliminação de nitrogênio.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Hidrólise de Amidas
A hidrólise de amidas para levar a ácidos carboxílicos e aminas requer
condições consideravelmente mais vigorosas do que para a hidrolise de
ésteres. A razão é que o nitrogênio estabiliza fortemente a carbonila.
Em solução básica, um mecanismo BAC2 semelhante a hidrólise de ésteres
é proposto. A principal diferença está relacionada a baixa capacidade dos
amidetos como grupos abandonadores, comparados aos alcóxidos.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Hidrólise de Amidas
O mecanismo de hidrólise usual em soluções fortemente ácidas envolve a
adição de água ao intermediário amida O-protonada seguida por
dissociação do intermediário tetraédrico.
Neste caso no intermediário tetraédrico a troca (intercâmbio)
de
hidrogênio do oxigênio com o nitrogênio significa leva exclusivamente a
eliminação do substituinte de nitrogênio. Este resultado é explicado, porque o
grupo amino é o sitio mais básico e é o local preferido de protonação no
intermediário tetraédrico. A amina protonado é um grupo abandonador
melhor deixando do que o íon hidróxido.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Acilação de Nucleofilos de Oxigênio e Nitrogênio
A conversão de álcoois em ésteres por O-acilação (Esterificação de
Fischer) e de aminas para amidas por N-acilação são reações orgânicas
fundamentais que ocorrem de forma inversa a hidrólise. Exemplos:
Os procedimentos mais comuns de acilação de O e N usam agentes de
acilação que são mais reativos que os seus ésteres e ácidos carboxílicos.
Anidridos e cloretos de acila reagem rapidamente com álcoois e aminas para
dar ésteres e amidas, respectivamente.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Acilação de Nucleofilos de Oxigênio e Nitrogênio
Acilação de álcoois é freqüentemente realizada na presença de uma base
orgânica, como a piridina. Esta base serve para dois propósitos: neutraliza
os prótons gerados na reação e impede o desenvolvimento de altas
concentrações de ácido. Piridina também está diretamente envolvida na
reação como um catalisador nucleofílico
Piridina é mais nucleofilica que o álcool. O produto resultante, um íon
acilpiridinium, é, por sua vez, mais reativo do que o cloreto de acila original. A
evidência que suporta este mecanismo é observação espectroscópica do íon
acetilpiridinium intermediário. Um catalisador mais eficiente é 4Dimetilaminopiridina (DMAP), que funciona da mesma forma, mas é mais
reativo devido ao seu substituinte dimetilamino doador de elétrons (ERG).
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Acilação de Nucleofilos de Oxigênio e Nitrogênio
Além de cloretos de acila e anidridos de ácido, há um número de outros
tipos de compostos que são agentes de acilação. Muitos foram desenvolvidos
para facilitar a síntese de polipeptídeos, que exigem condições suaves e alta
seletividade.
Carbodiimides, como dicyclohexylcarbodiimide (DCC), constituem um
importante grupo de reagentes para converter ácidos carboxílicos para em
amidas e ésteres. O mecanismo de formação de ligação amida-carbodiimida
é mostrado abaixo:
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Adição de Organometálicos
A adição de nucleófilos de carbono, tais como compostos organometálicos,
aos grupos carbonila é um dos principais métodos de formação de ligações
carbono-carbono. Reagentes organolítios e organomagnesium são altamente
reativos com compostos carbonilicos. Com aldeídos e cetonas, o aduto
tetraédrico é estável e álcoois são isolados após a protonação do aduto.
Com cloretos de acila, anidridos, ésteres, carboxamidas e ânions
carboxilato, o aduto tetraédrico pode sofrer eliminação. A eliminação leva a
uma cetona, podendo uma segunda etapa de adição ocorrer.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Adição de Enol e Enolatos a C=O
A reação de adição aldólica envolve a dimerização catalisada por ácido ou
base de uma cetona ou aldeido. Sob certas condições, o produto da reação
pode sofrer desidratação, levando a um aldeído ou cetona α,β-insaturada.
Esta variante pode ser chamada de Condensação Aldólica.
O mecanismo da reação catalisada por base envolve a formação de
equilíbrio do íon enolato, seguido pela adição do enolato ao grupo carbonila
do aldeído ou cetona. Estas reações de aldeídos ocorrem em solução básica
diluída em ou abaixo da temperatura ambiente. Em condições um pouco
mais vigorosas, como temperaturas altas ou maior concentração de base, a
etapa de eliminação ocorre.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Adição de Enol e Enolatos a C=O
Catalise Básica:
A constante de equilíbrio geralmente favorece a formação do produto de
desidratação por causa do sistema α,ß-insaturado, conjugado, mais estável.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Adição de Enol e Enolatos a C=O
Catalise Ácida:
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Adição de Enol e Enolatos a C=O
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Adição de Enol e Enolatos a C=O
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Reação Estereoespecífica
Uma conseqüência do ET cíclico quelado é que a reação é
estereoespecífica em relação a configuração E- ou Z- do enolato. O
enolato E dá o produto aldol-anti e o enolato-Z dá o aldol-syn.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Reação Estereoespecífica: Enolatos de Boro
Em geral, a estereosseletividade é maior do que para enolatos de lítio.
As distâncias de ligação do O−B são mais curtas do que O-Li, e isto leva
a um ET mais compacto e amplia as interações estéricas que controlam a
estereosseletividade facial.
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Reação Estereoespecífica
Quando a reação de adição aldólica é realizada sob condições
termodinâmicas, a diferença de estabilidade dos produtos syn e anti
determina a composição do produto. No caso de enolatos de lítio, os
adutos podem ser equilibrados. A maior estabilidade do isômero anti é
atribuída à posição pseudoequatorial do grupo metila no ET quelado.
Com grupos substituintes maiores, a preferência termodinâmica para o
isômero anti é ainda maior
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Formação de Silil Ceteno Acetais e Silil Enol Eteres
Os enolatos podem ser muitas vezes trapeados por agentes sililantes
(TMSCl, cloro trimetil silano) para levar aos correspondentes éteres de silicio.
silil enol eter
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Reação de Silil Ceteno Acetais e Silil Enol Eteres
com Aldeídos e Cetonas
Oxaborazolidinona
derivada do triptofano
Exemplo: Versão Assimétrica
MGM D’Oca
Adição e Substituição em Compostos Carbonílicos
______________________________________
Reação de Silil Ceteno Acetais e Silil Enol Eteres
com Aldeídos e Cetonas
ET:
Indução Assimétrica