Introdução a Bioquímica:
Biomoléculas
Referência
Aula 1
Autores:
Autores
Ignez Caracelli e
Julio Zukerman-Schpector
Introdução ao Curso: Aminoácidos
Editora:
Editora EdUFSCar
ISBN: 85-7600-065-2
Ignez Caracelli
Julio Zukerman Schpector
BioMat – DF – UNESP/Bauru
LaCrEMM – DQ – UFSCar
Bauru, 13 de agosto de 2007
1
2
Linguagem x Informação
Bancos de Dados
http://www.rcsb.org/pdb/
letras
frases
http://www.ebi.ac.uk/thornton-srv/databases/pdbsum/
aminoácidos
3
proteínas
4
Problema Central
frases
proteínas
Estruturas tridimensionais
métodos
experimentais
texto
métodos
teóricos
função
5
6
Estruturas tridimensionais
moléculas
pequenas
7
moléculas
grandes
8
Estruturas Tridimensionais
Estruturas Tridimensionais
difração de raios X
cristalografia
métodos experimentais: cristal
9
Estruturas Tridimensionais
1conformação
conformação
planejada
dobrada
10
Estruturas Tridimensionais
proteínas
planejamento
HC05
HC05
1conformação
conformação
não-planejada
estendida
síntese
cristalografia
moléculas pequenas
11
12
Estruturas Tridimensionais in silico
Estruturas Tridimensionais
Modelagem Molecular
alinhamento de seqüências
predição de estruturas de proteínas
modelagem por homologia
modelagem de ligantes
docking
quem são as proteínas???
como são suas estruturas 3D??
como desempenham suas funções???
13
Aspectos Básicos da Estrutura
Polipeptídica
14
Aminoácidos
Grupo amina
(protonado)
As proteínas são cadeias (polímeros)
constituídas por
COOH 3N +
• 20 L-aminoácidos
Grupo carboxila
(dissociado)
C H
R
R
• D-açúcares
Cadeia
lateral
15
Carbono α
16
Ligação Peptídica
Ligações nas Proteínas
•interações covalentes (fortes)
– ligação peptídica
– ligacao dissulfeto
•interações não-covalentes (fracas)
– interações eletrostáticas
– interações de van der Waals
– ligações de hidrogênio
– interações hidrofóbicas
17
Estereoisomeria
L-aminoácido
18
Isômeros Óticos
D-aminoácido
Uma molécula quiral, é aquela que não é idêntica à sua imagem especular.
Uma molécula quiral e sua imagem especular formam um par de
enantiômeros, ou isômeros especulares.
19
20
Aminoácidos: estereoisomeria
Isômeros Óticos: exemplo
Talidomida
• enantiômero R: efeito tetragênico
• enantiômero S: efeito sedativo
COO-
S
+
R
COOH C NH3+
H3N C H
CH3
L-Alanina
D-Alanina
CH3
21
Aminoácidos e Polaridade
Molécula Apolar (ou não-polar)
átomo ou molécula apolar: o centro das
cargas positivas coincide com o centro das
cargas negativas na ausência de campos
elétricos.
COOH 3N +
C H
R
R:
nao-polar
polar nao-carregado
polar carrgado
22
cargas
positivas
Carbono α
Cadeia
lateral
+ ≡
23
−
p = 0
cargas
negativas
24
Molécula Apolar (ou não-polar)
Molécula Apolar (ou não-polar)
molécula apolar
o centro de cargas positivas (núcleo)
coincide com o centro de cargas
negativas (nuvem eletrônica).
molécula apolar na presença de campo elétrico:
⇒ centro das cargas positivas ≠ centro das cargas
negativas
⇒ um dipolo induzido (orientado de – para +)
⇒p≠0
cargas
positivas
E
+ ≡
E
cargas
positivas
−
p
p
cargas
negativas
dipolo induzido
o centro de cargas positivas (núcleo)
não coincide com o centro de cargas
negativas (nuvem eletrônica).
cargas
negativas
p≠0
+ ≡
−
⇒ p=0
+ ≡
25
Molécula Polar
−
⇒ p≠0
26
moléculas
mesmo na ausência de campo elétrico:
carga elétrica ⇒ dipolo ⇒ sistema com muitas cargas
→centro de cargas positivas ≠ centro
das cargas negativas
A forma como as cargas estão distribuídas muda a forma
do campo elétrico criado por essas cargas ou
distribuição de cargas.
Na maioria dos sistemas que serão analisados, ou a
distribuição de cargas pode ser tratada como se as
cargas fossem isoladas (íons em um meio diluído), ou
como no caso de uma membrana, consideramos uma
distribuição linear, como a formada entre as placas de
um capacitor, que cria um campo magnético constante e
homogêneo.
→ molécula é um dipolo chamado de
dipolo permanente
27
28
Os aminoácidos
Os aminoácidos e proteínas
O químico holandês Gerardus Mulder foi o
primeiro a dotar o termo proteína em 1838.
Por que precisamos conhecer este assunto?
• O que acontece em uma proteína, na ligação de uma
enzima ao seu substrato, entre outras coisas, é
dominado pela estrutura tridimensional das moléculas e
por sua distribuição de cargas;
Do grego proteus: primário, o mais importante.
• o conhecimento dos aminoácidos pode ser fundamental
para o entendimento em nível molecular do
funcionamento do funcionamento das moléculas e isto
possibilita planejar como, por exemplo, inibir uma
enzima, planejar o desenho de um novo fármaco, etc.
29
Os aminoácidos e proteínas
30
Os aminoácidos e proteínas
Os aminoácidos
sistemático.
O primeiro aminoácido descoberto foi a asparagina,
extraída do aspargo, em 1806.
não
possuem
um
nome
O primeiro identificado em uma proteína foi a leucina
por Proust em 1819.
A glicina tem esse nome devido ao gosto doce
(glycos = doce).
O último a ser descoberto foi a treonina em 1936. (hoje
isto nao e mais verdade…)
A tirosina foi originalmente isolada do queijo
(tyros = queijo).
31
O ácido glutâmico foi encontrado no glúten de
trigo.
32
Aspectos Básicos da Estrutura
Polipeptídica
Os aminoácidos
Os aminoácidos não possuem um nome
sistemático. A glicina tem esse nome devido ao
gosto doce (glycos = doce). Tirosina foi
originalmente isolada do queijo (tyros = queijo) e o
ácido glutâmico foi encontrado no glúten de trigo
As proteínas são polímeros constituídos por
• 20 L-aminoácidos-padrão unidos
por ligações peptídicas
• Os aminoácidos reunem-se em
combinações praticamente infinitas
33
34
35
36
1° –> 2° –> 3° –> 4° Estrutura
Grupo carboxila
(dissociado)
Aminoácidos
Grupo amina
(protonado)
COOH 3N +
C H
R
R
Carbono α
Cadeia
lateral
37
38
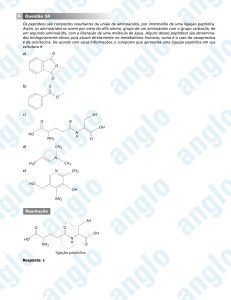
Ligação Peptídica
Ligação Peptídica
H
H2N C COOH
H
H2N C COOH
R1
H
H
R2
H
H2N C COOH
R3
H
H2N C CO NH C CO NH C COOH + 2H2O
R1
39
R2
R3
40
Ligação Peptídica
Ligações Peptídicas proteína
H
N-terminal
R1
C
H2N H C
H2N C COOH
H
O
N
H C
C
C
N H COOH
Ri
H
O
H
Rn
H2N C COOH
R1
C-terminal
H
H2N C COOH
R2
H
H
R3
H
H2N C CO NH C CO NH C COOH + 2H2O
n-2
R1
R2
R3
41
Ligação Peptídica
42
Estereoisomeria
• Ligação dupla parcial
– Plana, curta
• C a trans >> cis
L-aminoácido
43
D-aminoácido
44
Isômeros Óticos
Isômeros Óticos: exemplo
Talidomida
• enantiômero R: efeito tetragênico
• enantiômero S: efeito sedativo
S
R
Uma molécula quiral, é aquela que não é idêntica à sua imagem especular.
Uma molécula quiral e sua imagem especular formam um par de
enantiômeros, ou isômeros especulares.
45
46
Ângulos dihédricos Phi e Psi
Aminoácidos: estereoisomeria
Ângulos dihédricos são
definidos por 4 átomos
– Phi (Φ) é a torção ao redor
N–Cα
COO+
COOH C NH3+
H3N C H
CH3
Psi (Ψ) é a torção ao redor
L-Alanina
D-Alanina
CH3
Cα –C’
Φ e Ψ especificam a
conformação da cadeia principal
47
48
Ângulo diédrico φ
Ângulo diédrico ψ
φ
φ é o ângulo de torção
em torno de N−
− Cα
C’
N(i+1)
ψ é o ângulo de torção
em torno de Cα–C’
C’
ψ
Cα
Cα
N
N
C’(i-1)
49
Estrutura covalente
50
As Forças não-covalentes nas proteínas
•
• ligação peptídica
• ligação dissulfeto
•
•
•
51
interações eletrostáticas entre cargas
e dipolos;
forças de van der Waals;
ligações de hidrogênio e
interações hidrofóbicas.
52
Ligações de hidrogênio em estrutura terciária
H
HO
CH2
Aceptores
N
HN
H
CH2
R
Doadores
S
H3 N +
C H
Glicina
Gly, G
C H
CH
H 3C
CH3
Alanina
Ala, A
Valina
Val, V
K
N CH2
H
CH2
H3N+
CH3
H
H
H
C,M
Y
C H
COO-
COO-
COOH 3N +
S,T
HO CH
Aminoácidos com cadeias laterais não-polares
H
H
R
N
H
NH
C
R
NH2+
O
E,G,N,Q
H
C
H
R
O
N,Q
N C
H
53
54
(G, A, V, L, I, F, W, M, P)
Aminoácidos com cadeias laterais não-polares
COOH3N+
H3C
CH
CH3
COO-
COO-
C H
CH2
Aminoácidos com cadeias laterais não-polares
Leucina
Leu, L
H3N+
H3 N+
C H
CH
H3C
CH2
Isoleucina
Ile, I
CH3
C H
CH2
Fenilalanina
Phe, F
COOH3 N +
C H
Triptofano
Trp, W
CH2
NH
55
56
Aminoácidos com cadeias laterais não-polares
Aminoácidos com cadeias laterais
polares não-carregados (S, T, N, Q, Y, C)
COO-
COO Prolina
H3N+
Pro, P
NH2+
C H
CH2
CH2
S
COO-
Metionina
Met, M
H 3N +
C H
CH2OH
COO-
Serina
Ser, S
NE
H 3N +
C H
H C OH
Treonina
Thr, T
CH3
CH3
57
58
Aminoácidos com cadeias laterais
polares não-carregados (S, T, N, Q, Y, C)
COO
H3 N
+
COO-
-
C H
CH2
CONH2
Aminoácidos com cadeias laterais
polares não-carregados (S, T, N, Q, Y, C)
Asparagina
Asn, N
H3N+
C H
CH2
COOH3 N
Glutamina
Gln, Q
+
C H
CH2
CH2
COOTirosina
Tyr, Y
H3 N
+
C H
Cisteína
Cys, C
CH2
SH
CONH2
OH
59
60
Aminoácidos com cadeias laterais
polares carregados (D, E, K, R, H)
COO
COO
H3N
C H
CH2
COO-
-
-
+
Aminoácidos com cadeias laterais
polares carregados (D, E, K, R, H)
ÁcidoAspártico
Asp, D
H 3N
+
C H
CH2
H3N+
Ácido Glutâmico
Glu, E
CH2
COO-
C H
Lisina
Lys, K
CH2
CH2
CH2
CH2
COO-
NH3+
COO-
Arginina
Arg, R
H3 N
+
C H
CH2
CH2
CH2
NH
+
H2 N C
61
Aminoácidos com cadeias laterais
polares carregados (D, E, K, R, H)
COOH3N+
C H
CH2
NH+
HN
Histidina
His, H
63
63
NH2
62