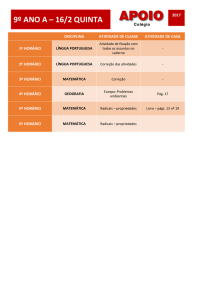
Reações de Radicais
Substituição Radicalar
1
Formação de Radicais
Halogenação e Combustão:
i)
Ocorrem por um mecanismo radicalar.
ii)
Envolvem a quebra homolítica de uma ligação.
Clivagem Homolítica:
Em uma homólise cada átomo fica com
Clivagem Heterolítica:
Resulta na formação de
íons:
um elétron da ligação covalente:
Exemplo? Em que tipo de
solvente ocorre?
Formação de Radicais
Radicais são formados pela quebra homolítica de
Setas:
reações relativamente fracas.
Exemplos:
a) Peróxidos:
b) Halogênios:
Algumas Características dos Radicais:
i)
Átomo ou grupo de átomos com um elétron desemparelhado.
ii)
Representado por um ponto.
iii)
Altamente reativos. Não podem ser normalmente isolados.
iv)
Intermediários em diversas reações orgânicas
Estrutura dos Radicais
Os radicais formados dos alcanos possuem uma estrutura trigonal planar (sp2):
Estabilidade Relativa dos Radicais
Estabilidade Relativa de Radicais de Carbono
Estabilidade Relativa de Radicais
6
Estabilidade Relativa de Radicais de Carbono
.
.
.
H
.
H
menos estáveis
que radicais alquil
.
H
H
.H
CH3
CH3
CH3
H3C
.
H
CH2
H3C
.
CH3
.
mais estáveis
que radicais alquil
7
Reação de Alcanos com Halogênios
Alcanos são compostos muito pouco reativos, pois têm somente fortes
ligações σ e átomos sem carga parcial (são nem eletrófilos nem nucleófilos).
Entretanto, alcanos reagem com Cl2 e Br2.
8
Reação de Alcanos com Cl2 ou Br2
Mecanismo para a cloração de metano:
9
Mecanismo da reação do átomo de Cl com metano
Reação de Alcanos com Cl2 ou Br2
Mecanismo para a bromação de etano:
11
Reação de Alcanos com Cl2 ou Br2
Fatores que determinam a distribuição dos produtos:
A etapa que determina a distribuição de produtos é a
abstração de hidrogênio.
12
Reação de Alcanos:
Alcanos: Estabilidade de Radicais
Estabilidade Relativa de Radicais Alquila:
O radical mais estável é formado mais rapidamente, portanto, o 2-clorobutano
é formado mais rapidamente; consequentemente este é o produto principal na
cloração do butano.
13
Reação de Alcanos:
Alcanos: Distribuição de Produtos
pg 341 middle
Velocidade Relativa de Formação de Radicais Alquila com Radical Cl a TA:
14
Distribuição de Produtos da Cloração
Velocidade Relativa:
C1o 1,0; C 2o 3,8; C 3o 5,0.
Na determinação das quantidades relativas de produto, obtido devem ser consideradas
fatores de probabilidade e de reatividade.
probabilidade: o número de hidrogênios que podem ser abstraídos, levando à
formação de um determinado produto
reatividade: a velocidade relativa com que um hidrogênio em particular é abstraído
15
Distribuição de Produtos da Cloração
16
Princípio da ReatividadeReatividade-Seletividade
Um radical bromo é menos reativo e mais seletivo do que um
radical cloro.
Velocidade relativa de formação de radicais alquila com radical bromo a 125 oC:
Velocidade relativa de formação de radicais alquila com radical cloro a TA:
17
Postulado de Hammond
O estado de transição será mais similar à espécie mais
próxima dele energeticamente
Reação exergônica:
Reação endergônica:
estado de transição precoce
estado de transição tardio
18
19
Princípio da ReatividadeReatividade-Seletividade:
Reação de Propano com Radicais de Cl e Br
Aplicação do Postulado de Hammond
Quanto maior a reatividade, menor a seletividade
20
Princípio da Reatividade
Reatividade--Seletividade
Cloro: reação exergônica – ET similar aos reagentes
Bromo: reação endergônica – ET similar aos produtos
(Postulado de Hammond)
Quanto maior a reatividade, menor a seletividade
21
Fluoração e Iodação de Alcanos
Termodinâmica das Transformações:
A fluoração é uma reação muito violenta para ser utilizada na síntese.
Alcanos sofrem (fluoração), cloração e bromação, mas não iodação,
22
porque a reação total na iodação é endotérmica.
Substituição Radicalar de Hidrogênios
Benzílicos e Alílicos
Formação Preferencial dos Radicais mais estáveis:
23
Bromação Alílica e Benzílica com NBS
Vantagem: a baixa concentração de Br2
e HBr presentes torna pouco provável a
reação de adição de Br2 à dupla
24
Estereoquímica de Reações de Substituição
Radicalar
Configuração dos Produtos
25
Estereoquímica de Reações de Radicais
26
Estereoquímica de Reações de Substituição
Radicalar com Reagentes Quirais
Estereoquímica do Produto:
27
Adição de HBr a C=C via Radicalar
Iniciação
RO
OR
.
2 RO
HBr
Br
ROOH; hν
R
O
.
H
Br
.
ROH + Br
Propagação
Br
.
Br
Br
.
Br
.
H
+ Br
Br
.
Terminação
Br
Br
. + Br.
.
.
Br
Br2
Br
Br
28
Formação de Radicais
Métodos de formação de radicais
Formados a partir de moléculas com elétrons emparelhados
homólise de ligações σ fracas
2 RO
RO OR
O
transferência de elétron
e−
O
Formados a partir de outros radicais
substituição (abstração)
X
Y Z
adição
X
Y Z
eliminação (homólise)
X Y Z
X Y
+
Z
X Y Z
X Y
+
Z
29
Formação de Radicais
Homólise de ligações σ fracas
O
O
Ph
Fotólise de Halogêneos
O
Ph
O
60 - 80 ºC
∆G = 139 kJ mol -1
Ph
.O
.
O
N
NC
N
CN
.
66 - 72 ºC
∆G = 131 kJ mol-1
NC
N
N
Cl
Br
Br
I
I
luz (h ν)
2 Cl
.
.
∆G = 243 kJ mol-1
Ph
O
O
Cl
luz (h ν)
2 Br
∆G = 192 kJ mol-1
luz (h ν)
∆G = 151 kJ mol-1
2I
CN
30
.
.
Radicais Estáveis
H
C
N
O.
.
impedimento estérico (cinético)
estabilização eletrônica (termodinâmico)
Ph
Cl5C6
Ph
Fatores Principais
(i)
(ii)
.O
Ph
Ph
O
Ph
.
C6Cl5
C6Cl5
O
.
Efeito de Substituíntes
grupos elétron-atraentes
grupos elétron-doadores (incluíndo hiperconjugação)
grupos conjugados
.
.
N
O
.
OEt
mais estáveis
que radicais alquil
efeito de grupos funcionais
±I, ±M
31
Principais Reações de Radicais
dimerização
.
2
.
.
H
H
H
.
H
disproporcionamento
+
H
+
Sol
Sol
.
abstração de H
H
.
.
O
O
O
.
O
.
adição de O2 triplete
adição a insaturados
32
Principais Reações de Radicais
Reações típicas
com Nucleófilos polares
Compostos C=O
insaturados
Reações típicas
com Radicais
.
−
Nu
X
O
−
Ligações X-H
B
O
H
H O
.
X
H
O H
Haletos de
alquila
.
−
Nu
X
H3C Br
Br
33
Autoxidação de Aldeídos
34
Polimerização Radicalar
Iniciação:
peróxido de dibenzoila
radical oxibenzoila
Uma característica dos iniciadores radicalares é uma ligação relativamente
fraca para quebra homolítica. São utilizados em cerca de 0.005% (peso).
35
Propagação:
Terminação:
O grupo presente no final do polímero tem influência pequena nas
propriedades, sendo normalmente omitido.
36
Radicais e Ozônio Estratosférico
• o ozônio é o constituinte principal do “smog”
• o ozônio protege a Terra de radiação UV letal
(UV-C < 290 nm)
37
Destruição de Ozônio por CFCs
Clorofluorcarbonos permanecem na atmosfera até atingirem
a estratosfera.
Formação de radicais cloro dos CFCs com irradiação UV
Cl
F C Cl
F
hn
hν
Cl
F C
F
+
Cl
Reação dos radicais cloro com ozônio
Cl
ClO +
+
O3
O3
ClO
+
O2
Cl + 2 O2
38