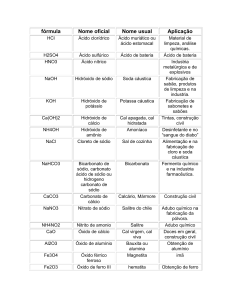
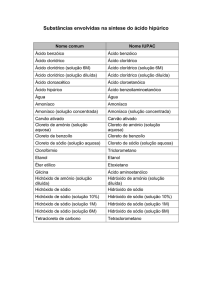
QUÍMICA - 1o ANO
MÓDULO 18
RELAÇÕES QUÍMICAS:
SIMPLES TROCA E
DUBLA TROCA
Como pode cair no enem
(ENEM) Um dos problemas ambientais decorrentes da industrialização é a poluição atmosférica.
Chaminés altas lançam ao ar, entre outros materiais, o dióxido de enxofre (SO2) que pode ser
transportado por muitos quilômetros em poucos dias. Dessa forma, podem ocorrer precipitações
ácidas em regiões distantes, causando vários danos ao meio ambiente (chuva ácida).
Um dos danos ao meio ambiente diz respeito à corrosão de certos materiais. Considere as
seguintes obras:
I) monumento Itamarati - Brasília (mármore);
II) esculturas do Aleijadinho — MG (pedra sabão, contém carbonato de cálcio);
III) grades de ferro ou alumínio de edifícios.
A ação da chuva ácida pode acontecer em:
a) I, apenas.
b) I e II, apenas.
c) I e III, apenas.
d) II e III, apenas.
e) I, II e III.
Fixação
.1) Complete as reações abaixo. Não se esqueça de ajustar os coeficientes.
a) AgNO3 + HCl →
s
b) NH4Cl + NaOH →
c) F2 + NaCl →
d) Cl2 + NaF →
e) Zn + HCl →
f) Cu + HCl →
g) Cu + H2SO4 →
h) AgNO3 + KBr →
Fixação
F
2) A ocorrência de uma reação de neutralização em solução aquosa acontece devido:
a) à precipitação de uma substância molecular pouco ionizada.
b) à formação de uma substância molecular praticamente não ionizada.
c) à formação de uma solução com igual número de íons positivos e negativos.
d) à liberação de uma substância iônica gasosa.
e) ao maior grau de ionização do ácido em relação à base.
3
h
p
a
b
c
d
e
Fixação
3) Um químico abriu um frasco de ácido clorídrico concentrado perto de um colega que utilizava
hidróxido de amônio. Depois de algum tempo, verificou que na superfície da bancada havia
pequenos pontos brancos. Este material branco poderia ser:
a) ácido nítrico;
b) amônia;
c) cloro;
d) nitrogênio;
e) cloreto de amônio.
Fixação
4) A substância química Na2SO3 pode ser obtida pela reação entre:
a) óxido de sódio e ácido sulfúrico;
b) cloreto de sódio e ácido sulfúrico;
c) hidróxido de sódio e ácido sulfídrico;
d) hidróxido de sódio e ácido sulfúrico;
e) óxido de sódio e ácido sulfuroso.
Fixação
5) Um jovem, após utilizar uma solução de sulfato de cobre II para proteger sua parreira, armazenou as sobras em um balde de ferro. Depois de algum tempo, observou que o balde estava
furado e que havia se formado um depósito avermelhado.
O material avermelhado pode ser:
a) óxido de cobre II
b) sulfeto de cobre II
c) sulfeto de ferro II
d) ferro metálico
e) cobre metálico
Fixação
6) A acidez estomacal é provocada pelo __________, presente no suco gástrico, e pode ser
diminuída pela ingestão de quantidades adequadas de __________.
a) ácido clorídrico, hidróxido de alumínio;
b) carbonato de cálcio, bicarbonato de sódio;
c) bicarbonato de sódio, ácido clorídrico;
d) ácido nítrico, óxido de alumínio;
e) ácido sulfúrico, cloreto de sódio.
Fixação
7) A substância que, ao ser adicionada em proporções adequadas, neutraliza a acidez do solo é:
a) CO2
d) CaCO3
b) H2Oe) HCl
c) SO2
Fixação
8) (UFF)
Nas anotações estava escrito um pormenor que à primeira vista me escapara, ou seja,
que o Zinco tão terno, delicado e dócil diante dos ácidos que o corroem imediatamente,
comporta-se, porém, diferente quando é muito puro; então resiste obstinadamente.
(LEVI, Primo. A tabela Periódica.
Rio de Janeiro: Relume – Dumará, 1994)
O fragmento acima revela a visão particular do romancista italiano sobre o comportamento
experimental do metal zinco perante os ácidos. Consultando a Tabela Periódica, encontram-se
metais que, em particular, não reagem com o HCl. Identifique-os:
a) Fe, Co e Hg
b) Au, Ag e Pt
c) Au, Fe e Ni
d) Ni, Co e Pt
e) Fe, Pt e Hg
Fixação
9) (PUC) O hidrogeno-carbonato de sódio, conhecido comercialmente como bicarbonato de
sódio, é usado como antiácido estomacal por ser capaz de reagir com o excesso de ácido clorídrico, presente no suco gástrico, resultando em um sal e um gás responsável pela eructação
(“arroto”). O nome do sal e a função química do gás são, respectivamente:
a) cloreto de sódio e óxido;
b) carbonato de sódio e ácido;
c) clorato de sódio e sal;
d) carbeto de sódio e base;
e) clorito de sódio e ácido.
Fixação
10) (FUVEST) Coloca-se em um recipiente de vidro água destilada, gotas de solução de
fenolftaleína e, em seguida, pedaços de sódio metálico: Observa-se, então, violenta reação
do metal com a água, resultando chama na superfície exposta do metal e coloração rósea na
solução. A chama e a coloração resultam, respectivamente, da queima de:
Chama
sódio
água
com
fenolftaleína
a) hidrogênio produzido na reação e aumento de pH.
b) oxigênio produzido na reação e aumento de pH.
c) nitrogênio do ar e aumento de pH.
d) hidrogênio produzido na reação e diminuição de pH.
e) nitrogênio do ar e diminuição de pH.
Proposto
1) Classifique as reações abaixo:
a) 2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
b) Mg + 2AgNO3 → Mg(NO3)2 + 2Ag
c) 2KI + Cl2 → 2KCl + I2
d) Na2CO3 + 2HCl → 2NaCl + H2O + CO2
Proposto
2) Um químico abriu um frasco de ácido clorídrico concentrado perto de um colega que utilizava
hidróxido de amônio. Depois de algum tempo verificou que na superfície da bancada havia
pequenos pontos brancos. Este material branco poderia ser:
a) ácido nítrico.
b) amônia.
c) cloro.
d) nitrogênio.
e) cloreto de amônio.
Proposto
3) A substância química Na2SO3 pode ser obtida pela reação entre:
a) óxido de sódio e ácido sulfúrico.
b) cloreto de sódio e ácido sulfúrico.
c) hidróxido de sódio e ácido sulfídrico.
d) hidróxido de sódio e ácido sulfúrico.
e) óxido de sódio e ácido sulfuroso.
Proposto
4) (ENEM) Suponha que um agricultor esteja
interessado em fazer uma plantação de girassóis. Procurando informação, leu a seguinte
reportagem:
Solo ácido não favorece plantio
Alguns cuidados devem ser tomados por
quem decide iniciar o cultivo do girassol.
A oleaginosa deve ser plantada em solos
descompactados, com pH acima de 5,2 (que
indica menor acidez da terra). Conforme as
recomendações da Embrapa, o agricultor
deve colocar, por hectare, 40 kg a 60 kg
de nitrogênio, 40 kg a 80 kg de potássio e
40 kg a 80 kg de fósforo. O pH do solo, na
região do agricultor, é de 4,8. Dessa forma,
o agricultor deverá fazer a “calagem”.
(Folha de S.Paulo, 25/09/1996)
Suponha que o agricultor vá fazer calagem (aumento do pH do solo por adição de
cal virgem — CaO). De maneira simplificada,
a diminuição da acidez se dá pela interação
da cal (CaO) com a água presente no solo,
gerando hidróxido de cálcio (Ca(OH)2), queP
reage com os ions H+ (dos ácidos), ocorrendo,
então, a formação de água e deixando ions
5
Ca2+ no solo.
a
Considere as seguintes equações:
b
I) CaO + 2H2O → Ca(OH)3
c
II) CaO + H2O → Ca(OH)2
d
+
2+
III) Ca(OH)2 + 2H → Ca + 2H2O
e
IV) Ca(OH)2 + H+ → CaO + H2O
O processo de calagem descrito acima
pode ser representado pelas equações:
a) I e II
b) I e IV
c) II e III
d) II e IV
e) III e IV
eProposto
,
5) A reação de 1 mol de ácido fosfórico com dois mols de hidróxido de sódio produz:
a) 2 mols de Na3PO4.
b) 1 mol de Na2HPO4.
c) 3 mols de NaH2PO4.
d) 2 mols de Na3PO3.
e) 1 mol de NaH2PO2 e 1 mol de Na2HPO3.
Proposto
P
6) Uma determinada substância caiu sobre uma pedra-mármore, havendo desprendimento de7
um gás. A substância que reagiu com o mármore pode ter sido:
a
a) cloreto de sódio;
b) ácido clorídrico;
c) cloreto de cálcio;
d) sacarose;
e) sulfato de cobre.
Proposto
7) (UFRJ) O sulfato de amônio pode ser obtido industrialmente pela reação do carbonato de
amônio com o sulfato de cálcio. Escreva a equação que descreve esta reação química.
Proposto
8) (FUVEST) Nitrato de bário pode ser preparado em meio aquoso, através das transformações
químicas a seguir:
Etapa 1: BaCl2 → BaCO3
Na2CO3
Etapa 2: BaCO3 → Ba(NO3)2
HNO3
Nas etapas 1 e 2, ocorrem, respectivamente:
a) precipitação de carbonato de bário e desprendimento de dióxido de carbono.
b) precipitação de carbonato de bário e desprendimento de hidrogênio.
c) desprendimento de cloro e desprendimento de dióxido de carbono.
d) desprendimento de dióxido de carbono e precipitação de nitrato de bário.
e) desprendimento de cloro e neutralização do carbonato de bário.
Proposto
9) (UNESP) Escreva as equações químicas balanceadas, indicando as fórmulas e os nomes
oficiais dos produtos das reações entre:
a) Óxido de sódio e água.
b) Zinco metálico e ácido sulfúrico.
Proposto
10) (UNITAU) Ao assoprarmos água de cal, estamos:
a) produzindo carbonato de cálcio;
b) injetando oxigênio na solução;
c) tornando a solução azul;
d) formando um óxido como produto;
e) mudando a solução do estado líquido para o estado gasoso.
Proposto
11) (FUVEST)
Holanda quer deixar de ser um País Baixo
Cientistas estão pesquisando a viabilidade de se elevar o litoral holandês — que é muito
baixo e há séculos vem sendo ameaçado por enchentes — através da injeção de substâncias
químicas na terra.
Os pesquisadores acreditam poder elevar o litoral injetando ácido sulfúrico numa camada
de rocha calcária 1,5 km abaixo da superfície. A reação química resultante produziria gipsita,
que ocupa o dobro do espaço do calcário e que empurra a superfície terrestre para cima.
(Notícia da Reuters publicada na Folha de S.Paulo, outubro de 1992.)
Sabendo que a gipsita é CaSO4 hidratado e que o calcário é CaCO3, a reação citada produz
também:
a) H2S
b) CO2
c) CH4
d) SO3
e) NH3
Proposto
P
12) (FUVEST) A respiração de um astronauta numa nave espacial causa o aumento da con-1
centração de dióxido de carbono na cabine. O dióxido de carbono é continuamente eliminadoa
através da reação química com reagente apropriado. Qual dos reagentes a seguir é o maisc
indicado para retirar o dióxido de carbono da atmosfera da cabine?
b
a) Ácido sulfúrico concentrado.
c
b) Hidróxido de lítio.
c
c) Ácido acético concentrado.
d) Água destilada.
e) Fenol.
Proposto
-13) (UNESP)
a) Escrever as equações das reações de óxido de potássio com a água e de trióxido de enxofre
com água.
b) Classificar os óxidos.
c) Escrever a equação da reação entre os produtos formados nas reações dos dois óxidos
com água.
Proposto
14) (UFMG) A queima do enxofre produz um dos seus óxidos, SO2(g) ou SO3(g). A identificação de
qual dos dois é, realmente, produzido pode ser feita, fazendo-se reagir esse gás com Ba(OH)2(aq).
As reações de cada um dos gases, SO2(g) ou SO3(g), com essa base levam à formação de um
sal, diferente em cada caso, que se precipita.
a) ESCREVA a equação balanceada da reação entre SO2 e Ba(OH)2.
b) ESCREVA a equação balanceada da reação entre SO3 e Ba(OH)2.