Olimpíada de Química do Rio Grande do Sul – 2016
folhas amareladas. Para solucionar esse problema adiciona-se ao solo óxido de
magnésio. Em 100 g de óxido de magnésio, a massa de magnésio e de oxigênio
aproximadamente, em gramas, é de:
a) 60 e 40
MODALIDADE EM 2
b) 48 e 32
c) 24 e 16
d) 30 e 70
e) 45 e 55
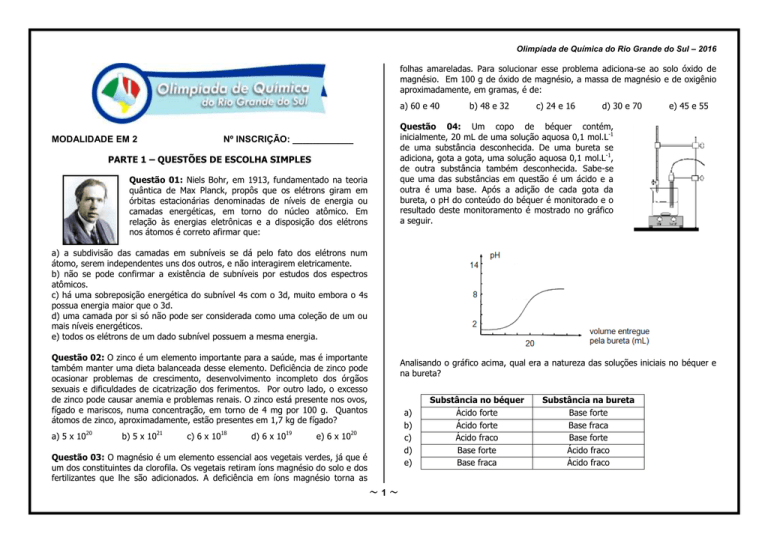
Questão 04: Um copo de béquer contém,
inicialmente, 20 mL de uma solução aquosa 0,1 mol.L-1
de uma substância desconhecida. De uma bureta se
adiciona, gota a gota, uma solução aquosa 0,1 mol.L-1,
de outra substância também desconhecida. Sabe-se
que uma das substâncias em questão é um ácido e a
outra é uma base. Após a adição de cada gota da
bureta, o pH do conteúdo do béquer é monitorado e o
resultado deste monitoramento é mostrado no gráfico
a seguir.
Nº INSCRIÇÃO: ____________
PARTE 1 – QUESTÕES DE ESCOLHA SIMPLES
Questão 01: Niels Bohr, em 1913, fundamentado na teoria
quântica de Max Planck, propôs que os elétrons giram em
órbitas estacionárias denominadas de níveis de energia ou
camadas energéticas, em torno do núcleo atômico. Em
relação às energias eletrônicas e a disposição dos elétrons
nos átomos é correto afirmar que:
a) a subdivisão das camadas em subníveis se dá pelo fato dos elétrons num
átomo, serem independentes uns dos outros, e não interagirem eletricamente.
b) não se pode confirmar a existência de subníveis por estudos dos espectros
atômicos.
c) há uma sobreposição energética do subnível 4s com o 3d, muito embora o 4s
possua energia maior que o 3d.
d) uma camada por si só não pode ser considerada como uma coleção de um ou
mais níveis energéticos.
e) todos os elétrons de um dado subnível possuem a mesma energia.
Questão 02: O zinco é um elemento importante para a saúde, mas é importante
também manter uma dieta balanceada desse elemento. Deficiência de zinco pode
ocasionar problemas de crescimento, desenvolvimento incompleto dos órgãos
sexuais e dificuldades de cicatrização dos ferimentos. Por outro lado, o excesso
de zinco pode causar anemia e problemas renais. O zinco está presente nos ovos,
fígado e mariscos, numa concentração, em torno de 4 mg por 100 g. Quantos
átomos de zinco, aproximadamente, estão presentes em 1,7 kg de fígado?
a) 5 x 1020
b) 5 x 1021
c) 6 x 1018
d) 6 x 1019
Analisando o gráfico acima, qual era a natureza das soluções iniciais no béquer e
na bureta?
a)
b)
c)
d)
e)
e) 6 x 1020
Questão 03: O magnésio é um elemento essencial aos vegetais verdes, já que é
um dos constituintes da clorofila. Os vegetais retiram íons magnésio do solo e dos
fertilizantes que lhe são adicionados. A deficiência em íons magnésio torna as
~1~
Substância no béquer
Ácido forte
Ácido forte
Ácido fraco
Base forte
Base fraca
Substância na bureta
Base forte
Base fraca
Base forte
Ácido fraco
Ácido fraco
Olimpíada de Química do Rio Grande do Sul – 2016
Modalidade EM2
Questão 05: O dióxido de enxofre é um gás incolor e muito solúvel em água.
Ocorre naturalmente nas erupções vulcânicas e reage com o oxigênio formando
trióxido de enxofre, conforme a equação balanceada:
Esse equilíbrio apresenta a constante de ionização Ka= 1,85 x 10-5 mol.L-1. Se a
essa solução adicionarmos cristais de acetato de sódio (NaOAc) sólido, é correto
afirmar que haverá:
Considerando que essa reação tem ∆H negativo, a formação de SO3 será
favorecida por:
a) Uma diminuição do valor de Ka na razão direta da adição dos cristais.
b) Um aumento do valor de Ka na razão direta da adição dos cristais.
c) Um deslocamento do equilíbrio, aumentando a concentração dos íons H3O+.
d) Um deslocamento do equilíbrio, diminuindo a concentração dos íons H3O+.
e) A manutenção da concentração dos íons H3O+.
a) Aumento da pressão e diminuição da temperatura.
b) Diminuição da pressão e aumento da temperatura.
c) Aumento da pressão e da temperatura.
d) Diminuição da pressão e da temperatura.
e) Aumento da pressão e a variação da temperatura não influenciam na formação
de SO3.
Questão 08: O pH é um parâmetro para medir o grau de acidez,
neutralidade ou basicidade de uma solução. Dissolvendo-se um
sal BA, sendo A um ânion do ácido fraco (HA) e B um cátion da
base forte (BOH), em água, o pH resultante desta solução será:
a) neutro
b) alcalino, ou seja, maior do que 7
c) ácido, ou seja, menor do que 7
d) alcalino, ou seja, menor do que 7
e) ácido, ou seja, maior do que 7
Questão 06: Uma das teorias aceitas para a formação da água é que os gases
provenientes das erupções vulcânicas, entre eles hidrogênio e oxigênio, a altas
temperaturas, se uniram formando moléculas de água, na forma de vapor. Com o
resfriamento do planeta, esses vapores se condensaram formando água líquida.
Questão 09: A tabela indica valores aproximados de pH de soluções usuais.
Solução
Detergente amoniacal
Leite de magnésia
Lágrimas
Café
Suco de tomate
Suco de laranja
Vinagre
Considerando a reação dada e que os reagentes e produtos estão à mesma
pressão e temperatura, é correto afirmar que:
a) é necessário fornecer 57,8 kcal para obter 1 mol de H2O(g) a partir dos gases
hidrogênio e oxigênio.
b) hidrogênio e oxigênio gasosos não coexistem sem reagirem.
c) Ao se processar a reação há um aumento no número de mols.
d) O valor –57,8 kcal representa o ∆H para a síntese de 1 mol de água gasosa,
nestas condições.
e) Há mais energia armazenada no produto do que nos reagentes.
pH
12
9
7
5
4
3
3
A partir das informações dessa tabela podemos concluir que:
a) Os ácidos são líquidos coloridos.
b) O leite de magnésia neutraliza um detergente amoniacal.
c) O vinagre descora uma solução contendo fenolftaleína.
d) A tabela indica três soluções básicas.
e) O suco de laranja muda para azul a cor do tornassol vermelho.
Questão 07: Numa solução de ácido acético, H3CCOOH, representado por HOAc,
de concentração 1,00 mol.L-1, ocorre o equilíbrio, mostrado abaixo.
~2~
Olimpíada de Química do Rio Grande do Sul – 2016
Modalidade EM2
Questão 10: O esquema a seguir mostra um modo de obtenção de água potável
a partir da água do mar, que é bombeada contra uma membrana semipermeável
que permite somente a passagem de parte da água. Assim, obtém-se uma
corrente de água pura e outra de rejeito, a qual é concentrada em sal.
GABARITO OBJETIVAS
QUESTÃO
1
2
3
4
5
6
7
8
9
10
Baseado no esquema, considere as afirmações seguintes:
I – O esquema abordado refere-se a um processo tradicional de osmose, no qual
ocorre passagem de solvente do meio mais concentrado para o menos
concentrado, obtendo-se água pura.
II – À pressão atmosférica normal, a água do mar (1) tem temperatura de
congelamento maior que o ponto de congelamento que a água pura (3).
III – A água de rejeito (2) apresenta maior efeito ebulioscópico quando
comparado à água do mar (1).
EM 1
E
E
A
B
A
D
D
B
C
B
PARTE 2 – QUESTÕES ANALÍTICO-EXPOSITIVAS
Questão 11: Considere o sistema representado abaixo. A seringa contém solução
aquosa de ácido clorídrico. O tubo (1) contém solução aquosa de carbonato de
sódio, e o tubo (2) contém uma solução aquosa de hidróxido de bário. Quando o
êmbolo da seringa é acionado, há formação de um ácido no tubo (1), que sofre
decomposição, formando um gás mais B. O gás passa para o tubo (2), reagindo
com hidróxido de bário, formando um precipitado.
É(são) correta(s):
a) apenas I.
b) apenas III.
c) apenas II e III.
d) apenas I e II.
e) I, II e III.
Considerando o procedimento descrito responda as questões:
~3~
Olimpíada de Química do Rio Grande do Sul – 2016
Modalidade EM2
resultante e titulou-se com 20 mL de solução de NaOH 0,02 mol.L-1, até completa
neutralização. Pergunta-se:
a) Qual a concentração em mol.L-1 da mistura de ácidos?
b) Qual a concentração em mol.L-1 da solução de H2SO4?
c) Para neutralizar completamente 300 mL da solução de H2SO4, qual será a
massa de NaOH, em gramas, necessária?
a) 0,02 mol de OH- ---------- 1 L
X
0,02 L
X= 0,0004 mol de OH0,0004 mol de H+-----------0,05 L
X
1L
X= 0,008 mol de H+/L Logo a concentração necessária para neutralizar
é de 0,008 mol/L
a) Escreva a equação química balanceada da reação entre o ácido clorídrico e o
carbonato de sódio;
b) Escreva a equação química balanceada de decomposição do ácido formado;
c) Escreva a equação química balanceada de formação do precipitado no tubo 2;
d) Qual é o nome da substância B formada no tubo 1?
e) Se a solução do frasco 2 fosse substituída por solução de NaOH, e todo o
procedimento repetido, ocorreria alguma reação de precipitação no tubo (2)?
Justifique.
b) 0,008 mol de H+
--------1 L
X
0,2 L
X= 0,0016 mol de H+ no total
0,01 mol de H+ do HCl---------1L
x-----------------------------------0,1 L
x= 0,001 mol de H+ do HCl
0,0016 mol de H+ do total - 0,001 mol de H+ do HCl = 0,0006 mol de H+
do H2SO4
0,0006 mol de H+----------0,1 L
x-------------------------------1 L
x= 0,006 mol de H+
H2SO4 → 2 H+ + SO421 mol H2SO4----------2 H+
x---------------------------0,006 mol de H+
x= 0,003 mol/L
c) 0,003 mol de H2SO4--------------------1L
x-----------------------------------------0,3 L
x= 0,0009 mol
H2SO4 + 2 NaOH → Na2SO4 + 2 H2O
1 mol
2 mol
RESPOSTA DE ISABEL MARIA CASA BLUM (Colégio Notre Dame – Passo
Fundo)
a) 2 HCl + Na2CO3 → 2 NaCl + H2CO3 ou 2 HCl + Na2CO3 → 2 NaCl
+ H2O + CO2
b) H2CO3 → H2O + CO2
c) Ba(OH)2 + CO2 → BaCO3 + H2O]
d) A substância B é o cloreto de sódio (NaCl)
e) Não, pois o sal formado dessa vez ( Na2CO3) seria solúvel em água,
sem formar precipitado.
Questão 12: Misturam-se 100 mL de uma solução de ácido sulfúrico X mol.L-1
com 100 mL de ácido clorídrico 0,01 mol.L-1. Retirou-se 50 mL da solução
~4~
Olimpíada de Química do Rio Grande do Sul – 2016
0,0009
x
Modalidade EM2
x= 0,0018 mol de NaOH
c) Não afeta o equilíbrio, a adição de um catalisador só diminui o tempo
que o sistema leva para chegar ao equilíbrio.
1 mol de NaOH---- 40 g
0,0018 mol----------x
X= 0,072 g de NaOH
d) kp= [pCO]2/ p CO2
e) o valor de kc = -X
Questão 13: A reação de transformação do dióxido de carbono em monóxido de
carbono, representada pela equação abaixo, é muito importante em alguns
processos metalúrgicos:
Questão 14: Considere a célula eletroquímica a seguir apresentada:
Sabendo que o ∆H é + 174 kJ por mol de C(s), qual o efeito sobre esse equilíbrio
quando:
(Justifique suas respostas)
a) Adiciona-se carbono sólido?
b) Aumenta-se a temperatura?
c) Introduz-se um catalisador?
d) Escreva a expressão teórica da constante de equilíbrio dessa reação, em
termos de pressões parciais.
e) Considerando que Kc para a reação direta tem valor genérico “X”, qual será o
valor genérico de Kc para a reação inversa, em termos de “X”?
Dados – potenciais de redução:
Mg 2+ + 2 e- → Mg
Cr3+ + 3 e- → Cr
RESPOSTA DE ISABEL MARIA CASA BLUM (Colégio Notre Dame – Passo
Fundo) E NÍCOLAS POLLY (Fundação Escola Técnica Liberato Salzano
Vieira da Cunha – Novo Hamburgo)
E0 = -2,34 V
E0 = -0,74 V
Após fechar o circuito pela chave A, responda:
a) Quais as reações anódica, catódica e global, respectivamente, para esta célula
eletroquímica?
b) Qual a diferença de potencial do sistema, acusado no voltímetro B?
c) Qual a massa do magnésio que se dissolve, devido a uma reação do metal,
durante 9650 segundos, sabendo que, nesse intervalo de tempo, a intensidade da
corrente manteve-se constante e igual a 0,1 ampère?
a) O carbono sólido não afeta o equilíbrio pois como a concentração de
sólidos praticamente não varia, os sólidos não afetam o equilíbrio.
b) Como o ∆H é positivo a reação direta é endotérmica, logo, aumentar
a temperatura desloca o equilíbrio no sentido de formação dos
produtos.
RESPOSTA DE ISABEL MARIA CASA BLUM (Colégio Notre Dame – Passo
Fundo) E GUILHERME LEGRAMANTI (Colégio Santa Dorotéia – Porto
Alegre)
~5~
Olimpíada de Química do Rio Grande do Sul – 2016
Modalidade EM2
a) Reação anódica: 3 Mg → 3 Mg+2 + 6 eb) Reação catódica: 2 Cr+3 + 6e- → 2 Cr
c) Reação Global: 3 Mg + 2 Cr3+ → 3 Mg+2 + 2 Cr
d) ∆E= + 2,34 V – 0,74 V = 1,6 V
e) Q= i.t
Q= 0,1 A. 9650 s
Q= 965 C
96500 C -------1 mol de elétrons
965 C---------------x
X= 0,01 mol de elétrons
Mg → Mg+2 + 2 e24 g------------2 mols de elétrons
x-----------------0,01 mol de elétrons
x= 0,12 g de Mg
Boa Prova!
~6~












