O GRUPO DO
NITROGÊNIO
GRUPO 15 OU V
Todos os elementos desse grupo são
sólidos com exceção do nitrogênio que é
um gás nas condições ambientais (25 °C
e 1 atm)
Todos os elementos desse grupo
apresentam 5 elétrons na camada de
valência.
NITROGÊNIO
O nitrogênio é um elemento químico com
símbolo N, número atômico 7 e número de
massa 14 (7 prótons e 7 nêutrons).
Há 19 isótopos do Nitrogênio, no
entanto, apenas 2 são estáveis.
São estáveis: N-14 (99,634%) e N-15
(0.366%)
Os outros 17 são radioativos e
possuem tempo de vida que varia de
nanossegundos a 10 minutos.
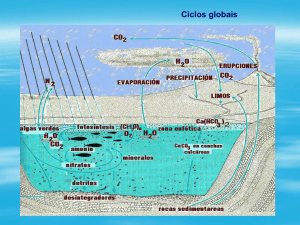
Nas condições ambientes é encontrado no
estado gasoso, obrigatoriamente em sua
forma molecular diatômica (N2), formando
cerca de 78% do ar atmosférico.
Na
molécula
de
nitrogênio ocorrem três
ligações covalentes entre
os dois átomos.
7N
2-5
Possíveis cargas: –1,+1,– 2, +2, +3, +4, +5
Como elemento (N) tem uma elevada
eletronegatividade (3 na escala de Pauling)
e 5 elétrons no nível mais externo (camada
de valência), comportando-se como íon
trivalente (-3) na maioria dos compostos
que forma.
Para obter o nitrogênio basta realizar uma
destilação fracionada do ar líquido.
78% Nitrogênio -
21% Oxigênio -
1% Argônio
1. Entrada do Ar
2. Limpeza
3. Compressão
4. Resfriamento
5. Separação do gases
6. Coleta do argônio
7. Vaporização
8. Armazenamento em
forma Gasosa
9. Armazenamento em
forma Líquida do
Nitrogênio (tanque
criogênico)
10. Bombeamento para os
tanques de
armazenamento.
O gás nitrogênio (N2) é usado como um
gás inerte no processamento de metais,
no refino de petróleo, e no processamento
de alimentos.
O
nitrogênio líquido
(P.E. = - 196°C) é
um refrigerante muito
útil na indústria e no
laboratório.
ATIVAÇÃO DO NITROGÊNIO
O nitrogênio (N2) não é muito reativo.A
principal explicação é a força da ligação N-N
que é grande.
Algumas
bactérias
conseguem reduzir o N2 a
temperatura
ambiente.
Essas bactérias estão
presentes nos nódulos
das raízes dos legumes.
PRINCIPAIS COMPOSTOS
Com o hidrogênio forma o amoníaco
(NH3) e a hidrazina ( N2H4 ).
O amoníaco líquido — anfótero como a
água — atua como uma base em solução
aquosa formando íons amônio (NH4+). O
mesmo amoníaco comporta-se como um
ácido em ausência de água, cedendo um
próton a uma base, dando lugar ao ânion
amida ( NH2- ).
Com o oxigênio forma vários óxidos como
o óxido nitroso ( N2O ) ou gás hilariante, o
óxido nítrico (NO) e o dióxido de
nitrogênio ( NO2 )
Os dois últimos são representados
genericamente por NOx e são produtos de
processos de combustão, contribuindo
para o aparecimento de contaminantes
(smog fotoquímico).
FÓSFORO
O fósforo (grego [phosphorus], portador de
luz) é um elemento químico de símbolo P,
número atômico 15 (15 prótons e 15
elétrons) e massa atômica igual a 31 u.
Há 23 isótopos do Fósforo.
Suas massas variam de P-24 a P-46.
O tempo de vida varia de nanossegundos
a 2 minutos.
O mais estável é o P-31 que contribui com
quase 100% de todo Fósforo da Terra
É um sólido na temperatura ambiente
É um não-metal.
Possíveis cargas: +3, –3 e +5
É encontrado na natureza combinado,
formando fosfatos (PO4-3)
É
um
nutriente
essencial das plantas
(fertilizantes)
O fósforo elementar é obtido a partir do
fosfato de cálcio bruto, pela redução com
carbono em forno de arco elétrico.
2 Ca3(PO4)2 + 6 SiO2 + 10 C → 6 CaSiO3 + 10 CO + P4
FÓSFORO BRANCO E VERMELHO
As duas formas são tratadas como alótropos
O fósforo branco é um sólido que consiste
de moléculas de P4 tetraédricas.
O fósforo vermelho pode ser obtido
aquecendo-se o fósforo branco a 300ºC
em uma atmosfera inerte por vários dias.
O fósforo vermelho é um sólido amorfo.
Diferente do branco, o fósforo vermelho
não inflama-se espontaneamente ao ar.
ARSÊNIO
O arsênio ou ainda arsênico, é um
elemento químico de símbolo As com
número atômico 33 (33 prótons e 33
elétrons) e com massa atômica 75 u.
Há 35 isótopos de Arsênio.
Suas massas variam de As-60 a As-92.
O tempo de vida varia de nanossegundos
a 80 dias.
O mais estável é o As-75 que contribui
com quase 100% de todo Arsênio da
Terra
É um sólido e um semi-metal (metalóide)
Possíveis cargas: +3, –3 e +5
O
arsênio
apresenta
três
estados
alotrópicos: cinza ou metálico, amarelo e
negro
Conservante de couro e madeira (arseniato
de cobre e crômio), uso que representa,
segundo algumas estimativas, cerca de 70%
do seu consumo mundial.
Descolorante na fabricação do vidro (trióxido
de arsênio).
O arsênio e seus compostos são
extremamente tóxicos, especialmente o
arsênio inorgânico. Em Bangladesh
ocorreu uma intoxicação em massa, a
maior da história, devido à construção de
uma infinidade de poços de água que
estavam contaminados com esse tipo de
material.
ANTIMÔNIO
O antimônio (do grego antímonos, oposto
à solidão) é um elemento químico de
símbolo Sb de número atômico 51 (51
prótons e 51 elétrons) e de massa atômica
igual a 121,8 u.
Há 53 isótopos do Antimônio.
Suas massas variam de Sb-103 a Sb-139.
O tempo de vida varia
nanossegundos a 3 anos.
de
150
Os 2 isótopos mais estáveis são: Sb-121
(57,21%) e Sb-123 (42,79%).
À temperatura ambiente, o antimônio
encontra-se no estado sólido e é um semimetal (metalóide)
Apresenta
quatro
formas alotrópicas. Sua
forma estável é um
metal de coloração
branca
azulada.
O
antimônio negro e o
amarelo são formas
não metálicas instáveis.
Seus estados de oxidação mais comuns
são o +3 e o +5.
O antimônio é empregado principalmente
em ligas metálicas e alguns de seus
compostos para dar resistência contra o
fogo, em pinturas, cerâmicas, esmaltes,
vulcanização da borracha e fogos de
artifício.
BISMUTO
O bismuto ( do alemão "Wismut", "massa
branca" ) é um elemento químico de
símbolo Bi , de número atômico 83 ( 83
prótons e 83 elétrons ), de massa
atômica igual a 208,9 u.
Há 59 isótopos do Bismuto.
O tempo de vida varia de milissegundos a
milhares de anos.
O mais estável é o Bi-209 com tempo de
vida de 19.000.000.000.000.000.000 anos
O Bi-209 corresponde a quase 100% de
todo Bismuto da Terra.
À temperatura ambiente, o
encontra-se no estado sólido
bismuto
Este elemento é pesado , frágil , cristalino,
de coloração rosa que se assemelha
quimicamente ao arsênio e ao antimônio.
Cargas possíveis: +3 e +5
O oxicloreto de bismuto é usado
extensivamente em cosméticos, e o
subnitrato de bismuto, o subcarbonato de
bismuto são usados em medicina. O
subsalicilato de bismuto é um líquido corde-rosa usado como antidiarreico.
Entre os metais pesados é considerado o
menos tóxico. O bismuto e os seus sais
causam danos moderados ao fígado