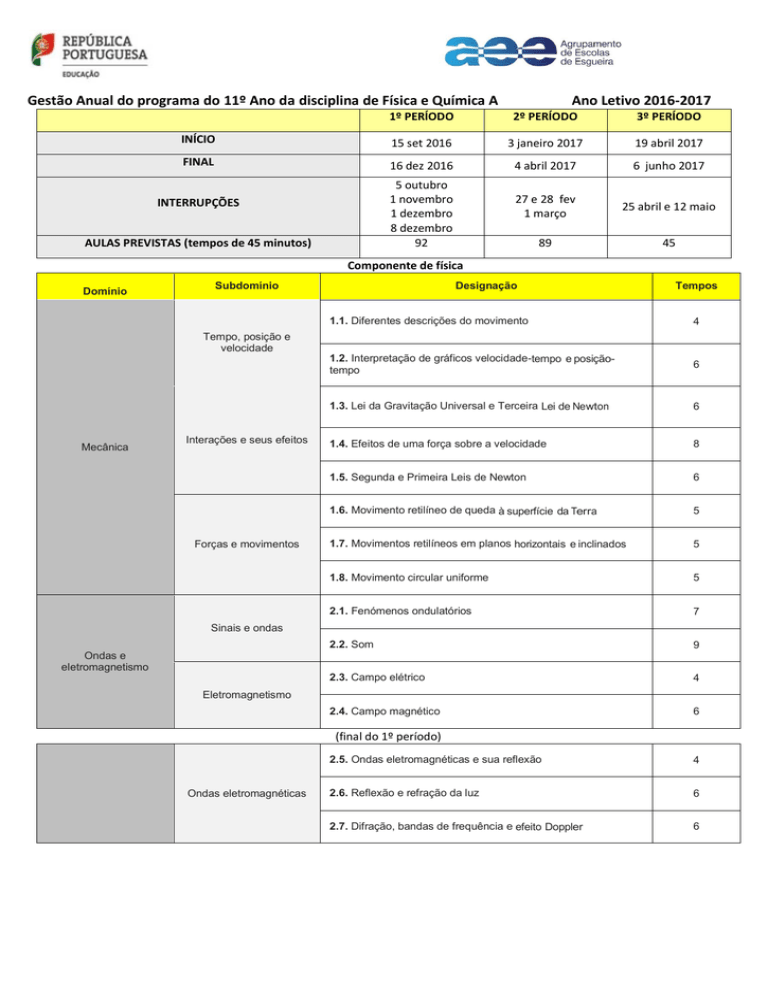
Gestão Anual do programa do 11º Ano da disciplina de Física e Química A
Ano Letivo 2016-2017
1º PERÍODO
2º PERÍODO
3º PERÍODO
INÍCIO
15 set 2016
3 janeiro 2017
19 abril 2017
FINAL
16 dez 2016
4 abril 2017
6 junho 2017
27 e 28 fev
1 março
25 abril e 12 maio
89
45
5 outubro
1 novembro
1 dezembro
8 dezembro
92
INTERRUPÇÕES
AULAS PREVISTAS (tempos de 45 minutos)
Componente de física
Domínio
Subdomínio
Designação
Tempos
1.1. Diferentes descrições do movimento
4
1.2. Interpretação de gráficos velocidade-tempo e posiçãotempo
6
1.3. Lei da Gravitação Universal e Terceira Lei de Newton
6
1.4. Efeitos de uma força sobre a velocidade
8
1.5. Segunda e Primeira Leis de Newton
6
1.6. Movimento retilíneo de queda à superfície da Terra
5
1.7. Movimentos retilíneos em planos horizontais e inclinados
5
1.8. Movimento circular uniforme
5
2.1. Fenómenos ondulatórios
7
2.2. Som
9
2.3. Campo elétrico
4
2.4. Campo magnético
6
Tempo, posição e
velocidade
Mecânica
Interações e seus efeitos
Forças e movimentos
Sinais e ondas
Ondas e
eletromagnetismo
Eletromagnetismo
(final do 1º período)
Ondas eletromagnéticas
2.5. Ondas eletromagnéticas e sua reflexão
4
2.6. Reflexão e refração da luz
6
2.7. Difração, bandas de frequência e efeito Doppler
6
Componente de química
Domínio
Subdomínio
Aspectos qualitativos
das reações químicas
Equilíbrio Químico
Equilíbrio químico e
extensão das reações
químicas
Reações em sistemas
aquosos
(3ª semana de Janeiro)
Designação
Tempos
1.1. Reações químicas: equações químicas e relações
estequiométricas
4
1.2. Reagente limitante, reagente em excesso e grau de pureza de
uma amostra
3
1.3. Rendimento de uma reação química
6
1.4. Economia atómica e química verde
2
2.1. Reações incompletas e equilíbrio químico
5
2.2. Extensão das reações químicas
7
2.3. Fatores que alteram o equilíbrio químico
5
1.1. Ácidos e bases
1
1.2. Acidez e basicidade de soluções
1
1.3. Autoionização da água
4
1.4. Ácidos e bases em soluções aquosas
2
1.5. Constantes de acidez e de basicidade e força relativa de ácidos
e de bases
6
1.6. Titulação ácido-base
4
1.7. Acidez e basicidade em soluções aquosas de sais
4
1.8. Aspetos ambientais das reações ácido-base
2
Reações ácido-base
(final do 2º período)
2.1. Caracterização das reações de oxidação‑redução
6
2.2. Força relativa de oxidantes e redutores
5
3.1. Mineralização das águas e processo de dissolução
1
3.2. Solubilidade de sais em água
5
3.3. Equilíbrio químico e solubilidade de sais
6
3.4. Alteração da solubilidade dos sais
5
3.5. Desmineralização de águas e processo de precipitação
2
Reações oxidação-redução
Soluções aquosas e
equilíbrio de
solubilidade
Estão previstas, ao longo do ano, 30 aulas para atividades de apresentação, avaliação e imprevistos.
A gestão anual do programa, será adequada por cada docente, às características de cada turma.
A avaliação é feita de acordo com os critérios aprovados em Conselho Pedagógico.
A componente prático-laboratorial (30%) será avaliada em grupos de nível, conforme o seguinte:
10%, para as Atividades Laboratoriais - nota de grupo;
5%, relativa à componente transversal das Atividades Laboratoriais - nota individual;
15%, para o Teste Laboratorial (1 por período) - nota individual.
Os testes escritos de 11º ano podem incluir itens relativos a conteúdos de 10º ano, cotados em cerca de 30%
da cotação total.
A planificação e atividades laboratoriais e de sala de aula estão descritas no programa, podendo ser
consultado no site http://www.dge.mec.pt/fisica-e-quimica-0
Material a solicitar aos alunos: caderno específico, manual, manual de actividades, máquina de calcular,
bata, luvas.