Tabela Periódica
Figura 1 – Tabela periódica
Fonte: RTimages/Shutterstock.com
CONTEÚDOS
Organização dos elementos na tabela periódica
Grupos ou famílias
Períodos
Propriedades dos elementos químicos
Classificação dos elementos químicos
AMPLIANDO SEUS CONHECIMENTOS
Existem mais de uma centena de elementos químicos e conhecer suas propriedades
pode parecer impossível. A tarefa se torna fácil e interessante, devido a uma das mais
importantes descobertas da Química – a organização dos elementos na Tabela
Periódica. A forma mais comum é a forma longa, e os elementos estão organizados em
ordem crescente de número atômico, a partir do hidrogênio (H).
Figura 2 – Tabela periódica completa
Fonte: Wikimedia
Com esta disposição, originam-se os períodos (linhas) e, na vertical (colunas), as
famílias ou os grupos.
Figura 3 – Grupos ou famílias e períodos na tabela periódica
Fonte: Fundação Bradesco
Grupos ou Famílias
Na Tabela Periódica há 18 colunas, com a série dos Lantanídeos e Actinídeos fora da
tabela. Essas colunas são os grupos ou famílias. Atualmente, os grupos são numerados
de 1 a 18, mas ainda, é muito comum, a utilização da representação com letras e
números, como 1A, 2A etc.
Os elementos do mesmo grupo apresentam propriedades semelhantes, e alguns
recebem nomes especiais:
Figura 4 – Grupos ou Famílias
Fonte: Fundação Bradesco
Metais alcalinos (Li, Na, K, Rb, Cs, Fr)
Alcalino é derivado de álcali, que significa cinza de plantas, que é uma referência
aos compostos de metais alcalinos nessas cinzas. Todos são metais macios e
prateados que fundem em baixas temperaturas. Reagem violentamente com a
água e produzem gás hidrogênio.
Metais alcalinos terrosos (Be, Mg, Ca, Sr, Ba)
Terroso é a palavra usada pelos alquimistas quando os compostos resistem bem
ao calor. Apresentam propriedades semelhantes à dos metais alcalinos, mas não
reagem de forma tão violenta com a água.
Calcogênios (O, S, Se, Te, Po)
Calcogênio significa gerador de cobre.
Halogênios (F, Cl, Br, I, At)
Halogênio significa gerador de sal.
Gases nobres (He, Ne, Ar, Kr, Xe, Rn)
Nobre significa pouca reatividade. São quimicamente neutros e são poucos
reativos, combinando-se com poucos elementos. Todos eles são incolores e
inodoros.
Algumas tendências desses elementos em formar íons1:
Elementos
Grupos ou
Propriedades
Famílias
Metais
Exemplos
(Representação)
1
Tendem a formar cátions +1
Li+; Na+; K+; etc
2
Tendem a formar cátions +2
Be+2; Mg+2; etc
Calcogênios
16
Tendem a formar ânions 2
O2; S2; etc
Halogênios
17
Tendem a formar ânions 1
F1; Cl1; Br1; etc
alcalinos
Metais
alcalinos
terrosos
Períodos
Existem sete períodos na Tabela Periódica. O início do período é à esquerda, na
primeira coluna. O número de elementos em cada período é variável.
1
Íon: partícula carregada eletricamente, com carga positiva ou negativa.
Período
N° de
N° atômico (Z)
Elementos
elementos
1°
2
Z=1eZ=2
H e He
2°
8
Z do 3 a 10
Li ao Ne
3°
8
Z do 11 ao 18
Na ao Ar
4°
18
Z do 19 ao 36
K ao Kr
5°
18
Z do 37 ao 54
Rb ao Xe
6°
32
Z do 55 a 86
Cs ao Rn
7°
Incompletos
Z do 87 em diante
Fr em diante
Para tornar a tabela mais manejável, o sexto e o sétimo período apresentam elementos
em duas linhas fora da tabela (série dos Lantanídeos e Actinídeos).
Atenção:
O hidrogênio (H) tem número atômico igual a 1, mas esse elemento não possui
propriedades semelhantes a todos os outros localizados no grupo 1 (metais
alcalinos). Esse elemento não é um metal alcalino.
Os elementos de números atômicos 57 a 71 (série dos lantanídeos) são muito
semelhantes entre si. Esses 15 elementos, também são conhecidos como
metais terras raras, e deveriam ficar todos na família 3, no 6° período.
Acontece da mesma forma com os elementos de números atômicos 89 a 103.
Todos esses possuem propriedades semelhantes e deveriam ficar na família 3,
no 7º período. Esses elementos são conhecidos como actinoides.
Classificação dos elementos
Os elementos são classificados como metais, não metais e metaloides2 (semimetais).
Figura 5 – Classificação dos elementos: Metais, Semimetais e Não metais
Fonte: Fundação Bradesco
Metais
Os metais formam substâncias simples, que de modo geral, conduzem bem a corrente
elétrica e o calor, são facilmente transformadas em lâminas e em fios e são sólidas nas
condições ambientes, com exceção ao mercúrio (Hg) que é líquido.
Não metais
Também conhecidos como ametais, formam substâncias simples que, ao contrário dos
metais, não conduzem bem o calor e nem a corrente elétrica, exceto o carbono na forma
de grafite. Não são transformados em fio ou lâminas.
Dos não metais, 11 formam substâncias simples gasosas nas condições ambientes:
hidrogênio, nitrogênio, oxigênio, flúor, cloro e os gases nobres.
2
Metaloide: também conhecido como semi-metal. ID da Imagem:101645104
Semimetais (metaloides)
Apresentam aparência e algumas propriedades de um metal mas comportam-se
quimicamente como um não metal.
Eles formam substâncias simples nas condições ambientes. Os mais importantes são
o silício e o germânio, que são empregados em componentes eletrônicos.
A Tabela Periódica é uma ferramenta útil para o desenvolvimento do conhecimento
químico, já que pela posição do elemento é possível conhecer as propriedades químicas
dele.
ATIVIDADES
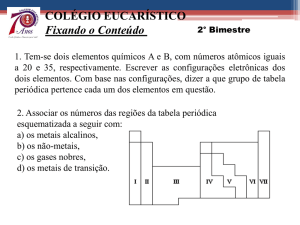
1. Na Tabela Periódica os elementos estão divididos em grandes grupos: metais, não
metais, semimetais e gases nobres. Na tabela a seguir, descreva as principais
características das substâncias simples desses grupos de elementos.
Grupo
Metal
Semimetais
Não metais
Gases nobres
Características
2. É possível prever as propriedades de um elemento pela sua localização na Tabela
Periódica.
a) Em que parte da Tabela Periódica estão localizados os metais?
_____________________________________________________________________
_____________________________________________________________________
b) Qual é a característica comum dos elementos flúor, cloro, bromo e iodo?
_____________________________________________________________________
_____________________________________________________________________
c) Por que os elementos hélio (He), neônio (Ne) e argônio (Ar) são chamados de
gases nobres?
_____________________________________________________________________
_____________________________________________________________________
3. (UEPG) Consulte a Tabela Periódica e assinale a alternativa, cujos elementos
químicos, na sequência em que se encontram, pertencem, respectivamente, aos
seguintes grupos: calcogênio, metal alcalino terroso, semimetal, metal de transição,
gás nobre, halogênio, metal alcalino e não metal.
a) Se – Bi – P – Mn – Xe – B – K – Zn.
b) O – Sr – Si – Cu – He – Cl – Li – Se.
c) N – Sn – Hg – Cr – H – Zr – Br – Ti.
d) S – Be – Cl – Ni – Ne – I – Na – C.
e) F, Ca, Sn, Fe, Ar, S, Nb, Os
4. (UnB. Adaptado) Assinale a alternativa incorreta, examinando a Tabela Periódica.
a) Uma das vantagens da classificação periódica é a de permitir o estudo das
propriedades dos elementos em grupos em vez do estudo individual.
b) Os átomos da família dos metais alcalinos têm as mesmas características físicas
e químicas.
c) Obtêm-se elementos artificiais a partir de transformações na eletrosfera de
elementos naturais.
d) Os elementos prata, ouro e cobre constituem um grupo.
e) Os símbolos dos elementos potássio, criptônio e césio são, respectivamente, K,
Kr e Ce.
5.
(VUNESP. Adaptado) Considerando-se as propriedades das substâncias dos
elementos químicos e a Tabela periódica é incorreta a afirmação:
a) Um metal é uma substância que conduz a corrente elétrica, é dúctil e maleável.
b) A maioria dos elementos químicos é classificada como não metal.
c) Um não metal é uma substância que não conduz corrente elétrica, não é dúctil
e nem maleável.
d) Os gases nobres são monoatômicos.
e) Um metaloide (ou semimetal) tem aparência física de um metal; mas tem
comportamento químico semelhante ao de um não metal.
6.
(UFC) Um átomo X tem um próton a mais que um átomo Y. Com base nessa
informação, assinale a alternativa correta.
a) Se Y for alcalino terroso, X será um metal alcalino.
b) Se Y for gás nobre, X será um halogênio.
c) Se Y for metal de transição, X será um gás nobre.
d) Se Y for um faz nobre, X será um metal alcalino.
7. (FUVEST) Um aluno estava analisando a Tabela Periódica e encontrou vários
conjuntos
de
semelhantes.
três
elementos
químicos
que
apresentavam
propriedades
Assinale a alternativa na qual os conjuntos de três elementos ou substâncias
elementares estão corretamente associados às propriedades indicadas no quadro
abaixo.
Números atômicos
Reatividades
Mesmo estado físico à
consecutivos
semelhantes
temperatura ambiente
a)
Pt, au, Hg
H2, He, Li
Cl2, Br2, I2
b)
Cl, br, I
O2, F2, Ne
Ne, Ar, Kr
c)
Li, Na, K
O2, F2, Ne
Pt, Au, Hg
d)
Ne, Ar, Kr
Mg, Ca, Sr
Cl2, Br2, I2
e)
Pt, Au, Hg
Li, Na, K
Ne, Ar, Kr
8. (FUVEST) Observe a posição do elemento químico ródio (Rh) na tabela periódica.
Assinale a alternativa correta a respeito do ródio.
a) Possui massa atômica menor que a do cobalto (Co).
b) Apresenta reatividade semelhante à do estrôncio (Sr), característica do 5º período.
c) É um elemento não metálico.
d) É uma substância gasosa à temperatura ambiente.
e) É uma substância boa condutora de eletricidade.
INDICAÇÕES
Para saber mais sobre os elementos químicos
Acesse os links sugeridos e navegue pela Tabela Periódica, obtendo mais informações
sobre os elementos químicos.
Tabela
Periódica
da
Fiocruz
-
Invivo.
Disponível
em:
<http://www.invivo.fiocruz.br/cgi/cgilua.exe/sys/start.htm?infoid=1346&sid=9>. Acesso
em: 10 maio 2016. 11h.
Tabela Periódica. org. Disponível em: <http://www.tabelaperiodica.org/>. Acesso em: 5
maio 2016. 9h15min.
Tabela
Periódica
Completa.
Disponível
em:
<http://www.tabelaperiodicacompleta.com/>. Acesso em: 11 maio 2016. 14h.
REFERÊNCIAS
ALMEIDA José Ricardo L.; BERGMAN Nelson; RAMUNNO Franco A. L. Química Geral
– Caderno de Atividades. 3ª ed: São Paulo: Harbra, 2015.
ATKINS Peter; JONES Loretta. Princípios de química: questionando a vida moderna
e o meio ambiente. Porto Alegre: Bookman. 2001.
BROWN Theodore L.; LEMAY Eugene H.; BRUCE Bursten E. Química a ciência
central. São Paulo: Pearson Prentice Hall. 2005.
ISUYAMA Reiko. Novo Telecurso de Química. 2 Ed, Rio de Janeiro. Fundação
Roberto Marinho. 2008.
FUNDAÇÃO BRADESCO. Curso de Formação Inicial e Continuada de Ciências da
Natureza. 2015.
PERUZZO Francisco Miragaia; CANTO Eduardo Leite do. Química na abordagem do
cotidiano. Volume único, 3ª edição, São Paulo: Moderna, 2007.
RTIMAGES/SHUTTERSTOCK.COM.
Tabela
periódica.
Disponível
em:
<
http://www.shutterstock.com/pic.mhtml?id=101645104&src=id>. Acesso em: 14 jun.
2016. 11h50min.
SANTOS Wilson; MÓL Gerson. Química Cidadã. Volume 1, 1ª Edição, São Paulo:
Editora Nova Geração, 2010.
USBERCO João; SALVADOR Edgar. Conecte química. Volume único, 1ª edição, São
Paulo: Saraiva, 2014.
WILLIAMS Linda D. Química sem mistério. Volume único, 2ª edição, Rio de Janeiro:
Alta Books, 2013.
WIKIPEDIA. Tabela Periódica. Disponível em:
<https://pt.wikipedia.org/wiki/Tabela_peri%C3%B3dica>. Acesso em: 11 maio. 2016.
10h.
GABARITO
1.
Grupo
Características
Os elementos são dúcteis, maleáveis, possuem alto ponto de
Metal
fusão, são duros e bons condutores de calor e eletricidade.
Esses elementos apresentam propriedades intermediárias entre
metais e não metais. Eles formam substâncias simples nas
Semimetais
condições ambientes. Os mais importantes são o silício e o
germânio, que são empregados em componentes eletrônicos.
Apresentam propriedades opostas aos metais, são maus
Não metais
condutores de calor e eletricidade, e em sua maioria, encontramse no estado gasoso. Não são transformados em fios ou lâminas.
São elementos estáveis e encontram-se isolados na natureza,
Gases nobres
não combinados com outros elementos.
2. a) Os metais ficam na parte esquerda da Tabela Periódica.
b) São elementos que possuem sete elétrons na camada de valência, e formam ânions
de carga 1.
c) Porque dificilmente reagem e existem na forma de gases monoatômica, de um
átomo só.
3. Alternativa B.
4. Alternativa E.
5. Alternativa B.
6. Alternativa A.
7. Alternativa E.
8. Alternativa E.