MÉTODOS PARA DIAGNÓSTICO DA TRICOMONÍASE: COMPARAÇÃO DO
DA MICROSCOPIA DE MONTAGEM MOLHADA COM O MÉTODO DE
CULTURA CONVENCIONAL
Renato Ribeiro Nogueira Ferraz1, Elaine Regiane Maia Neves2, Demétrius Paiva Arçari2,
Anderson Sena Barnabé2, João Victor Fornari2 .
1
Programa de Mestrado Profissional em Administração – Gestão em Sistemas de Saúde
(PMPA-GSS) – Universidade Nove de Julho (UNINOVE) - SP. 2Departamento de Saúde –
UNINOVE – SP.
Endereço para correspondência:
Renato Ribeiro Nogueira Ferraz.
Av. Francisco Matarazzo, 612 - 1o. andar - Prédio C
Barra Funda
01156050
São Paulo, SP – Brasil
Telefone: (11) 36659321
e-mail: [email protected]
RESUMO
Introdução: O trichomonas vaginalis tem de vencer a resposta imune do hospedeiro para
instalar a infecção, desenvolver resposta celular local com inflamação e acúmulo de
leucócitos, incluindo células alvo do HIV. A tricomoníase tem sido associada à
complicações no trato genital, infertilidade e ainda na aquisição e disseminação do HIV.
Atualmente, vários métodos laboratoriais têm sido utilizados para o seu diagnóstico.
Objetivo: Realizar uma revisão sistemática sobre dois métodos de diagnóstico da
tricomoníase, comparando suas eficácias. Resultados: Foram encontrados oito artigos, dos
quais dois foram excluídos, pois não comparavam a microscopia da montagem molhada
com a cultura. Conclusão: A cultura demonstrou melhor resultado para o diagnóstico da
tricomoníase com sensibilidade significativa, todavia com o inconveniente do maior custo e
da demora para obter o resultado.
Palavras-Chave: Trichomonas vaginalis. Montagem molhada. Cultura. Diagnóstico.
INTRODUÇÃO
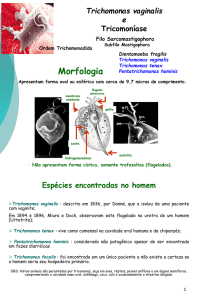
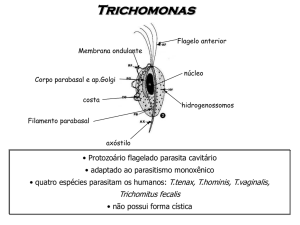
O trichomonas é um protozoário eucariótico flagelado de forma globular amebóide
com cinco flagelos móveis, sendo quatro livres e um aderido à parede (membranas
ondulantes). Como parasita extracelular residente da mucosa urogenital, a energia é obtida
dos carboidratos, é tolerante ao oxigênio e sobrevive sobre várias condições de O211.
O Trichomonas vaginalis tem que vencer várias barreiras e ainda a resposta imune
do hospedeiro para instalar a infecção, sendo necessário reconhecer o hospedeiro, colonizar
o sítio-alvo, vencer a competição com outros microorganismos presentes e sobreviver às
adversidades do ambiente. A citoaderência é necessária para a colonização e permanência
do patógeno. A tricomoníase desenvolve uma resposta celular local com inflamação da
mucosa vaginal, ocorrendo grande acúmulo de leucócitos, incluindo as células alvo do
HIV, como os linfócitos T CD4+ e macrófagos, causando também pontos hemorrágicos na
mucosa, facilitando o acesso do vírus à corrente sanguínea. O T. vaginalis consegue
40
degradar o inibidor da protease leucocitária secretória, responsável por bloquear o ataque
viral à celula9. É uma célula polimorfa, tanto no hospedeiro natural como em meios de
cultura. As condições físico-químicas (pH, temperatura, oxigênio, etc.) afetam o aspecto
dos trichomonas. No entanto, tendem a se tornar mais uniformes entre os flagelados que
crescem nos meios de cultura do que entre aqueles observados na secreção vaginal e na
urina10.
Normalmente, a infecção é transmitida durante a relação sexual, embora, em alguns
casos, não seja assim. O patógeno pode sobreviver por mais de uma semana no prepúcio de
um homem, sendo o vetor da doença. O período de incubação antes de desenvolver
sintomas é de 4 a 28 dias9. Na mulher, os sintomas mais comuns são corrimento vaginal de
cor amarelo-esverdeado bolhoso, de odor fétido, sendo acompanhado de prurido ou
irritação vulvovaginal. No homem é geralmente assintomático, podendo apresentar-se
como uma uretrite com fluxo leitoso ou purulento e uma leve sensação de prurido na
uretra10.
A tricomoníase tem sido associada a complicações no trato genital, incluindo parto
pré-termo, neoplasia cervical, infecções pós-histerectomia, doença inflamatória pélvica
atípica e infertilidade (muitas vezes pela diminuição da motilidade dos espermatozóides)11.
É proposto que a tricomoníase facilitaria um maior risco de infecção pelo HIV9.
A cultura é considerada o padrão clássico para estabelecer o diagnóstico, sendo
necessários meios específicos e incubação de 2 a 7 dias. O método mais simples e rápido de
diagnóstico é uma preparação úmida obtida por swab do fórnix vaginal posterior, colocada
numa gota de solução salina a 0,9%. A amostra não pode ser colhida do endocérvice, pois o
patógeno possui predileção pela exocérvice, raramente atingindo o endocérvice. Existem
ainda outros métodos para diagnosticar o T. vaginalis diferindo-se na sensibilidade e na
especificidade, como o papanicolaou e o exame microscópico do sedimento urinário, onde
é diagnosticado de forma casual. Os trichomonas imóveis tornam-se redondos, dificultando
a diferenciação dos leucócitos ou de pequenas células epiteliais no sedimento urinário ou
em preparações úmidas. Há ainda kits de imunoensaio fluorescente, que podem ser
aplicados à lâminas preparadas e métodos de imunoensaio enzimático (EIA), que também
são aplicados à lâminas preparadas e métodos com sonda de ácido nucleico12.
METODOLOGIA
Uma revisão sistemática foi realizada tomando como base de dados o Pubmed /
Medline, com acesso à busca avançada, e utilizando-se os seguintes descritores:
trichomonas vaginalis / diagnosis/ wet mount / culture. A estratégia utilizada na busca foi:
(((trichomonas vaginalis) AND wet mount) AND culture). Foram utilizados filtros para
artigos com o texto completo livre, publicados nos últimos cinco anos e realizados em seres
humanos.
RESULTADOS
A revisão da literatura foi finalizada no dia 10 de Outubro de 2013. Os artigos
encontrados compreendem publicações entre 2009 e 2012. Foram selecionados oito
artigos. Destes, quatro foram excluídos pois não se tratavam da comparação entre o método
da microscopia da montagem molhada e o método da cultura para o diagnóstico da
tricomoníase, ou mesmo não revelaram o desempenho dos métodos diagnósticos em
questão, apenas citando resultados de literatura anterior. Os quatro artigos restantes
41
analisaram vários métodos diagnósticos para a tricomoníase e, dentre eles, estavam os
métodos referentes ao presente estudo.
Paul et al1, em seu estudo realizado com 198 mulheres com idade média 21-52 anos
infectadas pelo HIV, coletou amostras de secreção vaginal, swabs do fundo de saco vaginal
posterior, sendo um swab utilizado para preparação da montagem molhada, analisando a
motilidade do parasita por técnicos treinados de 5-8 minutos após coleta da amostra. Outro
swab foi inoculado em meios modificados de diamante para cultura, incubada a 37o, sendo
verificada por 10 dias. Os resultados mostraram que pela montagem molhada apenas uma
(0,51%) foi considerada positiva para T. vaginalis e 6 (3,03%) apresentaram cultura
positiva.
Ertabaklar et al3, em seu estudo com 102 pacientes utilizando coleta de fundo de
saco vaginal posterior durante o exame ginecológico, comparou o método diagnóstico da
montagem molhada e da cultura. O resultado mostrou que a cultura, considerada padrãoouro da microscopia direta, apresentou sensibilidade 60% e especificidade calculada como
100%, enquanto a microscopia direta apresentou sensibilidade de 40% e especificidade
96,9%.
Zaki et al4, em seu estudo com 110 pacientes com idades variando entre 25 e 55
anos, sintomáticas, avaliou os métodos laboratoriais da microscopia da montagem molhada
e da cultura utilizando amostras de secreção vaginal à partir do fundo de saco posterior,
sendo examinados no mínimo 20 campos da montagem molhada por um observador.
Esfregaços vaginais foram inoculados para a cultura em meio de diamante, incubadas a 37o
durante 7 dias, e examinadas usando o método da montagem molhada diariamente para
detectar a motilidade de trofozoítos de T.vaginalis. No presente estudo os autores
concluíram que os métodos laboratoriais utilizados no diagnóstico da tricomoníase têm
vantagens e falhas. O exame microscópico da montagem molhada foi o primeiro a ser
descoberto e mantêm-se como o mais utilizado. Mostrou razoável sensibilidade (75,8%),
sendo um método rápido. Já a cultura, considerada o padrão ouro (com 100% de
sensibilidade), necessita de meios especiais e um período maior para obtenção do resultado.
Pattullo et al8, em seu estudo com 345 mulheres com idades entre 14 e 21 anos, com
e sem sintomas do trato geniturinário, realizou testes com a montagem molhada e a cultura,
sendo a montagem molhada mais amplamente utilizada e a cultura recomendada quando
T.vaginalis era suspeito, mas não visto em montagem molhada, como teste secundário.
Neste estudo transversal foram utilizados swabs vaginais para a montagem molhada com
técnicos de laboratório treinados para lê-los em busca da presença de motilidade de
trichomonas e cultura In Pouch de T.vaginalis. O resultado mostrou que, das 345 mulheres,
307 eram montagem molhada negativa, apenas 38 foram montagem molhada positiva com
sensibilidade 58,5%, e a cultura revelou 50 amostras positivas com sensibilidade 76,9%.
SÍNTESE DE EVIDÊNCIA
A literatura consultada mantém a cultura como padrão-ouro utilizado para
diagnóstico de tricomoníase, apesar da existência de outros métodos mais modernos e
amplamente estudados. A montagem molhada é um método rápido, de baixo custo, e que
requer profissionais treinados e um microscópio em bom estado, mas com sensibilidade
sempre inferior quando comparada à cultura convencional, com a desvantagem de pacientes
infectadas pelo Trichomonas vaginalis receberem um diagnóstico falso-negativo, o que
pode resultar em complicações a curto e médio prazo.
42
A cultura, no entanto requer meios especiais, custo mais elevado e os resultados só
estão disponíveis após 2-7 dias, que são necessários para o crescimento dos organismos. O
tamanho mínimo necessário para obter um resultado positivo é de cerca de 102
organismos/ml.
Os estudos revelaram também que diferentes amostras podem ser utilizadas no
diagnóstico de pacientes com tricomoníase. Sensibilidades e especificidades diferentes dos
testes utilizados variam de acordo com a amostra utilizada. A diferença estatística da
sensibilidade da microscopia da montagem molhada e da cultura foi significativa,
afirmando a importância da escolha pela cultura no diagnóstico da tricomoníase, a despeito
do seu maior custo e do tempo mais longo para se chegar ao resultado.
REFERÊNCIAS
1. Paul H, Peter D, Pulimood SA, Abraham OC, Mathai E, Prasad JH, Kannangai R. Role
of polymerase chain reaction in the diagnosis of Trichomonas vaginalis infection in human
immunodeficiency vírus-infected individuals from Índia (South). Indian J Dermatol
Venereol Leprol. 2012; 78 (3): 323-7.
2. Schwebke JR, Hobbs MM, Taylor SN, Sena AC, Catania MG, Weinbaum BS, Johnson
AD, Getman DK, Gaydos CA. Molecular testing for Trichomonas vaginalis in women:
results from a prospective U.S. clinical trial. J Clin Microbiol. 2011; 49 (12): 4106-11.
3. Ertabaklar H, Caner A, Doskaya M, Demirtas LO, Toz SO, Ertug S, Guruz Y.
Comparison of polymerase chain reaction with wet mount and culture methods for the
diagnosis of trichomoniasis. Turkiye Parazitol Derg. 2011; 35 (1): 1-5.
4. Zaki ES, Raafat D, Emshaty E, Azab MS, Goda H. Correlation of Trichomonas vaginalis
to bacterial vaginosis: a laboratory-based study. J Infect Dev Ctries. 2010; 4 (3): 156-63.
5. Girardet RG, Lahoti S, Howard LA, Fajman NN, Sawyer MK, Driebe EM, Lee F,
Sautter RL, Greenwald E, Beck-Saqué CM, Hammerschlaq MR, Black CM. Epidemiology
of sexually transmitted infections in suspected child victims of sexual assault. Pediatrics
2009; 124 (1): 79-86.
6. Torok MR, Miller WC, Hobbs MM, Macdonald PD, Leone PA, Schwebke JR, Seña AC.
The association between oral contraceptives, depot-medroxyprogesterone acetate, and
trichomoniasis. Sex Transm Dis. 2009; 36 (6): 336-40.
7. Loo SK, Tang WY, Lo KK. Clinical significance of Trichomonas vaginalis detected in
Papanicolaou smear: a survey in female Social Hygiene Clinic. Hong Kong Med J. 2009;
15 (2): 90-3.
8. Pattullo L, Griffeth S, Ding L, Mortensen J, Reed J, Kahn J, Huppert J. Stepwise
diagnosis of Trichomonas vaginalis infection in adolescent women. J Clin Microbiol. 2009;
47 (1): 59-63.
9. Bravo RS, Giraldo PC, Carvalho NS, Gabiatti JRE, Val ICC, Giraldo HPD Passos MDL.
Tricomoníase Vaginal: o que se Passa? DST – J Bras Doenças Sex Transm. 2010; 22 (2):
73-80.
10. Carli GA. Trichomonas. In: Neves DP. Parasitologia Humana. 10.ed. São Paulo:
Atheneu; 2000. p. 101-6.
11. Junior MFQS, Siqueira LFG. Tricomoníase. In: Cimerman B, Cimerman S.
Parasitologia humana e seus fundamentos gerais. 2.ed. São Paulo: Atheneu; 2001. p. 34-8.
12. Parasitologia Médica. In: Ravel R. Laboratório Clínico aplicações Clínicas dos Dados
Laboratoriais. 6.ed. Rio de Janeiro: Guanabara Koogan, 1997. p.250-8.
43