Aula 3 - Isolamento de células de retina de embrião de pinto.
Variados tipos de células (vegetais e animais) e organismos são actualmente utilizados
como modelos experimentais para estudar diferentes aspectos da biologia celular e
molecular. Uma vez que as características fundamentais de todas as células foram sendo
conservadas ao longo da evolução, os princípios básicos retirados de experiências
realizadas com um tipo de células são muitas vezes aplicáveis a outros tipos de células.
As culturas de células (in vitro) têm um largo espectro de aplicação, estando na base de
uma grande variedade de estudos, permitindo, por exemplo, o estudo do crescimento e
diferenciação celular e, inclusivamente, a manipulação genética de forma a
compreender a função e a estrutura de um determinado gene. Uma das maiores
vantagens da utilização de culturas celulares é o facto de se poder controlar mais
eficazmente o ambiente experimental. De forma a preservar mais informação sobre cada
tipo individual de célula desenvolveram-se métodos de dissociar as células dos tecidos e
separar os vários tipos celulares. O resultado desta dissociação, uma população celular
homogénea, pode ser então analisado directamente ou após o número de células ser
aumentado através da sua proliferação em cultura. O primeiro passo para se isolarem
células animais de um único tipo é romper a matriz extracelular e as junções
intercelulares que mantêm as células juntas. Quando se querem isolar células sem
capacidade proliferativa, como os neurónios, normalmente recorre-se a tecido fetal,
embrionário ou neo-natal. Podem-se também isolar células com capacidade proliferativa
provenientes de tecido adulto ou de tecido tumoral. O isolamento celular é feito através
do tratamento com enzimas proteolíticas (ex. tripsina ou colagenase) e/ou com agentes
que ligam cálcio (EDTA), necessário
para a adesão entre as células. Após o
isolamento, realizado em condições
assépticas de forma a minorar as
contaminações microbiológicas, as
células são mantidas em caixas ou
frascos de plástico especiais para
culturas, contendo meio de cultura
com os nutrientes necessários, numa
incubadora a 37ºC com 95% humidade e 5% CO2.
As culturas celulares que se estabelecem inicialmente a partir de um tecido são
denominadas culturas primárias. Normalmente, células com capacidade de divisão
crescem até cobrirem toda a superfície do frasco ou caixa. Algumas células da cultura
primária podem então ser colocadas numa densidade mais baixa em novos frascos de
cultura estabelecendo culturas secundárias ou culturas filhas.
Este processo pode ser repetido várias vezes mas, de uma maneira geral, não
indefinidamente. De facto, a partir de
determinado
número
de
divisões,
dependendo do tipo de células, as
células
acabam
por
morrer.
Por
exemplo, fibroblastos humanos normais
podem ser cultivados cerca de 50 vezes
a partir de uma cultura primária. No
entanto, células retiradas de tumores ou
células modificadas através de vírus
podem proliferar de forma indefinida em
cultura, sendo referidas como linhas
celulares imortais. Este tipo de linhas é
bastante útil em diferentes tipos de
experiências uma vez que providenciam
uma fonte de células de forma contínua
e uniforme, podendo ser manipuladas,
clonadas e propagadas indefenidamente
no laboratório.
1
2
3
4
Câmara de contagem , Câmara de NeuBauer ou Hemocitómetro
Isolamento de Células da Retina de Embrião de Pinto - Protocolo
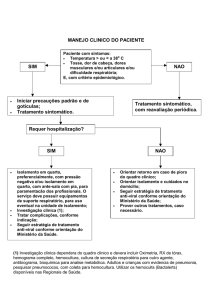
Na aula prática ir-se-á proceder ao isolamento de células de retina a partir de embriões
de pinto, com o objectivo de estabelecer uma cultura celular primária. O isolamento das
células de retina de pinto deve ser feito em condições assépticas numa câmara de fluxo
laminar (ver figura).
A. Material
- Ovos de galinha com 8 dias de incubação a 38,5 ºC, 70% humidade
- Caixas de Petri
- Multi-wells revestidas com poli-L-lisina 0,1 %
- Pinças
B. Soluções
- BME – Meio basal de Eagle com 20 mM de Hepes e 1 mM NaHCO3, suplementado
com 5% de soro fetal bovino, penicilina (100 U/ml) e estreptomicina (100 µg/ml)
- Meio de isolamento – Meio de Hanks sem Ca2+ nem Mg2+ (NaCl 137 mM, KCl 4,4
mM, KH2PO4 0,34 mM, NaHCO3 4 mM, glicose 5 mM, pH 7,4)
- 0,1 % de tripsina em meio de isolamento
C. Procedimento
- Aquecer os meios a 37º C e preparar a solução de tripsina
- Preparar as caixas de Petri com Meio de Isolamento
- Passar os ovos por álcool, partindo-os com a tesoura pela parte mais larga
- Remover o embrião para uma caixa de Petri, separar os olhos e retirar o tecido em
volta destes
- Retirar o humor aquoso ou cristalino e o humor vítreo
- Separar a retina do epitélio pigmentado
- Colocar as retinas num tubo de falcon com tripsina em Meio de isolamento (0,1
%)
- Incubar a 37º C durante 15 minutos
- Centrifugar a 800 rpm durante 1 min
- Ressuspender as células em Meio de Cultura e aspirar com uma pipeta
repetidamente para as dissociar.
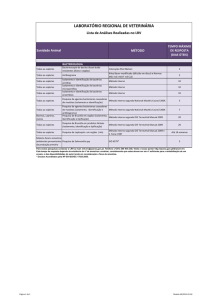
Contagem das células (exemplo):
- Retirar 25 µl da suspensão celular e diluir 5x com azul de tripã.
- Colocar a suspensão numa câmara de contagem (ver figura) e contar as células.
- Colocar o nº de células desejado em multi-wells revestidas com poli-L-lisina.
Exemplo:
Quadrado 1 - 50 células viáveis
Quadrado 2 - 45 células viáveis
Quadrado 3 - 52 células viáveis
Média: 50,75 células
Quadrado 4 - 56 células viáveis
[ ] suspensão celular: 50,75 x factor de diluição x 104 células/ml
50,75 x 5 x 104 células = 2, 54 x 106 células/ml de
suspensão