1º Teste - 2º Período
Correcção
1
Questão - 1
1.
Das afirmações seguintes indica
verdadeiras e falsas e corrige as falsas.
as
Os corpúsculos constituintes da matéria são todos
iguais, independentemente da substância. F
Cada substância é constituída por um determinado
tipo de corpúsculos
2
Questão - 1
1.
Das afirmações seguintes indica
verdadeiras e falsas e corrige as falsas.
as
Quando diminuímos o volume de um recipiente
fechado que contém um gás, a pressão diminui. F
Se diminuirmos o volume de um recipiente com um
gás, a pressão aumenta
3
Questão - 1
1.
Das afirmações seguintes indica
verdadeiras e falsas e corrige as falsas.
as
Os átomos são partículas indivisíveis. F
Os átomos dividem-se em electrões e núcleo com
protões e neutrões
4
Questão - 1
1.
Das afirmações seguintes indica
verdadeiras e falsas e corrige as falsas.
as
Uma substância elementar pode ser constituída por
moléculas. V
5
Questão - 1
1.
Das afirmações seguintes indica
verdadeiras e falsas e corrige as falsas.
as
No estado sólido os corpúsculos encontram-se muito
afastados, sendo a sua liberdade de movimento muito
grande. F
No estado gasoso os corpúsculos encontram-se muito
afastados, sendo a sua liberdade de movimento muito
grande
6
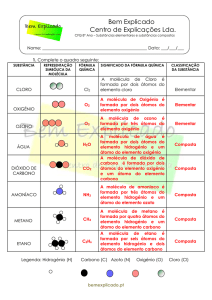
Questão - 2
2. Observa a organização e a separação dos
corpúsculos nos diagramas da figura 1.
Indica o estado físico que corresponde a cada um dos
diagramas.
(A) Líquido
(B) Sólido
(C) Gasoso
7
Questão - 3
3.1. Nas 3 seringas seguintes existe a mesma
quantidade de gás.
Ordena-as por ordem crescente de pressão do gás
exercida nas suas paredes.
C<A<B
8
Questão - 4
4. O berílio (Be) sólido reage com o ácido clorídrico
aquoso (HCl). Forma-se uma solução aquosa
(BeCl2) e um gás, o hidrogénio (H2).
4.1 Escreve a equação química que traduz a
reacção.
Be (s) + 2HCl (aq) → BeCl2 (aq) + H2 (g)
9
Questão - 4
4. O berílio (Be) sólido reage com o ácido clorídrico
aquoso (HCl). Forma-se uma solução aquosa
(BeCl2) e um gás, o hidrogénio (H2).
4.2 Refere factos que permitam identificar a
ocorrência de uma reacção química.
Consome-se a substância sólida.
Libertação de um gás
10
Questão - 5
5. Considera as seguintes equações químicas.
Al (s) + BaO (aq) → Ba (s) + Al2O3 (aq)
S8 (s) + O2 (g) → SO2 (g)
SO2 (g) + O2 (g) → SO3(g)
5.1 Acerta-as de forma a representarem reacções
químicas.
2Al (s) + 3BaO (aq) → 3Ba (s) + Al2O3 (aq)
S8 (s) + 8O2 (g) → 8SO2 (g)
2SO2 (g) + O2 (g) → 2SO3(g)
11
Questão - 5
5. Considera as seguintes equações químicas.
Al (s) + BaO (aq) → Ba (s) + Al2O3 (aq)
S8 (s) + O2 (g) → SO2 (g)
SO2 (g) + O2 (g) → SO3(g)
5.2 Escreve por palavras a reacção química
representada pela primeira equação química.
2 átomos de alumínio reagem com 3 moléculas de
óxido de bário e dão origem a 3 átomos de bário e
óxido de alumínio
12
Questão - 6
6.1 Observa o diagrama representado na figura 3
(1) Quantas moléculas estão
representadas neste diagrama?
5
(2) Quantos tipos de átomos
constituem cada uma destas
moléculas ?
2
(3) Quantos átomos
constituem cada molécula ?
4
13
6.2
Questão - 6
Indica, justificando se o diagrama representa uma
substância elementar ou composta.
14
Questão - 7
7. Descreve a composição qualitativa e quantitativa
de cada uma das seguintes moléculas:
15
Questão – 7 (I2)
I2 Uma molécula de Iodo é composta
por dois átomos de Iodo.
16
Questão – 7 (NO2)
NO2 Uma molécula de Dióxido de
Azoto é composta por átomos de Azoto e
átomos de Oxigénio.
Um átomo de Azoto e
dois átomos de Oxigénio.
17
Questão – 7 (C3H6O)
C3H6O Uma molécula de Acetona é
composta por átomos de Carbono,
Hidrogénio e Oxigénio.
Três átomo de Carbono,
seis átomos de Hidrogénio e
um átomo de Oxigénio.
18
Questão – 7 (H3PO4)
H3PO4 Uma molécula de Ácido
Fosfórico é composta por átomos de
Hidrogénio, Fosforo e Oxigénio.
Três átomo de Hidrogénio,
um átomo de Fósforo e
quatro átomos de Oxigénio.
19
Questão – 7 (CH4)
CH4 Uma molécula de Metano é
composta por átomos de Carbono e
Hidrogénio.
Um átomo de Carbono e
quatro átomos de Hidrogénio.
20
Questão - 8
8.Utilizando esferas de tamanhos diferentes, representa
(1) Dez átomos isolados de
uma substância elementar
(2) Cinco moléculas de uma
substância elementar
(3) Uma mistura constituída
por uma substância elementar
e uma substância composta
21
Questão - 9
9. Completa correctamente as seguintes frases,
preenchendo os espaços vazios:
átomos
– As unidades estruturais da matéria podem ser
__________
moléculas
iões
_______________ e _______________.
– Os iões são partículas com cargaeléctrica
_______________ e
átomo
podem ser constituídos por um só _______________
ou
um
conjunto
por
_______________
de átomos.
catiões
– Os iões com carga eléctrica positiva chamam-se
________
e os iões com carga eléctrica negativa chamam-se
_______
aniões
22
Questão - 10
10. Representa simbolicamente:
10.1 O ião que resulta de um átomo de ferro
que perdeu 2 electrões
Fe2+
10.2 O ião que resulta de um grupo formado por
um átomo de oxigénio e um átomo de hidrogénio
que captou 1 electrão.
OH- ou HO-
23
Questão - 11
11. Considera a seguinte tabela de iões:
Ião
Fórmula Ião
Iodeto
Óxido
Fosfato
Cloreto
Sulfato
Carbonato
Dicromato
Nitrato
IO2(PO4)3Cl(SO4)2(CO3)2(Cr2O7)2(NO3)-
Prata
Sódio
Potássio
Amónio
Cálcio
Zinco
Magnésio
Alumínio
Fórmula
Ag+
Na+
K+
(NH4)+
Ca2+
Zn2+
Mg2+
Al3+
24
Questão - 11
11.1 Escreve a fórmula química que representa
as seguintes substâncias iónicas:
Fosfato de sódio _________________Na3PO4
Cloreto de sódio _________________NaCl
Sulfato de alumínio _______________Al2(SO4)3
25
Questão - 11
11.2 Escreve os nomes dos seguintes compostos
iónicos
ZnCO3 _________________ Carbonato de zinco
NH4I ___________________ Iodeto de amónio
MgCr2O7 ________________ Dicromato de magnésio
26
2º Teste - 2º Período
Bom
Estudo
27