Por convecção: faz o transporte de energia através
da movimentação da matéria. Como há
movimentação da matéria, ocorre apenas em fluídos
quer sejam líquidos ou gases.
Este movimento origina pela variação da densidade
do fluído. Quando ele esfria, por dilatação seu
volume diminui e assim sua densidade aumenta
(d = m / V) e quando esquenta, ocorre o inverso, o
volume aumenta e a densidade diminui. Sabemos
que os fluídos menos densos ficam por cima dos
TERMOLOGIA
mais densos. Assim, quando a densidade muda, o
fluído tende a subir ou descer, dependendo se ele foi
Calorimetria:
aquecido ou resfriado.
Exemplo: Cozimento de legumes em uma panela
Calor: é energia térmica em trânsito. Ela ocorre
com água. Geladeira e Freezer. Brisa marinha. Ar
sempre entre dois corpos com temperaturas diferentes. condicionado.
O corpo com temperatura maior sede
espontaneamente calor para o corpo que tem a
Garrafa Térmica:
temperatura menor.
Calor: é uma sensação térmica.
Ela isola termicamente os fluídos
FORMAS DE PROPAGAÇÃO DE CALOR:
Por contato ou condução: é a troca de calor através
do contato entre as moléculas. Ocorre sempre entre
um meio material. É uma energia que se propaga. Os
corpos não se deslocam. O que ocorre é uma maior
agitação das moléculas.
Em geral, corpos maciços são melhores condutores de
calor, pois suas moléculas estão mais próximas e
corpos porosos são maus condutores de calor devido a
falta de aproximação de suas moléculas. Neste caso
dizemos que é um bom isolante térmico. O ideal é o
vácuo.
Exemplo: Uma colher deixada em uma panela com
água no fogão ligado. Se for de metal, propaga calor
rapidamente. Se for de madeira, demora mais o seu
aquecimento.
colocados no interior da seguinte forma:
- Para não ter condução, entre o bulbo de
vidro e a estrutura de fora o ambiente é o
vácuo, que não conduz calor entre
moléculas.
- Para não ter a radiação do calor, as
paredes internas são espelhadas, refletindo
estas ondas eletromagnéticas.
- Para não ter convecção, a tampa impede
que o ar em contato com o líquido se
movimente retirando ou trazendo calor.
Quantidade de Calor (energia térmica em trânsito):
Sensível: Ocorre quando há mudança de
temperatura, mas sem mudar o estado físico.
QS = quantidade de calor sensível
QS m.c. (cal)
m = massa (g)
c = calor específico (cal/gºC)
C m.c
C = capacidade térmica (cal/ºC)
(usado em CALORÍMETRO)
Por irradiação: não há necessidade de um meio
QS C.
= variação de temperatura (ºC)
material para se realizar e só há transporte de energia e
final inicial
não de matéria. Ocorre através das ondas
eletromagnéticas, também conhecidas como ondas de
caloríficas ou calor radiante, onde predominam os
raios infravermelhos.
Exemplo: Raio de luz do Sol que faz o bronzeamento
das pessoas ou aquecem o interior dos carros.
Também as lâmpadas incandescentes.
Latente: Ocorre quando há mudança no estado
físico, mas sem mudar a temperatura.
QL = quantidade de calor latente (cal)
QL m.L m = massa (g)
L = calor latente (cal/g)
www.nsaulasparticulares.com.br – Prof. Nilton Sihel – Tel.: 3825-2628 / 9.4737-7909 Pág. 1
Gráfico da quantidade de
calor:
Constantes
usadas nos
cálculos:
cágua = 1 cal/gºC
EQUILÍBRIO TÉRMICO:
Q cedido + Q absorvido = 0
Q1 + Q2 + Q3 + . . . + Qn = 0
cgelo = 0,5 cal/gºC
cvapor = 0,5 cal/gºC
Gráfico de equilíbrio térmico:
Lfusão = 80 cal/g
De 0 a Q1: Calor sensível,
Estado sólido
Lsolidificação = -80 cal/g
De Q1 a Q2: Calor latente, Fusão Lvaporização = 540 cal/g
De Q2 a Q3: Calor sensível,
Estado líquido
Lcondensação = -540 cal/g
De Q3 a Q4: Calor latente,
Evaporação
Acima de Q4: Calor sensível,
Estado de Vapor
Q1 + Q2 + Q3 + Q4 = 0
Q1 e Q3 = Calor sensível absorvido.
Q2 = Calor latente absorvido.
Q4 = Calor sensível cedido.
Fluxo de calor:
Q
tempo
K
A.(t maior t menor )
e
= fluxo de calor
(cal/s)
K = coeficiente de
condutibilidade térmica
(cal/s.cm.ºC)
A = área da secção
transversal (cm2)
t = temperatura (ºC)
e = espessura entre as
temperaturas (cm)
Potência térmica:
Pot
Q
tempo
Pot = Potência (cal/s;
cal/min; J/min; J/s = W)
1 cal 4,18 J
www.nsaulasparticulares.com.br – Prof. Nilton Sihel – Tel.: 3825-2628 / 9.4737-7909 Pág. 2
Resumo das Fórmulas de Calorimetria
QS m.c.t
C m.c
QS C.t
QS = quantidade de calor sensível (cal ou J)
Quando muda a temperatura, mas sem mudar o estado físico.
m = massa (g)
kg
g mg
g
c = calor específico (cal/goC)
C = capacidade térmica (cal/oC)
(calorímetro ideal = capacidade térmica desprezível = C = zero)
QL m.L
t = variação de temperatura (oC)
t t final tinicial
Q
Pot
tempo
Obs.: Variação da temperatura celsius é igual a kelvin
tC = tK
QL = quantidade de calor latente (cal ou J)
1 cal 4,2 J
Quando muda o estado físico, mas sem mudar a temperatura.
L = calor latente (cal/g)
Observação:
1 litro de água
é igual a
1 kg de água
Pot = Potência (cal/s; cal/min; J/min; J/s = W)
EQUILÍBRIO TÉRMICO:
1 m de água
é igual a
1 g de água
Q cedido + Q absorvido = 0
Q1 + Q2 + Q3 + . . . + Qn = 0
www.nsaulasparticulares.com.br – Prof. Nilton Sihel – Tel.: 3825-2628 / 9.4737-7909 Pág. 3
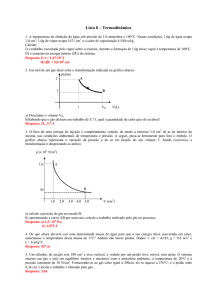
Exercícios de aplicação
1) Um bloco de gelo de massa 100g, na temperatura inicial de – 20ºC é aquecido até
virar vapor na temperatura de 150ºC. Pede-se:
a) Construa um esboço da curva de aquecimento indicando onde ocorre a
quantidade de calor sensível, a quantidade de calor latente, onde é gelo, água, vapor e as
transformações em que ocorrem a fusão e a vaporização.
b) Calcule a quantidade de calor total fornecida a este bloco em cal.
c) Se a fonte de calor fornece uma quantidade de 50cal/s, quanto tempo levará
este aquecimento?
d) Calcule a quantidade de calor fornecida em joules.
e) Calcule a potência térmica em W.
Dados:
cgelo = cvapor = 0,5cal/goC
cágua = 1,0cal/goC
Lfusão do gelo = 80cal/g
Lvaporização da água = 540cal/g
1 cal 4,2 J
Resp.: a) Construir o gráfico de Q x t; b) 75.500cal; c) 1510s = 25min10 s;
d) 317.100J; e) 210W
www.nsaulasparticulares.com.br – Prof. Nilton Sihel – Tel.: 3825-2628 / 9.4737-7909 Pág. 4
2) Em um recipiente de capacidade térmica desprezível, tem 400g de água na
temperatura de 80ºC. Ao se colocar mais 200g de água na temperatura de 20ºC, qual
será a temperatura de equilíbrio dos 600g de água? Faça a representação gráfica.
Dado:
cágua = 1,0cal/goC
Resp.: 60ºC
3) Em um recipiente de capacidade térmica desprezível, tem 400g de água na
temperatura de 80ºC. Coloca no recipiente um bloco de 50g de gelo na temperatura de
-20ºC. Calcule a temperatura de equilíbrio térmico. Faça a representação gráfica.
Dados:
cgelo = 0,5cal/goC
cágua = 1,0cal/goC
Lfusão do gelo = 80cal/g
Resp.: 61,1 ºC
www.nsaulasparticulares.com.br – Prof. Nilton Sihel – Tel.: 3825-2628 / 9.4737-7909 Pág. 5
4) Em um recipiente de capacidade térmica 20cal/ºC, tem 400g de água na temperatura
de 80ºC. Coloca no recipiente um bloco de 50g de gelo na temperatura de -20ºC.
Calcule a temperatura de equilíbrio térmico. Faça a representação gráfica.
Dados:
cgelo = 0,5cal/goC
cágua = 1,0cal/goC
Lfusão do gelo = 80cal/g
Resp.: 61,9ºC
5) Em um recipiente de capacidade térmica desprezível, tem 200g de água na
temperatura de 80ºC. Coloca no recipiente um bloco de 200g de gelo na temperatura de
-20ºC. Calcule:
a) A temperatura de equilíbrio térmico.
b) A massa de gelo que derreteu.
c) A massa de água que sobrou no final do processo.
d) Faça a representação gráfica.
Dados:
cgelo = 0,5cal/goC
cágua = 1,0cal/goC
Lfusão do gelo = 80cal/g
Resp.: a) 0ºC
b) 150g
c) 350g
d) desenhar
www.nsaulasparticulares.com.br – Prof. Nilton Sihel – Tel.: 3825-2628 / 9.4737-7909 Pág. 6