O ciclo de Krebs ou do ácido cítrico; Rui Fontes
O ciclo de Krebs ou do ácido cítrico
Índice
1-
O ciclo de Krebs é uma via metabólica central no metabolismo oxidativo de todos os nutrientes ..............1
2-
As enzimas envolvidas nas reações do ciclo de Krebs e a sequência de conversões ...................................1
3- A ação sequenciada da isoenzima da sintétase de succinil-CoA que tem como substrato o GDP e da
cínase de nucleosídeos difosfato permite a síntese de ATP “ao nível do substrato” ............................................2
4- A ação das desidrogénases do ciclo de Krebs e a reoxidação do NADH e do FADH2 pelo oxigénio na
cadeia respiratória .................................................................................................................................................3
5- A oxidação do resíduo acetilo do acetil-CoA e a cisão da ligação tioéster presente no acetil-CoA são
processos exergónicos ..........................................................................................................................................3
6- Na oxidação do resíduo acetilo do acetil-CoA não há, no balanço final, nem consumo nem formação de
intermediários do ciclo de Krebs ..........................................................................................................................3
7-
O papel do ião Ca2+ na ativação da oxidação do acetil-CoA nas fibras musculares em contração ..............4
8-
Aumentar a ingestão de nutrientes não aumenta a velocidade da sua oxidação ...........................................4
9-
A participação das enzimas do ciclo de Krebs em processos anabólicos .....................................................4
10-
Definição de processos catapleróticos e de processos anapleróticos ........................................................4
11-
Na gliconeogénese há consumo de oxalacetato mitocondrial, um processo que é cataplerótico .............5
12-
Na gliconeogénese há formação de intermediários do ciclo de Krebs (processos anapleróticos) ............5
13A reação catalisada pela síntase do citrato não é um processo anaplerótico nem cataplerótico e o acetilCoA não é substrato da gliconeogénese ...............................................................................................................5
14O acetil-CoA excedentário relativamente às necessidades energéticas pode, via citrato, sair das
mitocôndrias e ser usado na síntese de ácidos gordos ..........................................................................................6
15Os processos anapleróticos que compensam a saída de oxalacetato da mitocôndria durante a síntese
citoplasmática de ácidos gordos ...........................................................................................................................6
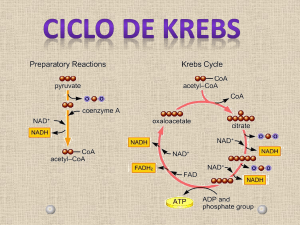
1- O ciclo de Krebs é uma via metabólica central no metabolismo oxidativo de todos os
nutrientes
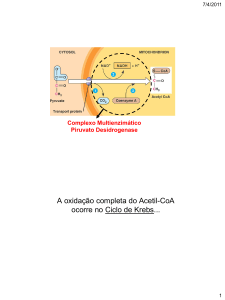
Por ação das enzimas da glicólise a glicose é, no citoplasma das células, oxidada a piruvato. O
piruvato entra para a mitocôndria e, através da ação catalítica da desidrogénase do piruvato, dá origem a
acetil-CoA (ver Equação 1).
Equação 1
piruvato + NAD+ + CoA → acetil-CoA + NADH + CO2
No catabolismo dos aminoácidos, dos ácidos gordos e do etanol também se forma acetil-CoA. O
ciclo de Krebs (também designado por ciclo do citrato ou dos ácidos tricarboxílicos) é uma via
metabólica central no metabolismo dos nutrientes pois permite a oxidação do grupo acetilo da acetilCoA (a CO2) com a concomitante redução do NAD+ e do FAD a NADH e FADH2 que são
intermediários no processo de redução do O2 (a H2O). A importância do ciclo de Krebs no metabolismo e
na sobrevivência dos seres vivos fica evidenciada pela extrema raridade das doenças congénitas em que
há defeitos na atividade de enzimas deste ciclo [1].
2- As enzimas envolvidas nas reações do ciclo de Krebs e a sequência de conversões
As enzimas envolvidas nas reações do ciclo de Krebs estão todas dentro da mitocôndria e são as
seguintes: síntase do citrato (Equação 2), aconitase (Equação 3), desidrogénase do isocitrato (Equação
4), desidrogénase do α-cetoglutarato (Equação 5), sintétase de succinil-CoA (Equação 6),
desidrogénase do succinato1 (Equação 7), fumárase (Equação 8) e desidrogénase do malato (Equação
1
A desidrogénase do succinato é, entre as enzimas “do ciclo de Krebs”, a única que está na membrana interna da
mitocôndria. Sendo constituída por várias subunidades é também conhecida como complexo II. O FAD não é o aceitador
Página 1 de 7
O ciclo de Krebs ou do ácido cítrico; Rui Fontes
9). A sintétase de succinil-CoA é o nome atribuído a duas isoenzimas distintas mas com atividades
semelhantes: uma tem maior afinidade para o GDP e leva à formação de GTP enquanto a outra tem maior
afinidade para o ADP e leva à formação direta de ATP.
Equação 2
Equação 3
Equação 4
Equação 5
Equação 6
Equação 7
Equação 8
Equação 9
acetil-CoA + oxalacetato + H2O → citrato + CoA
citrato ↔ isocitrato
isocitrato + NAD+ → α-cetoglutarato + CO2 + NADH
α-cetoglutarato + NAD+ + CoA → succinil-CoA + NADH + CO2
succinil-CoA + GDP (ou ADP) + Pi ↔ succinato + CoA + GTP (ou ATP)
succinato + FAD → fumarato + FADH2 (ver nota de rodapé nº 1)
fumarato + H2O ↔ malato
malato + NAD+ ↔ oxalacetato + NADH
Se ignorarmos momentaneamente a formação de NADH, FADH2, ATP (ou GTP), CO2 e CoA
poderemos escrever a seguinte sequência de transformações: oxalacetato [4C] (+ acetil-CoA [2C no
resíduo de acetato]) → citrato [6C] → isocitrato [6C] → α-cetoglutarato [5C] → succinil-CoA [4C no
resíduo de succinato]→ succinato [4C] → fumarato [4C] → malato [4C] → oxalacetato [4C]. O facto de
iniciarmos e terminarmos a listagem com o mesmo composto (o oxalacetato) evidencia o caráter cíclico
do processo.
A diminuição do número de carbonos nos passos isocitrato [6C] → α-cetoglutarato [5C] e αcetoglutarato [5C] → succinil-CoA [4C no resíduo de succinato] explica-se pela libertação simultânea de
CO2 (ver Equação 4 e Equação 5).
3- A ação sequenciada da isoenzima da sintétase de succinil-CoA que tem como substrato o
GDP e da cínase de nucleosídeos difosfato permite a síntese de ATP “ao nível do substrato”
A sintétase de succinil-CoA (Equação 6) existe na forma de duas isoenzimas. Uma das
isoenzimas tem maior especificidade para o ADP e a outra maior especificidade para o GDP mas, em
ambos os casos, a reação pode ser entendida como correspondendo à rotura de uma ligação “rica em
energia” e formação de outra ligação “rica em energia”. No sentido succinil-CoA → succinato rompe-se
uma ligação tioéster e forma-se uma ligação fosfoanidrido entre os fosfato β e γ; num dos casos do ATP e
no outro do GTP.
No entanto, em última análise, se também considerarmos a atividade da cínase dos nucleosídeos
difosfato (ver Equação 10) pode admitir-se que, na célula, o que se forma é ATP. Esta cínase não é,
tradicionalmente, considerada uma enzima do ciclo de Krebs, mas tem um papel importante neste
contexto já que permite a transferência do fosfato terminal do GTP (formado pela ação de uma das
isoenzimas da sintétase do succinil-CoA) para o ADP e, consequentemente, a formação de ATP. Assim,
mesmo que se admita que, num dado órgão, a isoenzima com maior atividade é a que tem maior afinidade
para o GDP, o somatório da sua atividade (ver Equação 6; com GDP como substrato) com a da cínase dos
nucleosídeos difosfato (ver Equação 10) é a Equação 11. Por contraponto com a formação de ATP na
fosforilação oxidativa, a fosforilação do ADP (catalisada pela isoenzima que tem como substrato o ADP
ou pelo somatório das duas atividades atrás referidas) diz-se que ocorre “ao nível do substrato”.
Equação 10
Equação 11
GTP + ADP ↔ GDP + ATP
succinil-CoA + ADP + Pi ↔ succinato + CoA + ATP
último dos eletrões no processo catalisado pela desidrogénase do succinato mas sim o grupo prostético que aceita
diretamente os eletrões (ou os “hidrogénios”) quando o succinato se oxida. Nas células, o aceitador último dos eletrões na
ação catalítica da desidrogénase do succinato é a ubiquinona (ou coenzima Q) mas, tradicionalmente, quando se discute o
ciclo de Krebs, aponta-se o FAD como o oxidante do succinato. Curiosamente, quando se discute o papel catalítico da
desidrogénase do succinato no contexto do estudo da fosforilação oxidativa já é a ubiquinona que é, tradicionalmente,
apontado como o oxidante. Uma visão global da atividade catalítica da enzima permite compreender que a redução da
ubiquinona (a ubiquinol) pelo FADH2 também faz parte da sua atividade global e que a esta é melhor expressa pela
equação seguinte:
succinato + ubiquinona (ou coenzima Q) → fumarato + ubiquinol (ou coenzima QH2).
Estas idiossincrasias têm origem na história da investigação da desidrogénase do succinato e das vias metabólicas onde
pode ser integrada.
Página 2 de 7
O ciclo de Krebs ou do ácido cítrico; Rui Fontes
4- A ação das desidrogénases do ciclo de Krebs e a reoxidação do NADH e do FADH2 pelo
oxigénio na cadeia respiratória
A “fase preparatória” da oxidação do grupo acetilo da acetil-CoA a CO2 começa com a sua
ligação ao oxalacetato por ação da síntase do citrato.
Os passos oxidativos em que ocorre a redução do NAD+ e do FAD são os catalisados pelas
desidrogénases do isocitrato, do α-cetoglutarato, do malato (NAD+ a NADH) e do succinato (FAD a
FADH2). O NAD+ existe nas células em concentrações de ordem µM e a oxidação da glicose, dos ácidos
gordos e dos aminoácidos (que são ingeridos em quantidades de alguns moles por dia) só pode ocorrer se
o NADH formado aquando das reações expressas pela Equações 4, 5 e 9 for imediatamente reoxidado a
NAD+. Algo de muito semelhante pode ser dito do FAD com a particularidade de o FAD ser um dos
grupos prostéticos da desidrogénase do succinato (ver nota de rodapé nº 1). A regeneração do NAD+ e do
FAD é indispensável para que o processo oxidativo possa prosseguir e, na mitocôndria, o único processo
que permite reoxidar o NADH e o FADH2 é desempenhado pelos complexos da cadeia respiratória sendo
que o oxidante final é o O2: ao contrário do que acontece no caso da glicólise não existe “ciclo de
Krebs anaeróbico”.
As descarboxilações (libertação de CO2) ocorrem durante as ações catalíticas da desidrogénase
do isocitrato (ver Equação 4) e da desidrogénase do α-cetoglutarato (ver Equação 5) e, tal como no caso
da desidrogénase do piruvato (ver Equação 1), as reações que estas duas desidrogénases catalisam são
frequentemente referidas como oxidações-descarboxilativas. Juntamente com a desidrogénase do
piruvato, as desidrogénases do isocitrato e do α-cetoglutarato são responsáveis pela esmagadora maioria
das moléculas de CO2 que os animais produzem.
5- A oxidação do resíduo acetilo do acetil-CoA e a cisão da ligação tioéster presente no acetilCoA são processos exergónicos
A Equação 12 descreve o somatório das reações que constituem o ciclo de Krebs (Equações 2-9)
e a catalisada pela cínase dos nucleosídeos difosfato (Equação 10):
Equação 12
CH3CO-CoA + 2 H2O + 3 NAD+ + FAD + ADP + Pi →
2 CO2 + CoA + 3 NADH + FADH2 + ATP
Esta equação mostra que, conceptualmente, a ação do conjunto das enzimas referidas pode ser
entendida como um somatório de três processos: (12a) a hidrólise da acetil-CoA, (12b) a oxidação do
resíduo de acetato a CO2 com a concomitante redução do FAD e do NAD+ e (12c) a síntese de ATP “a
nível do substrato” (a partir de ADP + Pi).
Equação 12a
Equação 12b
Equação 12c
CH3CO-CoA + H2O → CoA + CH3COOH
CH3COOH + 2 H2O + 3 NAD+ + FAD → 2 CO2 + 3 NADH + FADH2
ADP + Pi → ATP + H2O
Os processos 12a e 12b são exergónicos enquanto o 12c é endergónico e só ocorre porque está
acoplado com os dois primeiros. Vistos como um todo, o somatório das reações é, obviamente, um
processo exergónico; de contrário, a reação expressa pela Equação 12 não poderia ocorrer no sentido
indicado.
6- Na oxidação do resíduo acetilo do acetil-CoA não há, no balanço final, nem consumo nem
formação de intermediários do ciclo de Krebs
Em todos os tecidos e, particularmente, nos músculos, o principal papel das enzimas do ciclo de
Krebs é, tal como indica a Equação 12, catalisar a oxidação completa do grupo acetilo do acetil-CoA
formado durante o catabolismo da glicose, ácidos gordos e aminoácidos. Nas reações em que intervêm
catalisadores, porque estes não se consomem nem se formam durante o processo reativo, o catalisador não
aparece na equação final. O mesmo acontece no caso dos intermediários do ciclo de Krebs: quando se
somam as equações que expressam a atividade de cada uma das enzimas os intermediários desaparecem
da equação. Em cada uma das reações um intermediário converte-se no seguinte e o “último” (o
oxalacetato) converte-se no “primeiro” (o citrato). Por isso, não é de estranhar que seja costume dizer-se
que, no processo de oxidação do grupo acetilo da acetil-CoA, os intermediários do ciclo de Krebs têm
um papel catalítico.
Página 3 de 7
O ciclo de Krebs ou do ácido cítrico; Rui Fontes
7- O papel do ião Ca2+ na ativação da oxidação do acetil-CoA nas fibras musculares em
contração
Se ignorarmos a fração de glicose que se converte em lactato (glicólise anaeróbica), a velocidade
das reações catalisadas pelas enzimas do ciclo de Krebs é proporcional ao gasto de ATP. Por exemplo, a
velocidade com que ocorrem as reações do ciclo de Krebs (a oxidação do acetil-CoA a CO2) nas
fibras musculares aumenta quando, durante o exercício físico, aumenta a velocidade de hidrólise do
ATP. As enzimas que catalisam reações fisiologicamente irreversíveis são as catalisadas pela síntase do
citrato e pelas desidrogénases do isocitrato e do α-cetoglutarato. Estas enzimas são, in vitro, inibidas
pelo ATP e estimuladas pelo ADP; dado que o esforço muscular implica aumento da velocidade da
hidrólise do ATP (atividade das ATPases da actina-miosina, do Ca2+ e do Na+/K+) pensou-se durante
muito tempo que ocorria diminuição da concentração de ATP e aumento da de ADP durante o trabalho
muscular e que essas variações de concentração fossem a causa direta da ativação destas enzimas e do
ciclo de Krebs no seu conjunto. Contudo, in vivo, as variações de concentração do ATP (mesmo quando o
trabalho muscular é violento) são praticamente nulas e as do ADP são modestas; por isso crê-se,
atualmente, que o marcado aumento da atividade das enzimas do ciclo de Krebs e o consequente aumento
de produção de CO2 durante o esforço muscular só, em parte, pode ser explicado pelo aumento do ADP.
Pensa-se atualmente que um dos fatores responsáveis pelo aumento da produção de CO2 durante
o esforço poderá ser o ião Ca2+ que estimula as desidrogénases do isocitrato e do α-cetoglutarato
(ativação alostérica) e cuja concentração aumenta na célula (citoplasma e mitocôndria) durante a
atividade contráctil do músculo [2].
8- Aumentar a ingestão de nutrientes não aumenta a velocidade da sua oxidação
É de notar que a acetil-CoA não estimula a atividade das enzimas do ciclo de Krebs; ou seja,
não é de esperar que a ingestão aumentada de glicose ou ácidos gordos leve, por si só, a um aumento da
oxidação da acetil-CoA formada a partir dos nutrientes.
Os sistemas oxidativos e, em particular, o ciclo de Krebs têm velocidades que permitem manter a
concentração de ATP estacionária: só é possível aumentar a velocidade de oxidação da acetil-CoA (e, em
última análise, a da oxidação dos nutrientes) se aumentar a velocidade de hidrólise do ATP. Ou seja, a
velocidade de oxidação dos nutrientes aumenta quando um animal faz exercício físico mas aumentar a
ingestão de nutrientes não aumenta a velocidade da sua oxidação2.
9- A participação das enzimas do ciclo de Krebs em processos anabólicos
Para além do papel central no processo oxidativo dos nutrientes (catabolismo) as enzimas do ciclo
de Krebs também participam noutros processos metabólicos que podem ser vistos como anabólicos. Por
isso se costuma dizer que o ciclo de Krebs tem caráter anfibólico: os intermediários deste ciclo são
intermediários no catabolismo dos nutrientes, mas também podem ser intermediários em processos
anabólicos, como a síntese de ácidos gordos a partir de glicose (lipogénese), a síntese de glicose
(gliconeogénese) ou de glicerol-3-fosfato (gliceroneogénese) a partir de aminoácidos ou de lactato, a
síntese de alguns aminoácidos a partir de glicose assim como a síntese do heme da hemoglobina e de
outras proteínas hemínicas. O papel anabólico das enzimas do ciclo de Krebs tem particular relevância
nos casos do fígado, rim e tecido adiposo.
10- Definição de processos catapleróticos e de processos anapleróticos
Quando um intermediário do ciclo de Krebs é convertido num outro composto que não o é,
diz-se que o processo é cataplerótico [3, 4]. As reações catapleróticas tenderiam a “esvaziar” o ciclo de
Krebs, mas um processo cataplerótico não pode ocorrer sem que, a uma velocidade semelhante, um outro
composto que não é intermediário do ciclo de Krebs origine um intermediário do ciclo. Os processos
deste último tipo chamam-se anapleróticos.
É uma boa aproximação à realidade afirmar-se que os intermediários do ciclo de Krebs mantêm
concentrações estacionárias; em diferentes estados metabólicos, ou mesmo quando um músculo passa do
estado de repouso para o de trabalho mecânico, as concentrações dos intermediários do ciclo de Krebs
2
De facto, esta afirmação não é completamente verdadeira porque, quando se ingerem alimentos em excesso, ocorrem
fenómenos adaptativos que tendem a aumentar ligeiramente a velocidade de oxidação dos nutrientes. No entanto, é de
sublinhar que, num adulto, os nutrientes ingeridos que excedam os gastos energéticos de um dado indivíduo (nutrientes
não oxidados) acabam armazenados na forma de triacilgliceróis do tecido adiposo.
Página 4 de 7
O ciclo de Krebs ou do ácido cítrico; Rui Fontes
variam muito pouco [3-6]. Ou seja, sempre que há um processo cataplerótico há um outro anaplerótico
que o compensa e vice-versa.
11- Na gliconeogénese há consumo de oxalacetato mitocondrial, um processo que é
cataplerótico
O fígado e o rim formam glicose usando oxalacetato do citoplasma ou da mitocôndria como
percursores e ao processo chama-se gliconeogénese. A reação em que o oxalacetato se consome na
gliconeogénese é catalisada pela carboxicínase do fosfoenolpiruvato de que existem duas isoenzimas,
uma citoplasmática e outra mitocondrial; em ambos os casos o oxalacetato converte-se em
fosfoenolpiruvato (ver Equação 13). A quantidade total de oxalacetato num homem é de alguns
miligramas mas, na gliconeogénese, pode formar-se cerca de 100 g de glicose por dia [7]. O consumo de
oxalacetato citoplasmático é possível porque o oxalacetato citoplasmático é formado a partir de malato
(catálise pela desidrogénase do malato citoplasmática: ver Equação 9) que saiu da mitocôndria. O
consumo de oxalacetato mitocondrial (intermediário do ciclo de Krebs) via ação catalítica da
carboxicínase do fosfoenolpiruvato mitocondrial e a transformação de malato mitocondrial (também
intermediário do ciclo de Krebs) em oxalacetato citoplasmático são processos catapleróticos.
Equação 13
oxalacetato + GTP → fosfoenolpiruvato + GDP + CO2
12- Na gliconeogénese há formação de intermediários do ciclo de Krebs (processos
anapleróticos)
Os processos catapleróticos referidos acima só são sustentáveis porque durante a gliconeogénese
ocorrem simultaneamente processos anapleróticos que permitem formar intermediários do ciclo de Krebs.
Quando, num processo anaplerótico, se forma um qualquer intermediário do ciclo de Krebs, esse
intermediário pode, por ação das enzimas do ciclo de Krebs, substituir o malato ou o oxalacetato
mitocondriais que foram consumidos.
São exemplos de processos anapleróticos importantes durante a gliconeogénese:
(i) a conversão de lactato citoplasmático em oxalacetato mitocondrial [via ação sequenciada da
desidrogénase do lactato (ver Equação 14), do transporte de piruvato para a mitocôndria e da ação da
carboxílase do piruvato (uma enzima da matriz da mitocôndria, ver Equação 15)],
(ii) a conversão de glutamina, glutamato e outros aminoácidos em α-cetoglutarato mitocondrial e
(iii) a conversão de propionato em succinil-CoA mitocondrial.
Todas as substâncias que podem, direta ou indiretamente, ser substratos em processos
anapleróticos dizem-se também glicogénicas porque, no fígado e no rim, são substratos da
gliconeogénese. Para além dos processos já referidos, um exemplo de uma reação anaplerótica é a
catalisada pela desidrogénase do glutamato (ver Equação 16): nesta reação um aminoácido (o
glutamato) converte-se num intermediário do ciclo de Krebs (o α-cetoglutarato); o glutamato é, por isso,
um substrato da gliconeogénese.
Equação 14
Equação 15
Equação 16
lactato + NAD+ → piruvato + NADH
piruvato + CO2 + ATP → oxalacetato + ADP + Pi
glutamato + NAD+ → α-cetoglutarato + NADH + NH4+
13- A reação catalisada pela síntase do citrato não é um processo anaplerótico nem
cataplerótico e o acetil-CoA não é substrato da gliconeogénese
As reações catalisadas pela carboxílase do piruvato (ver Equação 15) ou pela desidrogénase do
glutamato (ver Equação 16) podem ser classificadas como processos anapleróticos porque nestas reações
há formação líquida de intermediários do ciclo de Krebs.
Pelo contrário, a análise atenta da reação catalisada pela síntase do citrato (ver Equação 2) mostra
que, nesta reação, não há formação líquida de intermediários do ciclo de Krebs. Na ação catalítica da
síntase do citrato, há um intermediário que se consome (o oxalacetato) e um outro que se forma (o citrato)
mas, em termos líquidos, se pensarmos nos intermediários do ciclo de Krebs como um todo, esta reação
não contribui, nem para a formação, nem para o consumo de intermediários. Por outras palavras: a reação
catalisada pela síntase do citrato não é um processo anaplerótico nem cataplerótico.
A síntase do citrato incorpora 2 carbonos do acetil-CoA no oxalacetato mas, não contribuindo
para a síntese de novas moléculas de intermediários, esta incorporação não pode sustentar o gasto de
Página 5 de 7
O ciclo de Krebs ou do ácido cítrico; Rui Fontes
oxalacetato que ocorre na gliconeogénese. Esta é uma das razões porque a acetil-CoA não pode ser
considerado um substrato da gliconeogénese.
Por outro lado, poderia pensar-se que a acetil-CoA poderia contribuir para a formação líquida de
intermediários do ciclo através de um outro caminho. Se admitíssemos que a reação catalisada pela
desidrogénase do piruvato (ver Equação 1) era reversível seria possível formar piruvato a partir de acetilCoA; de seguida, este piruvato poderia converter-se em oxalacetato (ver Equação 15) e teríamos, nesta
sequência, um processo anaplerótico com origem na acetil-CoA. No entanto, a reação catalisada pela
desidrogénase do piruvato é irreversível: ou seja, não é possível converter acetil-CoA em piruvato. Assim,
não existem processos anapleróticos com origem no acetil-CoA e, por isso, o acetil-CoA não pode
ser considerada um substrato da gliconeogénese.
14- O acetil-CoA excedentário relativamente às necessidades energéticas pode, via citrato, sair
das mitocôndrias e ser usado na síntese de ácidos gordos
A esmagadora maioria dos ácidos gordos, quer os da dieta quer os que fazem parte da estrutura
dos lipídeos dos seres vivos, contém um número par de carbonos. Estes ácidos gordos geram, no seu
catabolismo, apenas acetil-CoA e não podem, portanto, contribuir para a formação de glicose: os ácidos
gordos de cadeia par não são glicogénicos.
Pelo contrário, a glicose pode dar origem a ácidos gordos cuja síntese ocorre no citoplasma dos
hepatócitos e dos adipócitos partindo de acetil-CoA (lipogénese). A acetil-CoA excedentária
relativamente às necessidades energéticas da célula não pode ser oxidada a CO2 no ciclo de Krebs mas
pode, pelo menos no fígado e no tecido adiposo, ser convertida em ácidos gordos no citoplasma das
células.
No entanto, a acetil-CoA não pode atravessar a membrana mitocondrial porque não existe
transportador para esta substância. O mecanismo que permite, de forma indireta, transportar acetil-CoA
para o citoplasma é complexo e envolve as atividades catalíticas da síntase do citrato dentro da
mitocôndria (ver Equação 2), do transportador de citrato existente na membrana interna da mitocôndria
(ver Equação 17) e, já no citoplasma, da líase do ATP-citrato (ver Equação 18).
Equação 17
Equação 18
citrato mitocondrial → citrato citoplasmático
ATP + citrato + CoA → oxalacetato + ADP + Pi + acetil-CoA
O somatório das Equações 2, 17 e 18 (ver Equação 19) mostra que o transporte de acetil-CoA
ocorre à custa do gasto de uma “ligação rica em energia” do ATP:
Equação 19
acetil-CoA (mit.) + oxalacetato (mit.) + ATP + H2O →
acetil-CoA (cit.) + oxalacetato (cit.) + ADP + Pi
15- Os processos anapleróticos que compensam a saída de oxalacetato da mitocôndria durante
a síntese citoplasmática de ácidos gordos
Quer se considere a saída do citrato da matriz da mitocôndria (ver Equação 17), quer o processo
global descrito pela Equação 19, há aqui um processo cataplerótico que não seria sustentável sem
processos anapleróticos que o complementem. Porque não existe, na membrana interna da mitocôndria,
transportador para o oxalacetato, o regresso do oxalacetato citoplasmático à matriz mitocondrial é
indireto.
Uma das vias possíveis para este regresso envolve a redução do oxalacetato a malato no
citoplasma (via desidrogénase do malato; ver Equação 9), o transporte do malato formado para a matriz
da mitocôndria e a sua reoxidação a oxalacetato pela ação da desidrogénase do malato mitocondrial.
Uma outra via que também acaba na formação de oxalacetato mitocondrial é mais complexa.
Nesta via o malato formado no citoplasma que não entrou diretamente na mitocôndria vai ser oxidado (e
descarboxilado) a piruvato por ação de uma enzima citoplasmática frequentemente designada por enzima
málica (ver Equação 20); de seguida o piruvato entra para a mitocôndria e, por ação da carboxílase do
piruvato (ver Equação 15), converte-se em oxalacetato. Estes processos são anapleróticos e permitem
entender que a saída de acetil-CoA da mitocôndria (ver Equação 19) seja sustentável.
Equação 20
malato + NADP+ → piruvato + NADPH + CO2
Página 6 de 7
O ciclo de Krebs ou do ácido cítrico; Rui Fontes
Sendo o acetil-CoA citoplasmático um substrato para a formação endógena de ácidos gordos pode
afirmar-se que a fração da glicose ingerida que não é oxidada contribui para a formação dos
triacilgliceróis que formam as gotículas de gordura dos adipócitos e de outras células do organismo. No
entanto, o contrário não é verdadeiro: a maioria dos ácidos gordos que ingerimos são de cadeia par e, no
seu catabolismo, geram acetil-CoA que não pode converter-se em glicose.
1. Rustin, P., Bourgeron, T., Parfait, B., Chretien, D., Munnich, A. & Rotig, A. (1997) Inborn errors of the Krebs cycle:
a group of unusual mitochondrial diseases in human, Biochim Biophys Acta. 1361, 185-97.
2. Balaban, R. S. (2002) Cardiac energy metabolism homeostasis: role of cytosolic calcium, J Mol Cell Cardiol. 34,
1259-71.
3. Brunengraber, H. & Roe, C. R. (2006) Anaplerotic molecules: Current and future, J Inherit Metab Dis. 29, 327-31.
4. Owen, O. E., Kalhan, S. C. & Hanson, R. W. (2002) The key role of anaplerosis and cataplerosis for citric acid cycle
function, J Biol Chem. 277, 30409-12.
5. Brunengraber, H., Boutry, M. & Lowenstein, J. M. (1973) Fatty acid and 3- -hydroxysterol synthesis in the perfused
rat liver. Including measurements on the production of lactate, pyruvate, -hydroxy-butyrate, and acetoacetate by the fed
liver, J Biol Chem. 248, 2656-69.
6. Sharma, N., Okere, I. C., Brunengraber, D. Z., McElfresh, T. A., King, K. L., Sterk, J. P., Huang, H., Chandler, M. P.
& Stanley, W. C. (2005) Regulation of pyruvate dehydrogenase activity and citric acid cycle intermediates during high
cardiac power generation, J Physiol. 562, 593-603.
7. Bisschop, P. H., Pereira Arias, A. M., Ackermans, M. T., Endert, E., Pijl, H., Kuipers, F., Meijer, A. J., Sauerwein, H.
P. & Romijn, J. A. (2000) The effects of carbohydrate variation in isocaloric diets on glycogenolysis and
gluconeogenesis in healthy men, J Clin Endocrinol Metab. 85, 1963-7.
Página 7 de 7