Isomeria
ptica
Isomeria Ó
Óptica
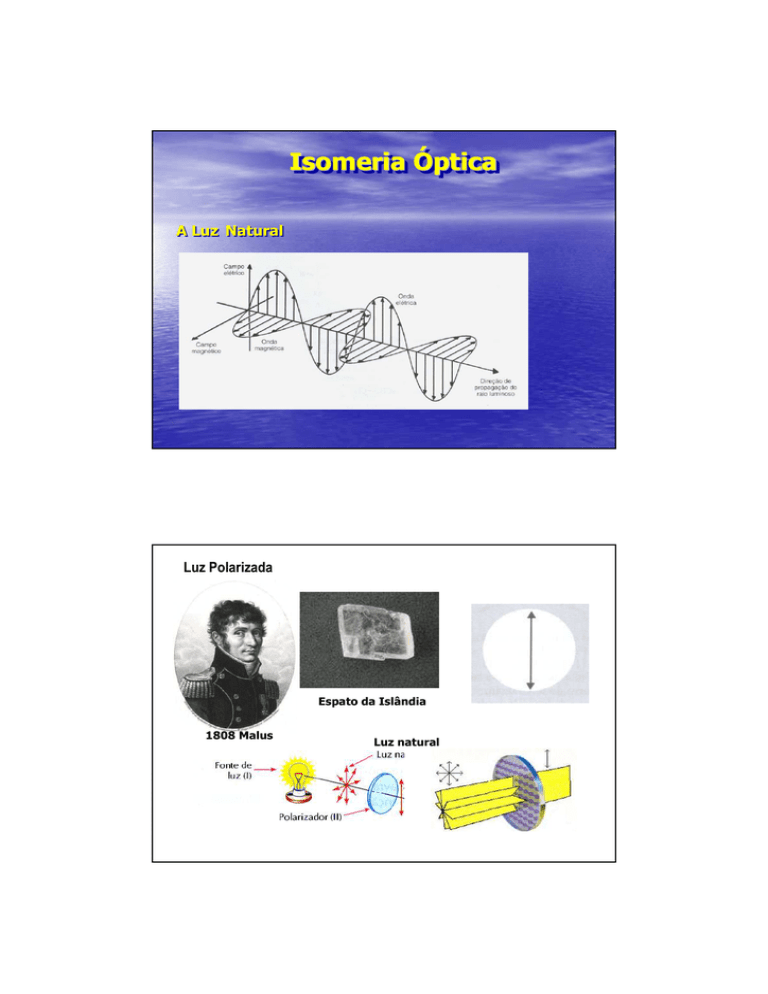
A Luz Natural
Luz Polarizada
Espato da Islândia
1808 Malus
Luz natural
“Constatei que algumas
soluções como o óleo de limão,
a cânfora em álcool e o caldode-cana, quando analisados no
polarizador tem a capacidade
de desviar o plano da luz
polarizada.“
1815 Jean-Batiste Biot
1829 Willian Nicol
A contribuição de Louis Pasteur
O
OH
C
H
C
OH
H
C
OH
C
O
1846 Louis Pasteur
OH
Ácido-2,3-diidroxibutanodióico
Isomeria
ptica
Isomeria Ó
Óptica
A importância Biológica da Quiralidade
A maioria das moléculas que constituem os
vegetais e animais é quiral . Todos os 20
aminoácidos que cosntituem as proteínas de
ocorrência natural , exceto um, são quirais e todos
são classificados como esquerdo
Limoneno
Talidomida
+
de 20.000 casos (oficiais) no mundo
Isomeria
ptica
Isomeria Ó
Óptica
1° Caso → A molécula possui carbono assimétrico
(carbono quiral)
R1
C
R2 R R4
3
R1 ≠ R2 ≠ R3 ≠ R4
Exemplo: Ácido lático
2
3
Hd3-ÁCcido láláticoCH
O
P.F.
1
Densidade
Constante de Ângulo
ionizaç
de desvio
ionização
52°
52°C
1,25 g/cm3
1,4 x 10-4
+ 2,6°
2,6°
52°
52°C
1,25 g/cm
OH
1,4 x 10-4
- 2,6 °
C
OH
l-Ácido lá
lático
3
H
H
C
C
H3C OH COOH
HOOC OH CH3
d - Ácido lático
l - Ácido lático
levógiro
dextrógiro
Antípodas ópticas ou enantiômeros
Exemplo: 2-metil-1-butanol
2
3
4
CH
CH2
CH3
1
H2 C
OH
H
CH3 Densidade
P.F.
l-2-metilmetil-1-butanol
129°
129°C
0,816 g/mL
d-2-metilmetil-1-butanol
129°
129°C
0,816 g/mL
C
OHCH2 CH C2H5
3
l - 2-metil-1-butanol
Solubilidade em água
H
Ângulo de
desvio
3,6 g/100g de água
- 5,9°
5,9°
3,6 g/100g de água
+ 5,9 °
C
H5C2 CH CH2OH
3
d - 2-metil-1-butanol
Antípodas ópticas, enanciômeros ou enantiomorfos
Exemplo: 3-metilexano
1
H3 C
2
3
4
5
6
CH2
CH
CH2
CH2
CH3
CH3
Exemplo*: 3-metil-2-pentanol
1
H3 C
5
2
3
4
CH
CH
CH2
OH
CH3
CH3
HO H CH
3
C
H3C H OH
C
C
C
H5C2 H CH3
H3C H C2H5
Como os ligantes do C2 não são todos iguais aos
aos ligantes
ligantes do C3 então:
Se o C2 girar a luz polarizada de um ângulo α,
o C3 irá girar a luz polarizada de um ângulo β ≠ α
Para facilitar a compreensão, vamos atribuir valores
arbitrários para os ângulos α e β
α = 30° e β = 10°
Sentido
do Desvio
Sentido
do Desvio
Sentido
do Desvio
Sentido
do Desvio
C2
+ 30°
- 30°
+ 30°
- 30°
C3
+ 10°
- 10°
- 10°
+ 10°
Resultado
+ 40°
- 40°
+20°
- 20°
Enanciômeros
Enanciômeros
d e ll ←
← Opticamente
Opticamente Ativos→
Ativos→ d’ e ll’’
Mistura ←
← Opticamente
Opticamente Inativos→
Inativos→ Mistura
racêmica
racêmica
Sentido
do Desvio
Sentido
do Desvio
Sentido
do Desvio
Sentido
do Desvio
C2
+ 30°
- 30°
+ 30°
- 30°
C3
+ 10°
- 10°
- 10°
+ 10°
Resultado
+ 40°
- 40°
+20°
- 20°
HO H CH
3
C2
H3C H OH
C2
C3
C3
H3C H C2H5
H5C2 H CH3
HO H CH
3
CC 2
CC 3
H3C H C2H5
H3C H OH
C2
C3
H5C2 H CH3
EnanciômerosDiastereômerosEnanciômeros
d e ll
ll e d’
d’ e ll’’
A fórmula de Van’t Hoff e Le Bell
N° de isômeros ópticos ativos: 2c*
N° de misturas racêmicas: 2c*
2
Obs.: Essa fórmula só é valida para
estruturas com C* diferentes
Exemplo: 1,3,4,5,6-Pentahidroxi-2-hexanona (Frutose)
OH O H OH OH OH
H
1
C
H
2
C
3
C
4
C
OH H
5
C
H
6
C
H
H
Aplicando a fórmula de Van’t Hoff e Le Bel temos:
N° de isômeros ópticos ativos: 23 = 8
N° de misturas racêmicas: __
23 = 4
2
Exemplo: 1,3,4,5,6-Pentahidroxi-2-hexanona (Frutose)
OH O H OH OH OH
H
HOCH2CO
H
C
C
OH
HO
HOCH2CO
H
C
H
H
C
C
HO
C
1
H
OH
HO
H
H
CH2OH HOH2C
d
2
C
ll
H
C
H
H
OH
HO
OH
HO C
CH2OH HOH2C
H d’’
C
C
ll’’’’ H
C
4
C
5
OH H
C
6
H
C
H
HOCH2CO
COCH2OH
OH
OH
OH
HOH2C
C
C
3
C
H
H
C
C
C
OH
HO
H
H
OH
HO
H d’
H
C
C
C
H
HOH2COC
COCH2OH
C
HO C
H
HOH2C
OH
C
H
OH
HO
OH
HO
OH
HO
d’’’
OH
CH2OH
ll’’
d’
H
COCH2OH
H
C
C
C
H
ll’’’
’’’
COCH2OH
H
CH2OH
Exemplo*: Ácido-2,3-diidroxibutanodióico
(Ácido tartárico)
H
O
C
HO
4
3
C
H
2
C
OH OH
1
C
O
OH
Como os ligantes do C2 e C3 são todos iguais então:
Se o C2 girar a luz polarizada de um ângulo α,
o C3 também irá girar a luz polarizada de um ângulo α
Sentido
do Desvio
Sentido
do Desvio
Sentido
do Desvio
C2
+ 6°
- 6°
- 6°
C3
+ 6°
- 6°
+ 6°
Resultado
+ 12°
- 12°
- 0°
H OH
OH H COOH HOOC
C
C
Compensação
interna
HOOC H OH
C
C
C
HOOC H OH
C
HO H COOH HOOC
H OH
ll
Meso
d
l
Meso
P.F.
170 °C
170 °C
140 °C
Densidade
1,76 g/ml
g/ml
1,76 g/ml
g/ml
1,69 g/ml
g/ml
Solubilidade
139 g
139 g
125 g
Poder
rotató
rotatório
+ 12°
12°
-12°
12°
0°
d
H OH
OH H COOH HOOC
C
C
C
HOOC H OH
d
HOOC H OH
C
C
C
HO H COOH HOOC
H OH
ll
Meso
Isomeria
ptica
Isomeria Ó
Óptica
2° Caso → A molécula NÃO possui carbono assimétrico
a) Compostos alênicos
R1
R3
C
C
R1 ≠ R2 ≠ R3 ≠ R4
C
R2
R4
b) Compostos cíclicos
Exemplo: z-1-metil-2-clorociclopropano
H3C
1
H
2
H
Cl
Exemplo: 1,2-diclorociclobutano
H
H
Cl
Cl
cis-1,2-diclorociclobutano
H
Cl
Cl
H
d- trans-1,2-diclorociclobutano
Cl
H
H
Cl
l- trans-1,2-diclorociclobutano
Qual o número total de isômeros ativos e
misturas racêmicas de uma molécula que possui
5 átomos de carbono assimétrico diferentes?
a) 16
b) 25
c) 48
X
d) 10
e) 41
Exemplo: Carvona
CH3
C
CH
CH2
C
*
CH
C
H3C
O
CH2
CH2
Exemplo: Vitamina C
HO
OH
*
O
O
*
OH
OH
Exemplo: Limoneno
*
Exemplo: Adrenalina
OH H
C* C
H
HO
OH
H
H
N
C
H
H
Exemplo: Anfetamina
CH2
*
CH
CH3
NH2
Exemplo: Talidomida
O
N
O
*
N
O
O
Exemplo: Fexofenadina
H
N
*
OH
OH
CH3
COOH
CH3