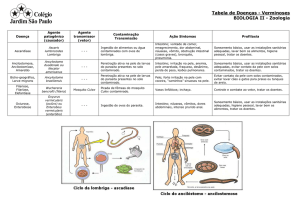
EMA/474847/2016
EMEA/H/C/002345
Resumo do EPAR destinado ao público
Revestive
teduglutide
Este é um resumo do Relatório Público Europeu de Avaliação (EPAR) relativo ao Revestive. O seu
objetivo é explicar o modo como o Comité dos Medicamentos para Uso Humano (CHMP) avaliou o
medicamento a fim de emitir um parecer favorável à concessão de uma Autorização de Introdução no
Mercado, bem como as suas recomendações sobre as condições de utilização do Revestive.
O que é o Revestive?
O Revestive é um medicamento que contém a substância ativa teduglutide. Está disponível na forma
de um pó e de um solvente que se destinam a ser reconstituídos numa solução injetável.
Para que é utilizado o Revestive?
O Revestive é utilizado no tratamento de adultos e crianças a partir de 1 ano de idade com síndrome
do intestino curto. A síndrome do intestino curto é uma patologia na qual os nutrientes e os fluidos não
são adequadamente absorvidos pelo intestino, habitualmente após a remoção cirúrgica de uma grande
parte do intestino delgado. O Revestive é utilizado após a ocorrência da adaptação intestinal
(alterações na função do intestino para compensar o seu tamanho reduzido depois de a cirurgia ser
realizada).
Dado o número de doentes afetados pela doença do intestino curto ser pequeno, a doença é
considerada rara, pelo que o Revestive foi designado medicamento órfão (medicamento utilizado em
doenças raras) em 11 de dezembro de 2001.
Este medicamento só pode ser obtido mediante receita médica.
Como se utiliza o Revestive?
O tratamento deve ser iniciado sob a supervisão de um médico com experiência no tratamento da
síndrome do intestino curto. No início do tratamento com o Revestive e regularmente durante o
tratamento, um especialista deve realizar uma colonoscopia (um exame do intestino) para determinar
se existem pólipos (excrescências) no intestino grosso. Deve também ser realizada uma colonoscopia
30 Churchill Place ● Canary Wharf ● London E14 5EU ● United Kingdom
Telephone +44 (0)20 3660 6000 Facsimile +44 (0)20 3660 5555
Send a question via our website www.ema.europa.eu/contact
An agency of the European Union
© European Medicines Agency, 2016. Reproduction is authorised provided the source is acknowledged.
em crianças com idade inferior a 12 anos quando seja detetado sangue nas fezes. Torna-se necessário
remover quaisquer pólipos detetados antes do tratamento.
O Revestive é administrado como uma injeção sob a pele do abdómen. A dose recomendada é de
0,05 mg por quilograma de peso corporal uma vez por dia. Se necessário, a dose diária pode ser
diminuída para reduzir os efeitos secundários. A dose diária deve ser reduzida para metade nos
doentes com função renal moderada ou gravemente reduzida. Caso não se observe qualquer benefício,
o tratamento deve ser terminado.
Como funciona o Revestive?
A substância ativa do Revestive, teduglutide, é um análogo do peptídeo 2 semelhante ao glucagon
humano (GLP-2), uma hormona fabricada no intestino que aumenta a absorção de nutrientes a partir
do mesmo.
O teduglutide funciona de forma similar ao GLP-2, aumentando a absorção do intestino através do
aumento do fluxo sanguíneo de e para o intestino, da redução da velocidade de passagem dos
alimentos e da redução das secreções ácidas no estômago que podem interferir com a absorção no
intestino. O teduglutide tem a vantagem de durar mais tempo do que o GLP-2 no organismo.
Como foi estudado o Revestive?
O Revestive foi estudado em dois estudos principais. O primeiro estudo incluiu 86 adultos com
síndrome do intestino curto causada pela remoção de uma grande parte do intestino delgado e que
necessitavam de nutrição parentérica (nutrientes e fluidos administrados diretamente numa veia) pelo
menos três vezes por semana.
Neste estudo, os doentes receberam Revestive ou um placebo (tratamento simulado) todos os dias
durante 24 semanas. O principal parâmetro de eficácia foi o número de doentes que responderam ao
tratamento. Esta última foi definida como uma redução de pelo menos 20 % do volume da nutrição
parentérica na semana 20 e a manutenção de uma redução de pelo menos 20 % do volume semanal
da nutrição parentérica na semana 24.
O segundo estudo incluiu 42 crianças com síndrome do intestino curto que necessitavam de nutrição
parentérica. Os doentes receberam diferentes doses do Revestive ou o tratamento padrão durante 12
semanas. O principal parâmetro de eficácia foi a percentagem de doentes que responderam ao
tratamento, definida como o número de doentes que alcançaram uma redução de pelo menos 10 % do
volume de nutrição parentérica à semana 12.
Qual o benefício demonstrado pelo Revestive durante os estudos?
No estudo em adultos, 62,8 % (27 num total de 43) dos doentes que receberam o Revestive
apresentaram resposta ao tratamento, em comparação com 30,2 % (13 num total de 43) que
receberam o placebo.
No segundo estudo, 53 % (8 num total de 15) das crianças que receberam o Revestive apresentaram
resposta ao tratamento, não tendo nenhuma delas respondido ao tratamento padrão (0 num total de
5).
Revestive
EMA/474847/2016
Página 2/4
Qual é o risco associado ao Revestive?
Os efeitos secundários mais frequentes associados ao Revestive são dor e distensão abdominal
(estômago dorido e inchado, 49 %), infeções do trato respiratório (infeções da garganta, seios nasais,
vias respiratórias ou pulmões, 28 %), náuseas (sensação de enjoo, 27 %), vermelhidão, dor ou
inchaço no local da injeção (21 %), dor de cabeça (17 %), vómitos (14 %) e edema periférico (inchaço
das mãos e/ou pés, 10 %). Cerca de 38 % dos doentes tratados com um estoma (uma abertura
artificial na parte da frente do abdómen para recolher fezes ou urina do organismo) sofreram
complicações, tais como inchaço do estoma. A maioria destas reações foi ligeira ou moderada. Para a
lista completa dos efeitos secundários comunicados relativamente ao Revestive, consulte o Folheto
Informativo.
O Revestive não deve ser utilizado em doentes com cancro ou suspeita de cancro. Não deve ser
utilizado em doentes que sofreram de cancro gastrointestinal (cancro do estômago, intestino ou
fígado) nos últimos cinco anos. Para a lista completa das restrições de utilização, consulte o Folheto
Informativo.
Por que foi aprovado o Revestive?
O CHMP considerou que o Revestive foi benéfico nos adultos com síndrome do intestino curto na
medida em que reduziu substancialmente a quantidade de nutrição parentérica necessária, um efeito
que se manteve após um ano de tratamento. Os doentes que necessitam de volumes elevados de
nutrição parentérica podem beneficiar de uma redução significativa ao passo que os doentes que
necessitam de quantidades baixas têm a hipótese de interromper por completo a administração de
nutrição parentérica. O Comité registou também que a síndrome do intestino curto é uma patologia
grave e incapacitante para a qual só existe um tratamento sintomático limitado. Além disso, o
Revestive apresentou um perfil de segurança aceitável durante até um ano de tratamento em adultos.
Observaram-se resultados de eficácia e um perfil de segurança semelhantes nas crianças, o que apoia
a utilização do Revestive nestes doentes.
Por conseguinte, o CHMP concluiu que os benefícios do Revestive são superiores aos seus riscos e
recomendou a concessão de uma Autorização de Introdução no Mercado para o medicamento.
Que medidas estão a ser adotadas para garantir a utilização segura do
Revestive?
Demonstrou-se que o Revestive estimula o crescimento das células no revestimento do intestino em
modelos experimentais. Ainda que o Revestive não tenha demonstrado ter qualquer efeito no início dos
tumores, a empresa monitorizará de perto a segurança e eficácia do medicamento através da criação
de um registo de doentes. No Resumo das Características do Medicamento e no Folheto Informativo
foram igualmente incluídas recomendações e precauções a observar pelos profissionais de saúde e
pelos doentes para a utilização segura e eficaz do Revestive.
Revestive
EMA/474847/2016
Página 3/4
Outras informações sobre o Revestive
Em 30 de agosto de 2012, a Comissão Europeia concedeu uma Autorização de Introdução no Mercado,
válida para toda a União Europeia, para o medicamento Revestive.
O EPAR completo sobre o Revestive pode ser consultado no sítio Internet da Agência
em: ema.europa.eu/Find medicine/Human medicines/European public assessment reports Para mais
informações sobre o tratamento com o Revestive, leia o Folheto Informativo (também parte do EPAR)
ou contacte o seu médico ou farmacêutico.
O resumo do parecer emitido pelo Comité dos Medicamentos Órfãos para o Revestive pode ser
consultado no sítio Internet da Agência em: ema.europa.eu/Find medicine/Human medicines/Rare
disease designation.
Este resumo foi atualizado pela última vez em 08-2016.
Revestive
EMA/474847/2016
Página 4/4