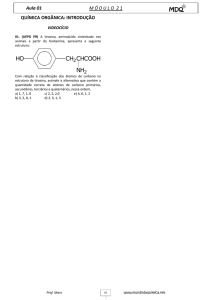
QUESTÕES DISCURSIVAS
1. Desde a antiguidade substâncias inorgânicas têm sido utilizadas como cosméticos.
Preencha quadro abaixo com o nome ou a fórmula de algumas dessas substâncias:
CONTEÚDO:
NOMENCLATURA DE COMPOSTOS INORGÂNICOS.
Nome das substâncias
Sulfeto de antimônio (III)
Resposta
Carbonato de chumbo (II)
Resposta
Acetato de chumbo (II) ou
etanoato de chumbo(II)
Resposta
Dióxido de titânio ou óxido
de titânio (IV)
Peróxido de hidrogênio
Óxido de ferro(III)
2.
Fórmulas
Resposta
Sb2S3
PbCO3
Pb(CH3CO2)2
TiO2
Resposta
H2O2
Resposta
Fe2O3
Usos
Sombra para os
olhos (3500 a.C.)
Pó facial (Europa,
séc. XVIII)
Tintura capilar
Protetor solar
Despigmentação
capilar
Sombra para os
olhos
Considere as entalpias de formação da água:
H2(g) + ½ O2(g) H2O(s) ∆H= -69,7 kcal/mol
H2(g) + ½ O2(g) H2O(l) ∆H= -68,3 kcal/mol
H2(g) + ½ O2(g) H2O(g) ∆H= -57,8 kcal/mol
a) Calcule, no quadro abaixo, a variação da entalpia envolvida na produção de 4 g de
hidrogênio a partir da água sólida.
b) Calcule, no quadro abaixo, a variação da entalpia envolvida na produção de 4 g de
hidrogênio a partir da água sólida.
c) Calcule, no quadro abaixo, a diferença de entalpia que existe entre 18 g de gelo e
36 g de água líquida à mesma temperatura e pressão.
CONTEÚDO:
TERMOQUÍMICA – Lei de Hess. Estados físicos da matéria. QUANTIDADE DE MATÉRIA
– Mol. Massa molar.
a) Utiliza-se a primeira equação, que envolve água no estado sólido, invertida, pois
deseja-se analisar a produção de hidrogênio a partir da água sólida.
H2O(s) __ H2(g) + ½ O2(g) _H = +69,7 kcal/mol
Como a equação foi invertida, troca-se o sinal de ∆H.
Observa-se que 1 mol de H2O(s) (equivalente a 18,0 g) produz 1 mol de H2(g)
(equivalente a 2,0 g). Nesse processo há a absorção de 69,7 kcal. Portanto, a
produção de 4 g de H2(g) (equivalente a 2 mols) consumirá 2x 69,7 kcal. Assim a
variação de entalpia envolvida na produção de 4 g de H2(g) a partir de água no
estado sólido será: 139,4 kcal.
b) Utilizam-se a primeira e a terceira equações (sendo a primeira invertida) de modo
que no processo global seja analisada a passagem de água no estado sólido para
água no estado gasoso (sublimação).
H2O(s) __ H2(g) + ½ O2(g) _H = +69,7 kcal/mol
H2(g) + ½ O2(g) __ H2O(g) _H = -57,8 kcal/mol
A soma das duas equações é: H2O(s) __ H2O(g) _H = 11,9 kcal/mol
Mas esse resultado é a entalpia envolvida na sublimação de 18 g de água
(equivalente a 1 mol); para 2 mols (36 g de água) a entalpia envolvida será o
dobro, portanto igual a 23,8 kcal.
c) Quando é formado 1 mol de gelo (equivalente a 18 g) a variação de entalpia, de
acordo com a primeira equação, é -69,7. Quando são formados 2 mols de água no
estado líquido (equivalente a 36 g) a variação de entalpia, de acordo com a
equação 2, será 2 x -68,3 kcal. Portanto, a diferença de entalpia entre 18 g de gelo
e 36 g de água no estado líquido à mesma temperatura e pressão será -69,7 – (2 x
-68,3)= 66,9 kcal
3. O atrativo sexual da mosca doméstica (Musca domestica Linnaeus) é um alqueno
contendo 23 átomos de carbono chamado muscalure, cuja fórmula estrutural
aparece representada abaixo:
CH3(CH2)7
H
(CH2)12CH3
H
a) Escreva, no quadro abaixo, a fórmula estrutural do produto da reação de cloração
de muscalure.
b) Escreva, no quadro abaixo, a fórmula estrutural do produto da reação de
muscalure com solução aquosa diluída de permanganato de potássio.
CONTEÚDO:
FUNDAMENTOS DA QUÍMICA ORGÂNICA – Representação das fórmulas estruturais
dos compostos orgânicos. Reações da química orgânica.
a) Trata-se de uma reação de adição de halogênio a uma ligação dupla carbono-carbono.
Nessa reação dois átomos de cloro se ligam aos átomos de carbono da ligação dupla
quebrando a ligação π. Assim, o produto formado será:
H
H
C
C
Cl
Cl
CH3 (CH2 )7
(CH2 )1 2 CH3
b) Como a solução de permanganato de potássio está diluída, trata-se de uma
oxidação branda de um alqueno. Nessas reações ocorre a quebra da ligação π
entre os átomos de carbono da ligação dupla e a adição de um grupo OH a cada
um desses átomos. Assim, o produto formado será:
CH (CH )
3
2 7
H
H
C
C
OH
OH
(CH ) CH
2 12
3
4. O óleo essencial de cravo-da-índia possui propriedades anestésica e antimicrobiana,
podendo ser utilizado para eliminar o mau hálito. Seu principal componente, o
eugenol, cuja fórmula estrutural aparece representada abaixo, é utilizado em
consultórios dentários, sendo o responsável pelo seu odor característico.
NaO
OCH
3
a) Escreva, no quadro abaixo, a estrutura do produto formado pela reação de
eugenol com uma solução aquosa de hidróxido de sódio.
b) Classifique, no quadro abaixo, a reação entre o eugenol e o hidróxido de sódio.
c) Escreva, no quadro abaixo, o número de átomos de carbono com hibridações sp3
e sp2 na molécula do eugenol.
Número de átomos de carbono com hibridação sp3: __________________
Número de átomos de carbono com hibridação sp3: __________________
CONTEÚDO:
FUNDAMENTOS DA QUÍMICA ORGÂNICA – Representação das fórmulasestruturais dos
compostos orgânicos. Reações da química orgânica. Hibridação de orbitais atômicos.
a) De todos os átomos de hidrogênio da molécula de eugenol, apenas aquele ligado
ao átomo de oxigênio é ionizável pelo hidróxido de sódio. Assim, a estrutura do
produto formado pela reação do eugenol com uma solução aquosa de hidróxido de
sódio será:
NaO
OCH
3
b) Trata-se de uma reação entre uma base e um ácido de Br_nsted-Lowry. Portanto
esta reação é classificada como reação ácido-base.
c) Os átomos de carbono com hibridação sp3 na molécula do eugenol estão ligados
a quatro outros átomos através de ligações simples. Os átomos de carbono com
hibridação sp2 apresentam uma ligação dupla. A figura abaixo mostra os carbonos
hibridados sp3 e sp2 na molécula do eugenol.
NaO
OCH3
= átomos de carbono com hibridação sp3 (2 átomos)
= átomos de carbono com hibridação sp2 (8 átomos)
= átomos de carbono com hibridação sp3 (2 átomos)
5. A casca da caneleira (Cinnamomum zeylanicum) é empregada como condimento. O
extrato concentrado da canela é constituído por cerca de 90% de cinamaldeído. O
cinamaldeído, cuja estrutura aparece representada abaixo, é o responsável pelo sabor
pungente da canela.
O
H
a) Represente, no quadro abaixo, a fórmula estrutural do composto cis-3-fenilprop-2enal.
b) O cinamaldeído pode ser preparado pela reação de condensação de benzaldeído
e etanal. Escreva, nos quadros abaixo, as fórmulas estruturais do benzaldeído e
do etanal.
Benzaldeído
Etanal
CONTEÚDO:
FUNDAMENTOS DA QUÍMICA ORGÂNICA – Representação de fórmulas de compostos
orgânicos. Nomenclatura de compostos orgânicos. Isomeria.
a) A nomenclatura sistemática de cinamaldeído é trans-3-fenilprop-2-enal. Portanto
cis-3-fenilprop-2-enal tem uma estrutura semelhante à do cinamaldeído, com a
ressalva de que os grupos fenil e CHO estão do mesmo lado em relação à ligação
dupla. Portanto, a estrutura do cis-3-fenilprop-2-enal é:
O
H
b) De acordo com a nomenclatura sistemática da química orgânica as estruturas dos
compostos mencionados são:
O
H
O
CH3 CH
Benzaldeído
Etanal