Tá com Dúvida? Faça DNA
Data da entrega: 22/4/2010
Data da devolução ____/_____/_________
COLÉGIO DNA
[email protected]
Aluno (a):_______________________________________________________________________________________________________
LISTA DE QUÍMICA
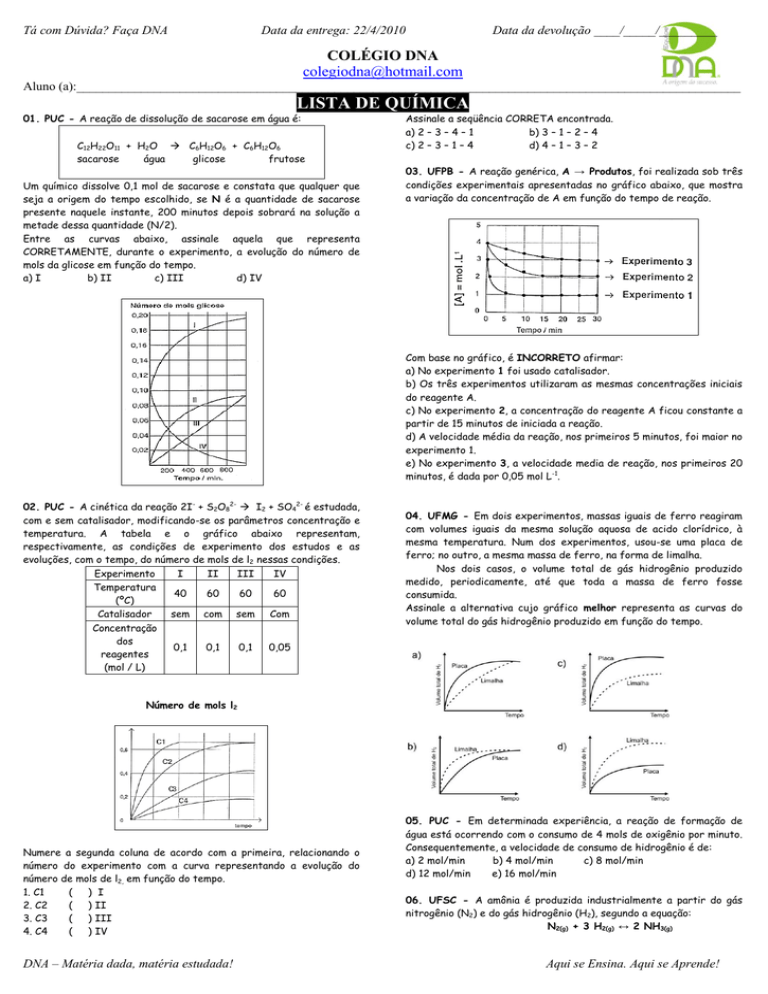
01. PUC - A reação de dissolução de sacarose em água é:
C12H22O11 + H2O C6H12O6 + C6H12O6
sacarose
água
glicose
frutose
Um químico dissolve 0,1 mol de sacarose e constata que qualquer que
seja a origem do tempo escolhido, se N é a quantidade de sacarose
presente naquele instante, 200 minutos depois sobrará na solução a
metade dessa quantidade (N/2).
Entre as curvas abaixo, assinale aquela que representa
CORRETAMENTE, durante o experimento, a evolução do número de
mols da glicose em função do tempo.
a) I
b) II
c) III
d) IV
Assinale a seqüência CORRETA encontrada.
a) 2 – 3 – 4 – 1
b) 3 – 1 – 2 – 4
c) 2 – 3 – 1 – 4
d) 4 – 1 – 3 – 2
03. UFPB - A reação genérica, A → Produtos, foi realizada sob três
condições experimentais apresentadas no gráfico abaixo, que mostra
a variação da concentração de A em função do tempo de reação.
Com base no gráfico, é INCORRETO afirmar:
a) No experimento 1 foi usado catalisador.
b) Os três experimentos utilizaram as mesmas concentrações iniciais
do reagente A.
c) No experimento 2, a concentração do reagente A ficou constante a
partir de 15 minutos de iniciada a reação.
d) A velocidade média da reação, nos primeiros 5 minutos, foi maior no
experimento 1.
e) No experimento 3, a velocidade media de reação, nos primeiros 20
minutos, é dada por 0,05 mol L-1.
02. PUC - A cinética da reação 2I- + S2O82- I2 + SO42- é estudada,
com e sem catalisador, modificando-se os parâmetros concentração e
temperatura. A tabela e o gráfico abaixo representam,
respectivamente, as condições de experimento dos estudos e as
evoluções, com o tempo, do número de mols de l2 nessas condições.
Experimento
I
II
III
IV
Temperatura
40
60
60
60
(ºC)
Catalisador
sem com sem Com
Concentração
dos
0,1
0,1
0,1
0,05
reagentes
(mol / L)
04. UFMG - Em dois experimentos, massas iguais de ferro reagiram
com volumes iguais da mesma solução aquosa de acido clorídrico, à
mesma temperatura. Num dos experimentos, usou-se uma placa de
ferro; no outro, a mesma massa de ferro, na forma de limalha.
Nos dois casos, o volume total de gás hidrogênio produzido
medido, periodicamente, até que toda a massa de ferro fosse
consumida.
Assinale a alternativa cujo gráfico melhor representa as curvas do
volume total do gás hidrogênio produzido em função do tempo.
Número de mols l2
Numere a segunda coluna de acordo com a primeira, relacionando o
número do experimento com a curva representando a evolução do
número de mols de l2, em função do tempo.
1. C1
(
) I
2. C2
(
) II
3. C3
(
) III
4. C4
(
) IV
DNA – Matéria dada, matéria estudada!
05. PUC - Em determinada experiência, a reação de formação de
água está ocorrendo com o consumo de 4 mols de oxigênio por minuto.
Consequentemente, a velocidade de consumo de hidrogênio é de:
a) 2 mol/min
b) 4 mol/min
c) 8 mol/min
d) 12 mol/min
e) 16 mol/min
06. UFSC - A amônia é produzida industrialmente a partir do gás
nitrogênio (N2) e do gás hidrogênio (H2), segundo a equação:
N2(g) + 3 H2(g) ↔ 2 NH3(g)
Aqui se Ensina. Aqui se Aprende!
Tá com Dúvida? Faça DNA
Data da entrega: 22/4/2010
Numa determinada experiência, a velocidade média de consumo de gás
foi de 120g por minuto. A velocidade de formação do gás amônia,
nessa experiência, em número de mols por minuto será de:
a) 10
b) 20
c) 40
d) 50
e) 60
07. UFPA - A combustão completa do etanol ocorre pela equação:
C2H5OH + 3O2 →2 CO2 + 3H2O.
Considerando-se que em 1h de reação foram produzidos 2.640 g de
gás carbônico, você conclui que a velocidade de reação, expressa em
número de mols de etanol consumido por minuto, é:
a) 0,5
b) 1,0
c) 23
d) 46
e) 69
08. UERJ - Air-bag são dispositivos de segurança de automóveis que
protegem o motorista em caso de colisão. Consistem em uma espécie
de balão contendo 130 g de azida de sódio em seu interior. A azida,
submetida a aquecimento, decompõe-se imediata e completamente,
inflando o balão em apenas 30 milissegundos. A equação abaixo
representa a decomposição da azida:
2 NaN3(s) → 3 N2(g) + 2 Na(s)
Considerando o volume molar igual a 24 L.mol-1, calcule a velocidade da
reação, em Ls-1, de nitrogênio gasoso produzido.
09. UFF - A amônia é um produto básico para a produção de
fertilizantes. Ela é produzida cataliticamente, em altas pressões
(processo Haber), conforme a equação:
N2 + 3H2 2 NH3
Se a velocidade de produção de amônio foi medida como:
velocidade = Δ[ NH3] = 2,0 x 10-4mol.L-1.s-1
Δt
Data da devolução ____/_____/_________
a) Sabendo que a reação é bimolecular e de primeira ordem em
relação aos reagentes escreva a expressão da velocidade desta
reação.
b) Determine a velocidade média da hidrolise do éster após 2 minutos
de reação.
12. UNB - O gráfico mostra o diagrama da concentração versus
tempo para o equilíbrio X ↔ Y, em que X representa os reagentes e
Y, os produtos. Sabe-se que, quando este sistema em equilíbrio é
submetido a um decréscimo de temperatura, ocorre um aumento da
velocidade da reação no sentido de formação de X, até o
estabelecimento de um novo equilíbrio.
Levando em consideração o gráfico e as informações fornecidas,
julgue os itens seguintes, usando (V) para verdadeiro e (F) para falso:
(
) O ponto de interseção entre as duas curvas indica o memento
em que se estabelece o equilíbrio químico para a reação.
(
) No sentido direto X → Y , o processo é exotérmico.
(
) Se o rendimento da produção de Y a partir de X for baixo, será
conveniente o uso de um catalisador.
(
) No equilíbrio, X e Y continuam sendo formados, isto é, a reação
ainda está ocorrendo.
(
) A função c=A(ekt+1) em que A e K são constantes reais nãonulas, é adequada para descrever a curva de concentração versus
tempo para os reagentes apresentada no gráfico.
13. UFC - O monóxido de carbono (CO), um veneno metabólico, é
incolor, inodoro e se apresenta no estado gasoso à temperatura
ambiente. Isto confere ao CO a denominação “poluente imperceptível”.
Quando inalado, o CO interfere no transporte de O2 no sangue, ao
combinar-se com a hemoglobina, para formar a carboxihemoglobina.
A velocidade da reação em termos de consumo de N2 será:
a) 1,0 x 10-4mol.L-1.s-1
b) 2,0 x 10-4mol.L-1.s-1
-4
-1 -1
c) 3,0 x 10 mol.L .s
d) 4,0 x 10-4mol.L-1.s-1
-4
-1 -1
e) 5,0 x 10 mol.L .s
10. PUC - As velocidades iniciais de decomposição do aldeído
acético (CH3 CHO) foram medidas para as concentrações iniciais de
0,1 mol/L e 0,20 mol/L e apresentaram os valores de 0,02 mol/L.s e
0,08 mol/L.s, respectivamente. A ordem da reação em relação ao
aldeído acético é:
a) ½
b) 1
c) 2
d) 3/2
e) 3
11. UNI - O butanoato de etila, utilizado para conferir o aroma
artificial de abacaxi, reage da seguinte forma em solução ácida:
Durante uma experiência, a concentração de butanoato de etila varia
com o tempo, de acordo com os dados da tabela abaixo.
Tempo
(min)
[Éster]
0,0
0,20
1,0
0,18
2,0
0,12
3,0
0,10
DNA – Matéria dada, matéria estudada!
Dado que a cinética da reação de formação da carboxihemoglobina é
de primeira ordem em relação a cada um dos reagentes, assinale a
alternativa CORRETA.
a) A expressão que representa corretamente a lei de velocidade da
reação inversa é v = k-1 [carboxihemoglobina] / [O2], e K-1 é
adimensional.
b) A lei de velocidade da reação direta é dada por v = k,
[oxihemoglobina] [CO], e as dimensões de K1 serão L.mol-1.s-1.
c) Quando os valores das concentrações iniciais da oxihemoglobina e
do CO forem idênticos e diferentes de 1M, a expressão v = k 1
representará corretamente a lei de velocidade da reação.
d) A reação descrita é dita de segunda ordem com relação aos
reagentes, e a constante de velocidade K1 assume dimensão L2.mol-2.s.
e) A etapa lenta da reação não é influenciada pelas concentrações da
oxihemoglobina e de monóxido de carbono.
14. EVANGÉLICA - O gráfico indica a variação que ocorre nas
concentrações das substâncias X, Y e Z, durante a reação química em
que participam essas três substâncias. É correto afirmar que a reação
que ocorre é representada por:
Aqui se Ensina. Aqui se Aprende!
Tá com Dúvida? Faça DNA
Data da entrega: 22/4/2010
Data da devolução ____/_____/_________
GABARITO
a) Z → X + Y
b) Y → X +Z
c) X → Y + Z
d) Y + Z → X
e) X + Z → Y
15. UFAC - A equação X +2Y → XY2 representa uma reação cuja
equação da velocidade é:
v =k [X] [Y]
Assinale o valor da constante de velocidade, para a reação acima,
sabendo que, quando a concentração de X é 1 M e a concentração de Y
é 2 M,a velocidade da reação é de 3 mol/min:
a) 0,75
d) 1,5
b) 3,0
e) 0,5
c) 1,0
DNA – Matéria dada, matéria estudada!
1. B
2. B
3. A
4. B
5. C
6. C
7. A
8. 2400 L . S-1
9. A
10. C
11. a) V = K . [C6H12O2] . [H2O]
b) Vm = 0,04 mol . min-1
12. F F F V V
13. B
14. A
15. D
Aqui se Ensina. Aqui se Aprende!