Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
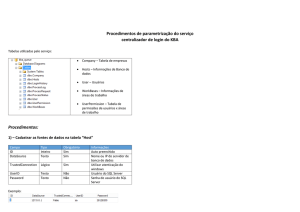
Exercícios
Instruções para os exercícios: 1 à 3
Z = numero atômico de um átomo (é também igual ao numero de prótons);
N = número de nêutrons;
A = número de massa de um átomo;
Fórmula para o calculo do número de massa: A = Z + N
(o número de massa de um átomo é soma dos protons e dos nêutrons que
se encontram no núcleo atomico).
Representação: zXA
(1)FUVEST – SP: O atomo constituído de 17 protons, 19 neutrons e 17
eletrons apresenta, respectivamente, número atomico (Z) e numero de
massa (A) iguais a:
(a) 17 e 17
(b) 17 e 18
(c) 18 e 17
(d) 17 e 35
(e) 35 e 17
(2) MACKENZIE – SP: O número de protons, de elétrons e de nêutrons do
atomo 17Cl35 é, respectivamente:
(a)17, 17, 18
(b)35, 17, 18
(c)17, 18, 18
(d)17, 35, 35
(e)52, 35, 17
(3) Quais são os números de protons (Z), de massa (A), de nêutrons (N) e
de eletrons (e-) de um átomos de potássio (19K39) em seu estado normal?
(4)UFMA: Em um atomo com 22 eletrons e 26 neutrons, seu numero
atomico e numero de massa são, respectivamente:
(a)22 e 26
(b)26 e 48
(c)26 e 22
(d)48 e 22
(e)22 e 48
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Instruções para os exercícios: 4 `a 8
Isótopos, Isóbaros e Isotonos
Isótopos: são átomos que possuem o mesmo numero atomico (Z) e
diferentes números de massa (A);
Lembrar do p de isotopo: igual numero de protons, igual numero atomico.
Isotonos: são átomos que apresenttam diferentes números atômicos (Z),
diferentes números de massa (A) e o mesmo numero de neutrons (N)
Lembrar do n de istono: mesmo numero de neutrons
Isóbaros: são átomos que apresentam diferentes números atomicos (Z) e
mesmo numero de massa (A). Lembrar do b de isóbaro: b de barriga que
tem massa.
(4) PUC – MG: Considere os seguintes dados:
Átomo
I
II
Prótons
40
42
Eletrons
40
42
Neutrons
40
38
Os átomos I e II:
(a) são isótopos
(b) são do mesmo elemento
(c) são isóbaros
(d) são isotonos
(e) têm o mesmo numero atomico
(5) UFPA: Os isotopos do hidrogenio receberam os nomes de protio (1H1),
deutério (1H2) e trítio (1H3). Nesses átomos os números de nêutrons são,
respectivamente:
(a)0, 1, 2
(b)1, 1, 1
(c)1, 1, 3
(d)1, 2, 3
(e)2, 3, 4
(6)UFS – SE: O atomo xA2x é isóbaro do
é:
(a) 28
(b)29
(c)30
28Ni
58
. O número de nêutrons em A
(d)31
(e)32
(7)Um atomo possui 19 protons, 20 neutrons e 19 eletrons. Qual dos
seguintes átomos abaixo é seu isotono:
(a) 19A21
(b) 19B20
(c) 18C38
(d) 39D58
(e) 20E39
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
(7) UFSM – RS: Analise as seguintes afirmativas:
I – isotopos são átomos de um mesmo elemento que possuem mesmo
número atomico e diferente numero de massa;
II – o númeo atomico de um elemento corresponde ao número de prontos
no núcleo de um atomo;
III – o número de massa corresponde à soma do numero de protons e do
numero de elétrons de um elemento;
Quais são corretas?
(8) Desafio
Considere as seguintes informações sobre os átomos x, y e z:
I – x e z são isótopos;
II – x e y são isotonos;
III – x e z são isóbaros.
Sabendo-se que o numero de massa de x é 70, o numero atomico de z é 35
e seu numero nêutrons é 33, determine os números atômicos e de massa
de todos os elementos.
Gabarito:
1)
2)
3)
4)
5)
6)
7)
8)
D
A
E
C
A
B
C
I e II