Transformações Químicas e o Mundo à Nossa Volta
SÍNTESE
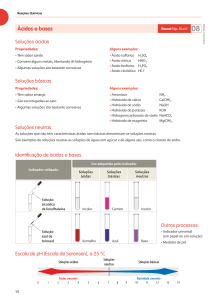
ü As soluções aquosas podem ser ácidas, básicas e neutras.
ü Os ácidos são substâncias que originam soluções aquosas ácidas. As bases originam
soluções aquosas básicas.
ü Uma solução diz-se :
- ácida se lH+l > lOH-l
- neutra se lH+l = lOH-l
- básica se lH+l < lOH-l
ü Os iões H+ são as partículas responsáveis pelas propriedades ácidas das soluções; os iões
HO- são as partículas responsáveis pelas propriedades básicas das soluções.
ü Os indicadores são substâncias que permitem identificar o carácter ácido, básico ou neutro
das soluções aquosas.
ü O valor de pH informa-nos sobre o grau de acidez ou de basicidade. Esta varia entre o 0 e o
14.
Soluções
pH
ácidas
menor que 7
básicas
maior que 7
neutras
igual a 7
ü Quanto maior for o valor de pH, mais básica é a solução. Quanto menor for o valor de pH,
mais ácida é a solução.
ü O pH de uma solução ácida aumenta por adição de uma base. O pH de uma solução básica
diminui por adição de um ácido.
ü O valor de pH de uma solução pode medir-se usando: medidores de pH ou um indicador
universal.
ü As reacções entre soluções aquosas ácidas e básicas designam-se por reacções de ácido-base
ou de neutralização.
ü As soluções ácidas reagem com as soluções básicas, originando sal e água.
Ácido (aq) + Base (aq) ? Água (l) + Sal (aq)
- Ácido
Comportamento
- Neutro
- Básico
ü Os sais são substâncias iónicas. Há sais solúveis e outros são praticamente insolúveis em
água.
ü As reacções químicas durante as quais ocorre a formação de sais insolúveis chamam-se
reacções de precipitação.
ü Os sais insolúveis que se formam designam-se por precipitados.