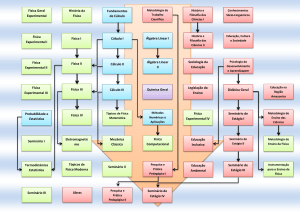
A missão do agente tensioativo
Uma aventura no Laboratório
Professoras orientadoras:
Célia Faustino
Isabel Ribeiro
Catarina Vaz
Teresa Rebelo
O que é um tensioativo?
• São moléculas que têm a capacidade de reduzir a tensão superficial de
uma superfície onde tendem a acumular-se.
• Estas moléculas têm caraterísticas anfifílicas.
Parte hidrofílica
polar
Fig. 1 – Estrutura de uma molécula tensioativa
Parte hidrofóbica
apolar
Utilizações do dia-a-dia
• Detergentes e produtos de limpeza
• Indústria farmacêutica
• Indústria de cosméticos
3%
2%
8%
10%
10%
54%
13%
Detergentes
Têxtil, couro, papel
Petroquímica
Cosmética e farmacêutica
Indústria alimentar
Agroquímica
Outros
Tensioativos no corpo humano
Membrana
celular
Tensioativos
Sistema
respiratório
Ácidos biliares
Produção de tensioativos
• Os primeiros tensioativos utilizados pelo Homem são sais de ácidos
gordos, os tradicionais sabões.
• Eram preparados a partir de gorduras vegetais e animais, combinadas com
sais alcalinos obtidos a partir de cinzas de ossos.
• Atualmente são um dos produtos químicos produzidos em maior
quantidade mundialmente.
• A maior é produzida a partir de derivados de petróleo, contudo tem-se
vindo a procurar utilizar fontes renováveis: biotensioativos.
Micelas
• Os agentes tensioativos, dada a sua natureza anfifílica, têm tendência para
se acumular na superfície de um líquido.
• Caracterizam-se ainda pela sua capacidade de associação em solução,
formando agregados globulares aproximadamente esféricos designados
micelas uma vez atingida uma determinada concentração, designada
concentração micelar crítica (CMC).
Molécula anfifílica
cadeia hidrófobica
(cauda)
grupo hidrofílico
(cabeça)
ar
água
Micela
Parte Experimental
• 1ª Fase: Produção e extração de biotensioativos por via biotecnológica:
- Avaliação do crescimento da levedura S. bombicola
- Avaliação do consumo de glucose
- Estabelecimento de uma relação entre todos os parâmetros estudados
Parte Experimental
• 2ª Fase: Utilização dos tensioativos na indústria farmacêutica
- Incorporação de um fármaco em micelas de diferentes tensioativos e
comparação do seu poder solubilizante
- Estabelecimento do CMC para cada tensioativo e seleção do melhor para
encapsulação do fármaco
Parte experimental – I
• Avaliação do crescimento de S. bombicola pelo método de
Densidade Óptica
- Preparação de meios de cultura e da microplaca
Parte experimental – I
• Avaliação do crescimento de S. bombicola pelo método de
Densidade Óptica
- Leitura das absorvâncias num leitor de placas (0, 3, 6, 8, 14, 24, 48, 72
h) e recolha do conteúdo
Parte experimental – I
• Avaliação do crescimento de S. bombicola pelo método de
Densidade Óptica
- Elaboração da curva de crescimento
Fase de
desaceleração
Fase estacionária
Fase de morte celular
2.5
2
DO600
Fase de
crescimento
exponencial
1.5
1
0.5
0
0
Fase de latência
20
40
tempo (h)
60
80
Parte experimental – I
• Extração dos compostos produzidos
- Remoção da fase superior do meio de cultura e congelação dos estratos
Parte experimental – I
• Avaliação de produção de soforolípidos ao longo do tempo
por cromatografia em camada fina
- Aplicação das amostras na placa de TLC e desenvolvimento na câmara
Parte experimental – I
• Avaliação do consumo de glucose
- Quantificação da glucose pelo método DNS (micrométodo)
Parte experimental – I
• Avaliação do consumo de glucose
- Elaboração da curva de calibração e determinação da concentração de
glucose
Curva de Calibração
25
0.6
y = 0.6787x - 0.0306
R² = 0.9933
20
0.4
Glucose (g/L)
Absorvancia
0.5
0.3
0.2
0.1
15
10
5
0
0
0.2
0.4
Glucose (g/L)
0.6
0.8
1
0
0
20
40
tempo (h)
60
80
Parte experimental – II
• Determinação da CMC de um tensioativo
- Preparação das soluções de SDS.
Parte experimental – II
• Determinação da CMC de um tensioativo
- Leitura de absorvâncias
Parte experimental – II
• Determinação da CMC de um tensioativo
- Representações gráficas
0.60
0.50
Abs média
0.40
0.30
0.20
0.10
0.00
0.0
2.0
4.0
6.0
c / mol L-1
8.0
10.0
Parte experimental – II
• Determinação da CMC de um tensioativo
- Representações gráficas
CMC
70.00
60.00
ΔA/Δc
50.00
40.00
30.00
20.00
10.00
0.00
0.0
1.0
2.0
3.0
4.0
5.0
cmedia / mol
L-1
6.0
7.0
8.0
9.0
Parte experimental – II
• Incorporação de um fármaco em micelas de diferentes
tensioativos
- Construção da curva de calibração (ácido acetilsalicílico)
1.200
y = 0,126*105x - 0,171
R² = 0,995
Absorvância média
1.000
0.800
0.600
0.400
0.200
0.000
0.00
2.00
4.00
6.00
Concentração
(mol L-1)
8.00
10.00
12.00
Parte experimental – II
• Incorporação de um fármaco em micelas de diferentes
tensioativos
- Preparação de soluções.
Parte experimental – II
• Incorporação de um fármaco em micelas de diferentes
tensioativos
- Filtração das soluções
Parte experimental – II
• Incorporação de um fármaco em micelas de diferentes
tensioativos
- Leitura das absorvâncias
Parte experimental – II
• Incorporação de um fármaco em micelas de diferentes
tensioativos
Eficiência de encapsulamento
(%)
- Calculo da eficiência de encapsulamento
100.0
Tensioativo
Classificação
80.0
CMC
MTA
m TA
EE
(mol/L)
(g/mol)
(g)
(%)
60.0
SDS
Aniónico
8x10-3
288,38
0,029
38,5
40.0
DTAC
Catiónico
2x10-2
263,89
0,033
55,0
Tween 80
Não iónico
1,2x10-3
1310
0,013
43,0
NaC
Natural
aniónico
1x10-3
430,55
0,043
3,3
20.0
0.0
SDS
DTAC
Tween
80
Tensioativos
NaDC
Agradecimentos
Agradecemos por esta experiência:
• Professora Dora Brites;
• Professora Célia Faustino;
• Professora Isabel Ribeiro;
• iMed.Ulisboa;
• Faculdade de Farmácia;
• Ciência Viva.