GRUPO 1 – TIPO A
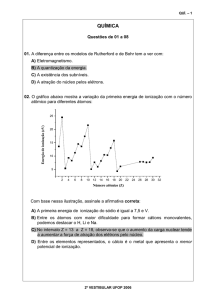
QUÍ.– 11
QUÍMICA
Questões de 09 a 12
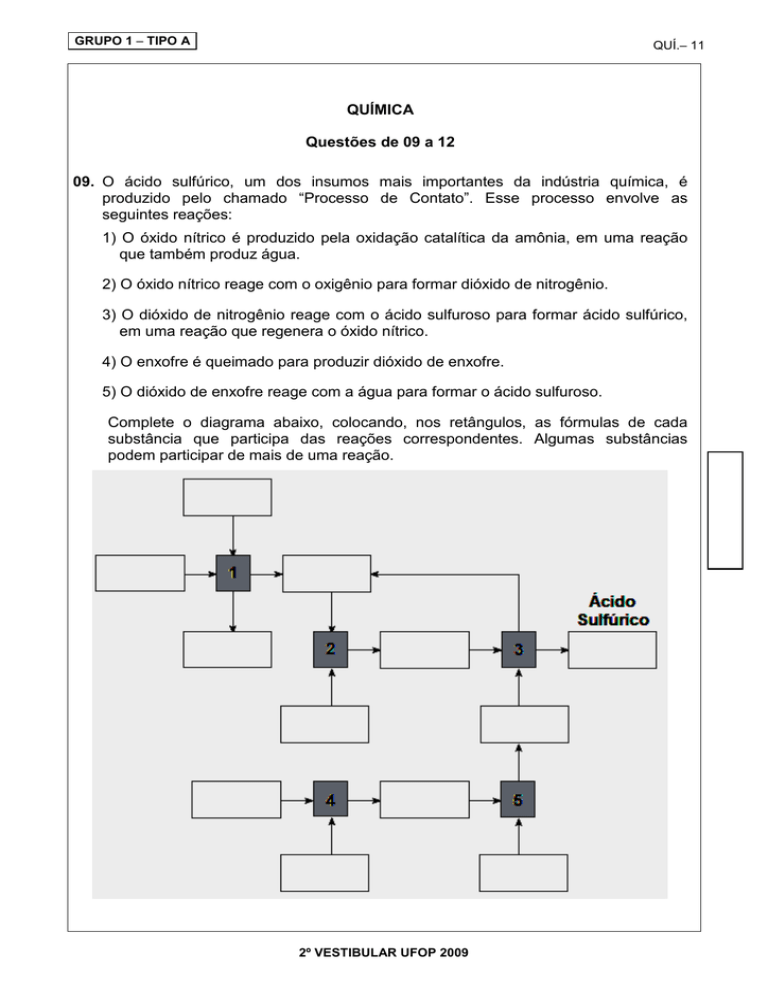
09. O ácido sulfúrico, um dos insumos mais importantes da indústria química, é
produzido pelo chamado “Processo de Contato”. Esse processo envolve as
seguintes reações:
1) O óxido nítrico é produzido pela oxidação catalítica da amônia, em uma reação
que também produz água.
2) O óxido nítrico reage com o oxigênio para formar dióxido de nitrogênio.
3) O dióxido de nitrogênio reage com o ácido sulfuroso para formar ácido sulfúrico,
em uma reação que regenera o óxido nítrico.
4) O enxofre é queimado para produzir dióxido de enxofre.
5) O dióxido de enxofre reage com a água para formar o ácido sulfuroso.
Complete o diagrama abaixo, colocando, nos retângulos, as fórmulas de cada
substância que participa das reações correspondentes. Algumas substâncias
podem participar de mais de uma reação.
2º VESTIBULAR UFOP 2009
QUÍ. – 12
GRUPO 1 – TIPO A
10. Os hidretos metálicos reagem violentamente com a água, e a reação produz
hidrogênio gasoso. Baseando-se nessa afirmação, faça o que se pede.
A) Forneça uma equação química balanceada, mostrando a reação entre hidreto de
cálcio e água.
B) A solução aquosa resultante dessa reação é ácida ou básica? Justifique.
C) Explique, de forma bem sucinta, como se poderia determinar visualmente se a
solução resultante é ácida ou básica.
D) Uma amostra de hidreto de cálcio impuro, pesando 7,5 g, foi adicionada a um
excesso de água, produzindo 6,72 L de hidrogênio gasoso nas CNTP. Calcule o
teor percentual de hidreto de cálcio nessa amostra.
2º VESTIBULAR UFOP 2009
GRUPO 1 – TIPO A
QUÍ.– 13
11. Nas estações de tratamento de esgoto, uma das etapas consiste em reduzir a
atividade biológica com o aumento do pH da água. Isso é feito com a adição de
pequenas quantidades de hidróxido de cálcio à água do esgoto. Um químico
determinou a concentração de hidróxido de cálcio aquoso na água do esgoto,
titulando uma amostra dessa água com ácido clorídrico 5 × 10-3 mol.L-1. Baseandose nessas informações, faça o que se pede.
A) No processo de titulação, 25,0 mL da água de esgoto tratada com hidróxido de
cálcio reagiu com 21,35 mL da solução de ácido clorídrico. Qual a concentração
de hidróxido de cálcio na água de esgoto determinada pelo químico?
B) Após um tratamento posterior, a água pôde ser usada para beber. Na água
–
potável obtida, a concentração de íons OH era 100 vezes maior que a
concentração de íons H+. Calcule o pH dessa água potável.
2º VESTIBULAR UFOP 2009
QUÍ. – 14
GRUPO 1 – TIPO A
12. Considere a transformação a seguir e faça o que se pede.
Cl
NaOH(aq)
A
H2SO4(c)
160 °C
B
H2/catalisador
A) Forneça as fórmulas estruturais dos compostos A, B e C.
B) Classifique a reação de conversão de B em C.
______________________________________________________
C) Indique a classe de compostos orgânicos à qual pertence o composto C.
______________________________________________________
2º VESTIBULAR UFOP 2009
C
2º VESTIBULAR UFOP 2009
7
6
5
4
3
2
1
88,9
57
138,9
89
Sr
87,6
56
Ba
137,3
88
Ra
(226)
Rb
85,5
55
Cs
132,9
87
Fr
(223)
Pa
(231)
Th
91
90
232,0
Pr
140,9
140,1
59
58
Ce
(261)
Rf
104
178,5
Hf
72
91,2
Zr
(227)
Ac
‡
La
†
Y
40
47,9
Ti
22
4
61
(263)
Sg
106
183,8
W
74
95,9
Mo
42
52,0
Cr
24
6
62
(262)
Bh
107
186,2
Re
75
(97)
Tc
43
54,9
Mn
25
7
63
(265)
Hs
108
190,2
Os
76
101,1
Ru
44
55,8
Fe
26
8
1,0
H
1
238,0
U
92
144,2
(237)
Np
93
(145)
(242)
Pu
94
150,4
96
157,3
Gd
64
(266)
Mt
109
192,2
Ir
77
102,9
Rh
45
58,9
Co
27
9
97
158,9
Tb
65
195,1
Pt
78
106,4
Pd
46
58,7
Ni
28
10
(243)
(247)
(247)
(251)
Cf
98
162,5
Dy
66
197,0
Au
79
107,9
Ag
47
63,5
Cu
29
11
Massa atômica
Am Cm Bk
95
152,0
Nd Pm Sm Eu
60
(262)
Db
105
180,9
Ta
73
92,9
Nb
41
50,9
V
23
5
Número atômico
(252)
Es
99
164,9
Ho
67
200,6
Hg
80
112,4
Cd
48
65,4
Zn
30
12
101
168,9
Tm
69
207,2
Pb
82
118,7
Sn
50
72,6
Ge
32
28,1
Si
14
12,0
C
6
14
(257)
(258)
Fm Md
100
167,3
Er
68
204,4
Tl
81
114,8
In
49
69,7
Ga
31
27,0
Al
13
10,8
B
5
13
(259)
No
102
173,0
Yb
70
209,0
Bi
83
121,8
Sb
51
74,9
As
33
31,0
P
15
14,0
N
7
15
(260)
Lr
103
175,0
Lu
71
(209)
Po
84
127,6
Te
52
79,0
Se
34
32,1
S
16
16,0
O
8
16
(210)
At
85
126,9
I
53
79,9
Br
35
35,5
Cl
17
19,0
F
9
17
(222)
Rn
86
131,3
Xe
54
83,8
Kr
36
39,9
Ar
18
20,2
Ne
10
4,0
He
2
18
* Nova numeração dos grupos, segundo recomendação da IUPAC de 1990. Símbolos dos elementos 104 a 109 de acordo com recomendação da IUPAC de 1997.
‡
†
39
38
37
Sc
45,0
21
3
40,1
24,3
23,0
Ca
Mg
Na
K
12
11
39,1
9,0
6,9
20
Be
Li
19
4
2
3
1,0
H
1
1
Tabela Periódica*
MAT. – 10
GRUPO 1 – TIPO B
GRUPO 1 – TIPO B
11
QUÍMICA
Questões de 09 a 12
09. Considere a transformação a seguir e faça o que se pede.
Cl
NaOH(aq)
A
H2SO4(c)
160 °C
B
H2/catalisador
A) Forneça as fórmulas estruturais dos compostos A, B e C.
B) Classifique a reação de conversão de B em C.
______________________________________________________
C) Indique a classe de compostos orgânicos à qual pertence o composto C.
______________________________________________________
2º VESTIBULAR UFOP 2009
C
MAT. – 12
GRUPO 1 – TIPO B
10. O ácido sulfúrico, um dos insumos mais importantes da indústria química, é
produzido pelo chamado “Processo de Contato”. Esse processo envolve as
seguintes reações:
1) O óxido nítrico é produzido pela oxidação catalítica da amônia, em uma reação
que também produz água.
2) O óxido nítrico reage com o oxigênio para formar dióxido de nitrogênio.
3) O dióxido de nitrogênio reage com o ácido sulfuroso para formar ácido sulfúrico,
em uma reação que regenera o óxido nítrico.
4) O enxofre é queimado para produzir dióxido de enxofre.
5) O dióxido de enxofre reage com a água para formar o ácido sulfuroso.
Complete o diagrama abaixo, colocando, nos retângulos, as fórmulas de cada
substância que participa das reações correspondentes. Algumas substâncias
podem participar de mais de uma reação.
2º VESTIBULAR UFOP 2009
GRUPO 1 – TIPO B
13
11. Os hidretos metálicos reagem violentamente com a água, e a reação produz
hidrogênio gasoso. Baseando-se nessa afirmação, faça o que se pede.
A) Forneça uma equação química balanceada, mostrando a reação entre hidreto de
cálcio e água.
B) A solução aquosa resultante dessa reação é ácida ou básica? Justifique.
C) Explique, de forma bem sucinta, como se poderia determinar visualmente se a
solução resultante é ácida ou básica.
D) Uma amostra de hidreto de cálcio impuro, pesando 7,5 g, foi adicionada a um
excesso de água, produzindo 6,72 L de hidrogênio gasoso nas CNTP. Calcule o
teor percentual de hidreto de cálcio nessa amostra.
2º VESTIBULAR UFOP 2009
MAT. – 14
GRUPO 1 – TIPO B
12. Nas estações de tratamento de esgoto, uma das etapas consiste em reduzir a
atividade biológica com o aumento do pH da água. Isso é feito com a adição de
pequenas quantidades de hidróxido de cálcio à água do esgoto. Um químico
determinou a concentração de hidróxido de cálcio aquoso na água do esgoto,
titulando uma amostra dessa água com ácido clorídrico 5 × 10-3 mol.L-1. Baseandose nessas informações, faça o que se pede.
A) No processo de titulação, 25,0 mL da água de esgoto tratada com hidróxido de
cálcio reagiu com 21,35 mL da solução de ácido clorídrico. Qual a concentração
de hidróxido de cálcio na água de esgoto determinada pelo químico?
B) Após um tratamento posterior, a água pôde ser usada para beber. Na água
–
potável obtida, a concentração de íons OH era 100 vezes maior que a
concentração de íons H+. Calcule o pH dessa água potável.
2º VESTIBULAR UFOP 2009
2º VESTIBULAR UFOP 2009
7
6
5
4
3
2
1
6
7
39
138,9
89
38
Sr
87,6
56
Ba
137,3
88
Ra
(226)
37
Rb
85,5
55
Cs
132,9
87
Fr
(223)
9
Y
Pa
(231)
Th
91
90
232,0
Pr
140,9
140,1
59
58
Ce
(261)
Rf
104
178,5
Hf
72
91,2
Zr
(227)
Ac
‡
57
La
†
88,9
40
47,9
Ti
22
61
(263)
Sg
106
183,8
W
74
95,9
Mo
42
52,0
Cr
24
62
(262)
Bh
107
186,2
Re
75
(97)
Tc
43
54,9
Mn
25
63
(265)
Hs
108
190,2
Os
76
101,1
Ru
44
55,8
Fe
26
238,0
U
92
144,2
(237)
Np
93
(145)
(242)
Pu
94
150,4
96
157,3
Gd
64
(266)
Mt
109
192,2
Ir
77
102,9
Rh
45
58,9
Co
27
97
158,9
Tb
65
195,1
Pt
78
106,4
Pd
46
58,7
Ni
28
(243)
(247)
(247)
Am Cm Bk
95
152,0
Nd Pm Sm Eu
60
(262)
Db
105
180,9
Ta
73
92,9
Nb
41
50,9
V
23
10
(251)
Cf
98
162,5
Dy
66
197,0
Au
79
107,9
Ag
47
63,5
Cu
29
11
12
(252)
Es
99
164,9
Ho
67
200,6
Hg
80
112,4
Cd
48
65,4
Zn
30
Al
101
168,9
Tm
69
207,2
Pb
82
118,7
Sn
50
72,6
Ge
32
28,1
Si
(257)
(258)
Fm Md
100
167,3
Er
68
204,4
Tl
81
114,8
In
49
69,7
Ga
31
27,0
14
12,0
C
6
14
(259)
No
102
173,0
Yb
70
209,0
Bi
83
121,8
Sb
51
74,9
As
33
31,0
P
15
14,0
N
7
15
(260)
Lr
103
175,0
Lu
71
(209)
Po
84
127,6
Te
52
79,0
Se
34
32,1
S
16
16,0
O
8
16
(210)
At
85
126,9
I
53
79,9
Br
35
35,5
Cl
17
19,0
F
9
17
(222)
Rn
86
131,3
Xe
54
83,8
Kr
36
39,9
Ar
18
20,2
Ne
10
4,0
He
2
18
* Nova numeração dos grupos, segundo recomendação da IUPAC de 1990. Símbolos dos elementos 104 a 109 de acordo com recomendação da IUPAC de 1997.
‡
†
45,0
40,1
Sc
Ca
K
39,1
21
20
19
8
24,3
23,0
5
Mg
Na
4
12
11
3
13
9,0
B
10,8
Be
6,9
Massa atômica
5
13
Li
1,0
H
1
4
2
Número atômico
3
1,0
H
1
1
Tabela Periódica*
GRUPO 2 – TIPO A
QUÍ.– 7
QUÍ. – 8
GRUPO 2 – TIPO A
QUÍMICA
Questões de 07 a 12
07. A tabela apresentada a seguir mostra algumas energias de ionização (E.I.) para três
metais, designados por X, Y e Z.
Metais
X
Y
Z
1ª E.I.
738
578
496
2ª E.I.
1451
1820
4560
3ª E.I.
7733
2750
4ª E.I.
11600
Baseando-se nessa tabela e em seus conhecimentos de Química, resolva as
questões propostas.
A) Qual a fórmula química dos óxidos binários formados com X, Y e Z?
________________
________________
________________
B) Explique a grande diferença observada na 3ª e 4ª energias de ionização de Y.
C) Os elementos X, Y e Z pertencem a quais grupos da tabela periódica?
Elemento X: _______________________________
Elemento Y: _______________________________
Elemento Z: _______________________________
2º VESTIBULAR UFOP 2009
GRUPO 2 – TIPO A
QUÍ.– 9
08. Algumas reações do ferro são mostradas no seguinte fluxograma:
Sabendo-se que o número de oxidação do ferro no sólido A é maior que na solução
B, forneça a fórmula e o nome de cada uma das substâncias A a E.
A) _________________
_____________________________________
B) _________________
_____________________________________
C) _________________
_____________________________________
D) _________________
_____________________________________
E) _________________
_____________________________________
2º VESTIBULAR UFOP 2009
QUÍ. – 10
GRUPO 2 – TIPO A
09. Os fertilizantes à base de superfosfatos contêm o dihidrogenofosfato de cálcio,
Ca(H2PO4)2. Esse composto é um dos principais fertilizantes existentes e, quando
—
dissolvido em água, dissocia-se, formando íons H2PO4 , que são facilmente
—
assimilados pelas plantas. Os íons H2PO4 podem atuar tanto como ácido quanto
como base, e uma solução aquosa de Ca(H2PO4)2 pode ser usada como uma
solução tampão. Com base nessas informações, faça o que é proposto.
A) O Ca(H2PO4)2 é produzido a partir do tratamento de uma rocha fosfática, que
contém Ca3(PO4)2, com ácido sulfúrico. Escreva uma equação balanceada para
esse processo.
—
B) Dê a fórmula do ácido conjugado do H2PO4 : ___________________________
—
C) Dê a fórmula da base conjugada do H2PO4 : ____________________________
D) Explique sucintamente o que se entende por solução tampão.
2º VESTIBULAR UFOP 2009
GRUPO 2 – TIPO A
QUÍ.– 11
10. A reação entre óxido nítrico e hidrogênio foi investigada em temperaturas acima de
150º C, utilizando-se um aparelho, mostrado simplificadamente a seguir. Óxido
nítrico e hidrogênio são introduzidos pela entrada do aparelho, e a torneira é
fechada.
A equação para a reação é: 2 NO(g) + 2 H2(g) → N2
equação, faça o que é solicitado.
(g)
+ 2 H2O(g). A partir dessa
A) Indique e justifique o que acontece com os níveis de mercúrio nos dois lados do
aparelho, à medida que a reação ocorre.
B) Considerando que o volume molar do nitrogênio nas condições do experimento é
25,0 L.mol-1, calcule a massa de nitrogênio obtida quando 500 cm3 de óxido
nítrico reagem completamente com hidrogênio.
2º VESTIBULAR UFOP 2009
QUÍ. – 12
GRUPO 2 – TIPO A
11. Isômeros são compostos que apresentam a mesma fórmula molecular. Com base
nessa informação, faça o que se pede.
A) O composto X tem a fórmula CH3CH(OH)CH3. Forneça o nome do composto X e
a fórmula estrutural de seu isômero de posição.
Nome do composto: ____________________________________
Fórmula do isômero:
B) O composto Y tem a fórmula (CH3)2C=C(CH3)2. Forneça o nome do composto Y e
a fórmula estrutural de um isômero de cadeia desse composto.
Nome do composto: ____________________________________
Fórmula do isômero:
C) O composto Z tem a fórmula CH3CH2COCH2CH3. Forneça o nome do composto
Z e a fórmula estrutural de um isômero de função desse composto, que contenha
um grupo carbonila.
Nome do composto: ____________________________________
Fórmula do isômero:
2º VESTIBULAR UFOP 2009
GRUPO 2 – TIPO A
QUÍ.– 13
12. A lovastatina é um fármaco utilizado no tratamento de hipercolesterolemias e ativo
graças à sua biotransformação no composto não-lactônico, conforme o seguinte
esquema.
HO
O
HO
O
O
O
O
COOH
OH
O
Lovastatina
Composto Ativo
Baseando-se nesse esquema, faça o que se pede.
A) Na biotransformação, o anel lactônico da lovastatina é hidrolisado. Cite as
funções orgânicas resultantes desse processo.
B) Explicite o número de átomos de carbono que apresentam hibridação sp2 nos
dois compostos.
2º VESTIBULAR UFOP 2009
QUÍ. – 14
GRUPO 2 – TIPO A
C) Identifique o número de grupos metila substituintes presentes na estrutura dos
dois compostos. Marque esses grupos com um círculo na estrutura da
lovastatina.
D) Identifique o número de carbonos quirais presentes na estrutura dos dois
compostos. Marque esses carbonos quirais com um asterisco na estrutura do
composto ativo.
2º VESTIBULAR UFOP 2009
2º VESTIBULAR UFOP 2009
7
6
5
4
3
2
1
6
7
39
138,9
89
38
Sr
87,6
56
Ba
137,3
88
Ra
(226)
37
Rb
85,5
55
Cs
132,9
87
Fr
(223)
9
Y
Pa
(231)
Th
91
90
232,0
Pr
140,9
140,1
59
58
Ce
(261)
Rf
104
178,5
Hf
72
91,2
Zr
(227)
Ac
‡
57
La
†
88,9
40
47,9
Ti
22
61
(263)
Sg
106
183,8
W
74
95,9
Mo
42
52,0
Cr
24
62
(262)
Bh
107
186,2
Re
75
(97)
Tc
43
54,9
Mn
25
63
(265)
Hs
108
190,2
Os
76
101,1
Ru
44
55,8
Fe
26
238,0
U
92
144,2
(237)
Np
93
(145)
(242)
Pu
94
150,4
96
157,3
Gd
64
(266)
Mt
109
192,2
Ir
77
102,9
Rh
45
58,9
Co
27
97
158,9
Tb
65
195,1
Pt
78
106,4
Pd
46
58,7
Ni
28
(243)
(247)
(247)
Am Cm Bk
95
152,0
Nd Pm Sm Eu
60
(262)
Db
105
180,9
Ta
73
92,9
Nb
41
50,9
V
23
10
(251)
Cf
98
162,5
Dy
66
197,0
Au
79
107,9
Ag
47
63,5
Cu
29
11
12
(252)
Es
99
164,9
Ho
67
200,6
Hg
80
112,4
Cd
48
65,4
Zn
30
Al
101
168,9
Tm
69
207,2
Pb
82
118,7
Sn
50
72,6
Ge
32
28,1
Si
(257)
(258)
Fm Md
100
167,3
Er
68
204,4
Tl
81
114,8
In
49
69,7
Ga
31
27,0
14
12,0
C
6
14
(259)
No
102
173,0
Yb
70
209,0
Bi
83
121,8
Sb
51
74,9
As
33
31,0
P
15
14,0
N
7
15
(260)
Lr
103
175,0
Lu
71
(209)
Po
84
127,6
Te
52
79,0
Se
34
32,1
S
16
16,0
O
8
16
(210)
At
85
126,9
I
53
79,9
Br
35
35,5
Cl
17
19,0
F
9
17
(222)
Rn
86
131,3
Xe
54
83,8
Kr
36
39,9
Ar
18
20,2
Ne
10
4,0
He
2
18
* Nova numeração dos grupos, segundo recomendação da IUPAC de 1990. Símbolos dos elementos 104 a 109 de acordo com recomendação da IUPAC de 1997.
‡
†
45,0
40,1
Sc
Ca
K
39,1
21
20
19
8
24,3
23,0
5
Mg
Na
4
12
11
3
13
9,0
B
10,8
Be
6,9
Massa atômica
5
13
Li
1,0
H
1
4
2
Número atômico
3
1,0
H
1
1
Tabela Periódica*
GRUPO 2 – TIPO B
QUÍ.– 7
QUÍ. – 8
GRUPO 2 – TIPO B
QUÍMICA
Questões de 07 a 12
07. A lovastatina é um fármaco utilizado no tratamento de hipercolesterolemias e ativo
graças à sua biotransformação no composto não-lactônico, conforme o seguinte
esquema.
HO
O
HO
O
O
O
O
COOH
OH
O
Lovastatina
Composto Ativo
Baseando-se nesse esquema, faça o que se pede.
A) Na biotransformação, o anel lactônico da lovastatina é hidrolisado. Cite as
funções orgânicas resultantes desse processo.
2º VESTIBULAR UFOP 2009
GRUPO 2 – TIPO B
QUÍ.– 9
B) Explicite o número de átomos de carbono que apresentam hibridação sp2 nos
dois compostos.
C) Identifique o número de grupos metila substituintes presentes na estrutura dos
dois compostos. Marque esses grupos com um círculo na estrutura da
lovastatina.
D) Identifique o número de carbonos quirais presentes na estrutura dos dois
compostos. Marque esses carbonos quirais com um asterisco na estrutura do
composto ativo.
2º VESTIBULAR UFOP 2009
QUÍ. – 10
GRUPO 2 – TIPO B
08. A tabela apresentada a seguir mostra algumas energias de ionização (E.I.) para três
metais, designados por X, Y e Z.
Metais
X
Y
Z
1ª E.I.
738
578
496
2ª E.I.
1451
1820
4560
3ª E.I.
7733
2750
4ª E.I.
11600
Baseando-se nessa tabela e em seus conhecimentos de Química, resolva as
questões propostas.
A) Qual a fórmula química dos óxidos binários formados com X, Y e Z?
________________
________________
________________
B) Explique a grande diferença observada na 3ª e 4ª energias de ionização de Y.
C) Os elementos X, Y e Z pertencem a quais grupos da tabela periódica?
Elemento X: _______________________________
Elemento Y: _______________________________
Elemento Z: _______________________________
2º VESTIBULAR UFOP 2009
GRUPO 2 – TIPO B
QUÍ.– 11
09. Algumas reações do ferro são mostradas no seguinte fluxograma:
Sabendo-se que o número de oxidação do ferro no sólido A é maior que na solução
B, forneça a fórmula e o nome de cada uma das substâncias A a E.
A) _________________
_____________________________________
B) _________________
_____________________________________
C) _________________
_____________________________________
D) _________________
_____________________________________
E) _________________
_____________________________________
2º VESTIBULAR UFOP 2009
QUÍ. – 12
GRUPO 2 – TIPO B
10. Os fertilizantes à base de superfosfatos contêm o dihidrogenofosfato de cálcio,
Ca(H2PO4)2. Esse composto é um dos principais fertilizantes existentes e, quando
—
dissolvido em água, dissocia-se, formando íons H2PO4 , que são facilmente
—
assimilados pelas plantas. Os íons H2PO4 podem atuar tanto como ácido quanto
como base, e uma solução aquosa de Ca(H2PO4)2 pode ser usada como uma
solução tampão. Com base nessas informações, faça o que é proposto.
A) O Ca(H2PO4)2 é produzido a partir do tratamento de uma rocha fosfática, que
contém Ca3(PO4)2, com ácido sulfúrico. Escreva uma equação balanceada para
esse processo.
—
B) Dê a fórmula do ácido conjugado do H2PO4 : ___________________________
—
C) Dê a fórmula da base conjugada do H2PO4 : ____________________________
D) Explique sucintamente o que se entende por solução tampão.
2º VESTIBULAR UFOP 2009
GRUPO 2 – TIPO B
QUÍ.– 13
11. A reação entre óxido nítrico e hidrogênio foi investigada em temperaturas acima de
150º C, utilizando-se um aparelho, mostrado simplificadamente a seguir. Óxido
nítrico e hidrogênio são introduzidos pela entrada do aparelho, e a torneira é
fechada.
A equação para a reação é: 2 NO(g) + 2 H2(g) → N2
equação, faça o que é solicitado.
(g)
+ 2 H2O(g). A partir dessa
A) Indique e justifique o que acontece com os níveis de mercúrio nos dois lados do
aparelho, à medida que a reação ocorre.
B) Considerando que o volume molar do nitrogênio nas condições do experimento é
25,0 L.mol-1, calcule a massa de nitrogênio obtida quando 500 cm3 de óxido
nítrico reagem completamente com hidrogênio.
2º VESTIBULAR UFOP 2009
QUÍ. – 14
GRUPO 2 – TIPO B
12. Isômeros são compostos que apresentam a mesma fórmula molecular. Com base
nessa informação, faça o que se pede.
A) O composto X tem a fórmula CH3CH(OH)CH3. Forneça o nome do composto X e
a fórmula estrutural de seu isômero de posição.
Nome do composto: ____________________________________
Fórmula do isômero:
B) O composto Y tem a fórmula (CH3)2C=C(CH3)2. Forneça o nome do composto Y e
a fórmula estrutural de um isômero de cadeia desse composto.
Nome do composto: ____________________________________
Fórmula do isômero:
C) O composto Z tem a fórmula CH3CH2COCH2CH3. Forneça o nome do composto
Z e a fórmula estrutural de um isômero de função desse composto, que contenha
um grupo carbonila.
Nome do composto: ____________________________________
Fórmula do isômero:
2º VESTIBULAR UFOP 2009