PETRÓLEO E SEUS DERIVADOS
Figura 1 – Objetos de plásticos
Fonte: Africa Studio/Shutterstock.com
CONTEÚDOS
Fonte de matéria-prima de compostos sintéticos: o petróleo
Principais substâncias presentes e separação dos derivados do petróleo
Propriedades do átomo de carbono
Cadeias carbônicas
AMPLIANDO SEUS CONHECIMENTOS
O que você sabe sobre os plásticos? Na imagem acima, estão representados alguns
objetos de plástico muito comuns: o balde, os frascos, as escovas e a luvas.
É fato que esse material trouxe muitos benefícios devido às suas propriedades: é leve,
moldável, pode ser do tipo elástico (flexível) ou fixo (rígido), não quebra como os vidros,
não oxida como os metais, é impermeável, portanto pode substituir o papel, o papelão,
o tecido etc.
Os plásticos, que são materiais sintéticos, são produzidos a partir de uma única matériaprima, que são os derivados do petróleo, uma fonte não renovável. A partir desses
derivados, podemos sintetizar vários compostos para diferentes finalidades, desde
insumos1 industriais, reagentes laboratoriais, substâncias que colaboram para o
desenvolvimento técnico-científico e para o bem-estar da sociedade no geral.
O petróleo
O petróleo é uma substância oleosa, inflamável, menos densa que a água, com cheiro
característico e cor variando entre o negro e o castanho escuro. A origem deste óleo
está associada à decomposição dos seres vivos (animais marítimos e vegetais), em
meio a pouca oxigenação e pela ação de bactérias. Ao longo de milhões de anos, esses
seres decompostos foram se acumulando no fundo dos mares e dos lagos, sendo
pressionados pelos movimentos da crosta terrestre e transformados na substância
oleosa que é o petróleo. Ao contrário do que se pensa, ele não permanece na rocha em
que foi gerado, mas desloca-se até encontrar um terreno apropriado para se concentrar.
Esses terrenos são denominados bacias sedimentares, formadas por camadas ou
lençóis porosos de areia, arenitos ou calcário. O petróleo aloja-se nesses locais,
ocupando os poros rochosos, acumulando-se e formando as jazidas. As condições em
que se formou o petróleo também foram propícias para a formação do gás natural. É
por isso que em muitos depósitos de petróleo encontram-se também o gás natural.
A importância da química orgânica não se restringe aos estudos dos plásticos e dos
materiais sintéticos. De fato, todo o mundo natural, exceto rochas e oceanos, consiste
de compostos orgânicos. A química orgânica é base do funcionamento de todos os
organismos vivos. Os compostos orgânicos naturais são responsáveis pelas cores e
odores das flores e da vegetação e pelo sabor dos alimentos. Enfim, são inúmeros os
compostos de carbono naturais e artificiais.
Composição do petróleo
A composição química do petróleo varia muito dependendo do lugar em que foi formado
e encontrado, por isso, é muito difícil saber quais são as substâncias presentes e a
concentração delas. No entanto, sabe-se que os elementos carbono e hidrogênio são
os elementos mais abundantes, seguidos por enxofre (~ 10%), oxigênio (~ 5%),
nitrogênio (~ 1%) e vários elementos metálicos como níquel, vanádio, ferro, alumínio,
1
Insumo: matéria-prima para produzir outros materiais.
sódio, cálcio, cobre e urânio (~ 1000 ppm). Esses elementos estão combinados
formando uma mistura complexa de compostos orgânicos.
As substâncias orgânicas presentes no petróleo são, principalmente, formadas apenas
pelos elementos carbono (C) e hidrogênio (H). Essas substâncias recebem um nome
especial, são conhecidas como hidrocarbonetos.
Existem inúmeros hidrocarbonetos e o mais simples deles é o metano, composto de
fórmula molecular CH4. Este composto é principal componente do gás natural e é
utilizado como combustível. Nas condições ambiente é um gás, e a molécula de metano
não é estática, ela está em constante movimento. No plano, em duas dimensões,
podemos representar o metano da seguinte forma:
Figura 2 – Fórmula estrutural do metano
Considerando somente os elementos carbono e hidrogênio, como é possível existir uma
infinidade de hidrocarbonetos? O segredo está nas propriedades do átomo de carbono.
Propriedades do átomo de carbono
O átomo de carbono apresenta algumas propriedades que o tornam especial, de tal
forma que permitem a formação de um número muito grande de compostos orgânicos.
O átomo de carbono é tetravalente: isso quer dizer que o átomo possui 4 elétrons
livres e pode realizar 4 ligações covalentes com outros átomos.
Tipos de ligações: o átomo de carbono pode compartilhar, com outro átomo de
carbono, um, dois ou três pares de elétrons por meio de ligações simples, dupla ou
tripla.
Figura 3 – Tipos de ligações
Formação de cadeias: como o átomo de carbono pode fazer 4 ligações, há
possibilidade de formação de cadeias carbônicas, por exemplo:
Figura 4 – Cadeias carbônicas
Classificação dos átomos de carbono nas cadeias carbônicas
Em uma cadeia carbônica é possível classificar os átomos de carbono, de acordo com
o número de átomos de carbono ligados à ele.
Carbono primário: ligado a somente um átomo de carbono
Figura 5 – Estrutura com átomos de C primários
Observe que o C1 está ligado ao C2, e este, por sua vez, está ligado ao C1. Os dois
átomos de carbono são primários.
Observação
Para simplificar, podemos representar a fórmula estrutural do composto acima da
seguinte forma:
Note que cada átomo de carbono faz quatro ligações químicas!
Muitas vezes, as fórmulas estruturais são representadas de forma simplificada.
Carbono secundário: ligado a dois átomos de carbono
Figura 6 – Estrutura com carbono secundário
Os átomos C1 e C3 são primários e o átomo C2 é secundário, pois está ligado a dois
átomos de carbono, ao C1 e C3.
Carbono terciário: ligado a três átomos de carbono.
Figura 7 – Estrutura com carbono terciário
O átomo C* está ligado aos átomos C1, C2 e C3, logo, C* é terciário.
Carbono quaternário: ligado a quatro átomos de carbono.
O átomo central, C*, é quaternário, está ligado aos átomos C1, C2, C3 e C4.
Figura 8 – Estrutura com carbono quaternário
Atenção
Para classificar os átomos de carbono de um composto orgânico, não importa o tipo de
ligação (simples, dupla ou tripla), e sim, com quantos átomos de carbono ele está ligado.
Observe o composto representado a seguir.
Os átomos de carbono C1, C5 e C4 são
primários.
C4 faz tripla ligação com C3, mas está
ligado somente com esse átomo de
carbono, desta forma, é primário.
Figura 9 – Composto orgânico e os átomos
C2 é terciário.
C3 faz uma ligação simples com C2 e uma
tripla com C4. Como está ligado a dois
de carbono
átomos de carbono, ele é secundário.
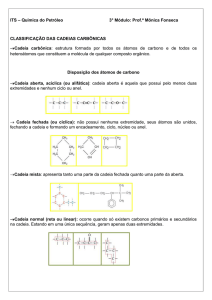
Tipos de cadeias carbônicas
A existência de uma grande variedade de cadeias carbônicas nos leva a classificá-las
segundo os critérios:
Quanto ao fechamento da cadeia
a) Cadeia aberta ou acíclica: quando os átomos de carbono se ligam de maneira
que não formam um ciclo. Na cadeia aberta, obrigatoriamente devem ter átomos
de carbono primários, que não sejam de ramificação2.
Figura 10 – Cadeias abertas
b) Cadeia fechada ou cíclica: quando há fechamento da cadeia, formando-se um
ciclo, núcleo ou anel.
2
Ramificação: ramo que sai da cadeia principal que apresenta carbono terciário ou quaternário.
Figura 11 – Cadeia fechada ou cíclica
Na cadeia principal (fechada) não há átomos de carbono primários.
Quanto à disposição dos átomos de carbono
a) Cadeia normal: quando a cadeia apresenta uma sequência única, ela é linear.
Figura 12 – Cadeias normais
A cadeia linear apresenta somente átomos de carbono primários e secundários.
b) Cadeia ramificada: quando, na cadeia, surgem ramos ou ramificações.
Figura 13 – Cadeias ramificadas
Na cadeia principal, há átomos de carbono terciário e quaternário, de onde saem as
ramificações. Considera-se como a cadeia principal, a cadeia com maior número de
átomos de carbono, ou seja, a mais longa.
Quanto aos tipos de ligação
a) Cadeia saturada: quando só existem ligações simples entre os átomos de carbono.
Figura 14 – Cadeias saturadas
b) Cadeia insaturada: quando, além das ligações simples, aparecem ligações
duplas ou triplas, entre átomos de carbono.
Figura 15 – Cadeias insaturadas
A insaturação deve obrigatoriamente estar na cadeia principal. Não existe
ramificação instaurada.
Quanto à natureza dos átomos
a) Cadeia homogênea: quando, na cadeia, só existem átomos de carbono.
Figura 16 – Cadeias homogêneas
b) Cadeia heterogênea: quando, na cadeia, além dos átomos de carbono, existem
outros átomos (heteroátomos).
Figura 17 – Cadeias heterogêneas
Observe pela estrutura apresentada, que o átomo de oxigênio realiza duas ligações, e
o átomo de nitrogênio três ligações. Esses átomos também podem fazer duplas ou
triplas ligações covalentes com outros átomos.
ATIVIDADES
1. Analise as afirmações e classifique em verdadeiro (V) ou falso (F).
a)
(
)
Os derivados do petróleo são separados na refinaria, por destilação
simples.
b)
(
)
Nas cadeias carbônicas normais existem somente átomos de carbono
primário e secundário.
c)
(
)
Cadeias fechadas ou cíclicas não podem ser insaturadas.
d)
(
)
Nas cadeias insaturadas, obrigatoriamente há um carbono terciário.
e)
(
)
A cadeia mais simples que apresenta um carbono quaternário tem no total
5 átomos de carbono.
2. Classifique os átomos de carbono numerados em primário, secundário, terciário ou
quaternário.
Observação: As estruturas estão representadas simplificadamente, sem os átomos
de hidrogênio.
C1 = _________________________
a)
C2 = _________________________
C3 = _________________________
C4 = _________________________
b)
C1 = _________________________
C2 = _________________________
C3 = _________________________
Observação: Se apresentar dificuldade em visualizar
C4 = _________________________
os átomos, consulte a fórmula estrutural com os
átomos de C.
c)
C1 = _________________________
C2 = _________________________
C3 = _________________________
C1 = _________________________
d)
C2 = _________________________
C3 = _________________________
C4 = _________________________
C5 = _________________________
C6 = _________________________
3. Classifique as cadeias em:
aberta ou fechada;
normal ou ramificada;
saturada ou insaturada;
homogênea ou heterogênea
a)
b)
c)
d)
e)
4. Complete as ligações faltantes dos átomos de carbono com os átomos de hidrogênio
(H) e escreva a fórmula molecular dos compostos da questão 4.
a)
b)
c)
d)
e)
LEITURA COMPLEMENTAR
Derivados do petróleo e a destilação fracionada
O petróleo é mistura complexa de hidrocarbonetos, desde substâncias de cadeias
simples com poucos átomos de carbono, até substâncias mais complexas de cadeias
longas, ramificadas e insaturadas. Da forma como é encontrada, uma mistura de
diversos compostos, o petróleo cru não tem utilidade. É preciso separar as substâncias
ou grupos de substâncias, transformá-las, para então, torná-las úteis.
Como as substâncias presentes na mistura apresentam ponto de ebulição próximos, a
separação é feita por destilação fracionada, método pelo qual os compostos são
separados por diferença de ponto de ebulição.
A destilação fracionada é como uma destilação simples, mas que acontece de forma
repetida. O aparelho da destilação fracionada tem uma coluna comprida por onde
sobem os vapores da mistura que se condensam várias vezes até que saem os
componentes puros separadamente.
Na prática, a separação dos componentes do petróleo ocorre na refinaria, e o processo
é chamado de refino do petróleo.
Na refinaria, é muito difícil separar cada componente, o que é possível obter são as
frações do petróleo. Seguem as principais frações e seus usos.
N° de átomos de
Nome da fração
carbono
Faixa de ebulição
Usos
Combustível
gasoso, matéria-
C1 a C4
Gás de petróleo
160°C a 30 °C
prima para a
produção de
hidrogênio.
Combustível para
veículos à
C5 a C12
Nafta
30 °C a 200 °C
combustão,
indústria
petroquímica.
C12 a C18
180 °C a 400 °C
Acima de C17
Ao redor de 350 °C
Querosene
Óleo lubrificante
Parafinas
Asfalto
Acima de C20
Mais de C36
Sólidos de baixo
ponto de fusão
Resíduos
Combustíveis para
jatos, aviões.
Óleo de
lubrificação.
Velas e vaselina.
Asfalto para
pavimentação.
O petróleo é a grande fonte de matéria-prima para os materiais sintéticos. É muito difícil
imaginar o nosso dia a dia sem esses materiais, que estão presentes em diversos
setores: alimentício, automobilístico, combustíveis, construção civil, têxtil, tintas,
resinas, enfim, quase tudo que usamos, direta ou indiretamente, foi fabricado a partir de
um derivado do petróleo.
INDICAÇÕES
Assista a web aula “Compostos orgânicos e suas representações”. Nesta aula são
abordados alguns compostos orgânicos e a sua importância para a percepção do mundo
físico pelos cinco sentidos. Além disso, são apresentadas algumas funções orgânicas e
as representações por fórmula molecular e estrutural. Assistir à essa web aula será uma
oportunidade para revisar a introdução aos estudos da química orgânica, parte da
Química onde são estudados, principalmente, os compostos de carbono e hidrogênio.
O programa está disponível no Portal EJ@, na Biblioteca digital da área de Ciências da
Natureza do Ensino Médio.
Além desta web aula, ouça o podcast de Plásticos, de maneira descontraída e rápida
você poderá aprimorar seus conhecimentos sobre os compostos orgânicos e os
plásticos. Realize a atividade que acompanha o podcast, Sequência didática, que está
disponível na mesma área. Ao resolver a atividade, você aplicará seus conhecimentos
sobre as propriedades do átomo de carbono, que viabilizam a existência de inúmeros
compostos orgânicos, sobre a classificação dos átomos de carbono, e reconhecerá os
compostos orgânicos por meio das fórmulas molecular e estrutural.
Aproveite para assistir o episódio A química da pastilha elástica (goma de mascar), da
série A Química das coisas. Você vai se surpreender que derivados do petróleo são
utilizados para a fabricação de goma de mascar, o chiclete!
Ainda sobre outros
episódios da série, assista:
A química das lentes de contato
A química dos impermeáveis
A química do álcool
Todos estes contam um pouco sobre a química dos materiais que estão presentes no
nosso cotidiano.
REFERÊNCIAS
ALMEIDA José Ricardo L.; BERGMAN Nelson; RAMUNNO Franco A. L. Química Geral
– Caderno de Atividades. 3ª ed: São Paulo: Harbra, 2015.
ATKINS Peter W. Moléculas. São Paulo: Editora da Universidade de São Paulo, 2000.
ATKINS Peter W.; JONES Loretta. Princípios de química: questionando a vida
moderna e o meio ambiente. Porto Alegre: Bookman. 2001.
BLOCH Daniel R. Química orgânica sem mistério. Rio de Janeiro: Alta Books, 2013.
SANTOS Wildson; MÓL, Gerson, etc. Química cidadã. Volume 3. 1ª edição, São Paulo:
Nova Geração, 2010.
GABARITO
1.
a)
( F ) Os derivados do petróleo são separados na refinaria, por destilação
simples.
Comentários: A separação das frações do petróleo é feita por destilação
fracionada.
b)
( V ) Nas cadeias carbônicas normais existem somente átomos de carbono
primário e secundário.
c)
( F ) Cadeias fechadas ou cíclicas não podem ser insaturadas.
Comentários: As cadeias fechadas podem apresentar insaturações
(duplas ou triplas ligações).
d)
( F ) Nas cadeias insaturadas, obrigatoriamente há um carbono terciário.
Comentários: Nas cadeias insaturadas, deve haver uma insaturação
(dupla ou tripla ligação). Caso haja carbono terciário, a cadeia será
ramificada.
e)
( V ) A cadeia mais simples que apresenta um carbono quaternário tem no total
5 átomos de carbono.
2.
a)
C1 = primário
C2 = terciário
C3 = primário
C4 = primário
b)
C1 = secundário
C2 = secundário
C3 = secundário
Observação: Se apresentar dificuldade em visualizar
os átomos, consulte a fórmula estrutural com os
átomos de C.
C4 = secundário
c)
C1 = primário
C2 = primário
C3 = primário
d)
C1 = primário
C2 = quaternário
C3 = primário
C4 = secundário
C5 = primário
C6 = primário
3.
a)
Aberta; normal; insaturada e
homogênea.
b)
Fechada; normal; insaturada e
homogênea.
c)
Fechada; ramificada; saturada,
homogênea.
d)
Aberta; ramificada; saturada e
homogênea.
e)
Aberta, normal; saturada e
heterogênea.
4.
a) C3H6
b) C3H4
c) C8H16
d) C7H16
e) C3H8O