1
Carbânions Alguns compostos orgânicos funcionam como ácidos,
liberando um próton de uma ligação C-H. A base conjugada é
conhecida como carbânion.
C
H
C
+
+ H
-
Esta tendência é pouco pronunciada em hidrocarbonetos alifáticos,
porque a ligação C-H é bastante forte e não existe característica
estrutural que favoreça a acidez do átomo de hidrogênio.
Ex: CH4 pKa = 58 e CH3COOH pKa = 4,76
A presença de um ou mais grupos aceptores exerce um efeito mais
acentuado ainda.
Ex: Tricianometano ácido forte, semelhante aos ácidos minerais.
CN
CN
C
CN
CN
H
H
+
C -
CN
CN
C
C
N
,
C
-
C
N
N
O grupamento ciano é importante na acidez dos compostos.
CH3
C
N
Acetonitrila
(pKa alto)
H
+
-
CH2
C
N
CH2
C
N
etc
2
De maneira análoga, o grupo carbonila (C=O) de aldeídos e cetonas,
aumenta a acidez dos átomos de hidrogênio ligados ao carbono ,
permitindo várias reações químicas.
Ex: Ionização de um hidrogênio .
O
O
C
+
C
C
..B
-
C
+
Base
O
C
..
H B
-
C
Equivalente a
-
Ionizações deste tipo não
acontecem em hidrogênios
, , etc
C
O
C
Formação de carbânions
Embora a tendência à dissociação espontânea de ligação C-H seja
baixa, fatores estruturais (grupos que retirem elétrons) pode causar
nos átomos de hidrogênio acidez suficiente para sua retirada fácil por
base.
H
R
C
H
X
.
+ .B
R
-
CH
X
+
..
H B
3
Assim,
O
O
C
EtO
;
CH2 C
CH3NO2
OEt
O
O
;
CH3
OCH3
pKa 10,2
pKa 15
;
CH2 C
C
O
O
C
C
CH2
CH3
CH3
pKa 10,2
pKa 8,8
Estabilidade dos carbânions Efeitos de grupos retiradores de
elétrons aumentam a acidez do átomo de hidrogênio e estabilizam o
carbânion resultante.
H
R
C
+
..B
O
N
O
H
R
-
CH
+
O
+
R
N
-
O
CH
O
-
N
-
O
-
..
+
H B
+
H B
Grupo nitroso
H
R
C
O
C
..B
R
-
CH
R
C
Grupo carbonila
R
H
F
C
C
H
F
F
Menos eficiente
..B
F
R
-
CH
C
F
F
CH
C
R
R
R
H
O
O
+
..
H B
-
..
4
Algumas reações de carbânions
Reações de adição (condensação aldólica)
O
CH3
C
H
-
O
CH3
-
-
OH
C
O
O
C
CH2
CH3
O
C
H
H
-
C
CH2
CH2
C
H
H
O
H2O
H
OH
CH3
O
CH2
C
C
H
H
Condensação de ésteres condensação de Claysen
(Reação do tipo aldólico Base necessária ETO-).
O
CH3
C
OCH3
-
O
CH3
C
EtO
O
O
-
CH2
C
CH3
O
CH2
-
C
H2O
O
(álcool)
+
CH3
C
O
CH2
(ceto-éster)
C
OCH3
OCH3
OCH3
CH3OH
CH2
C
OCH3
OCH3
O
C
OCH3
.OH
.
CH3
C
O
CH2
OCH3
C
OCH3
5
Nas condensações, forma-se uma nova ligação C-C, aumentando
assim a cadeia.
Um exemplo biológico da condensação de Claysen é a condensação
de acetil-CoA com ácido oxalacético, produzindo ácido cítrico.
O
CH3
C
SR
C
CH2
O
O
O
-
SR
C
+
HO
C
O
CH2
C
OH
Ác. oxalácetico
O
CH2
O
C
HO
C
O
SR
H2O
C
CH2
OH
O
HO
C
O
CH2
C
C
C
OH
CH2
OH
OH
C
+
RSH (CoA)
+
CO2
OH
O
Ác. cítrico
Descarboxilação ocorre através do carbânion.
O
R
C
-
R
O-
O
+
+
H
C
RH
O
Próton do solvente
ou outra fonte
Outro exemplo é a descarboxilação de ácidos -cetônicos.
6
O
O
-
C
CH2
O
-
C
CH2
C
O
O
+
R
R
H
+
CO2
CH3
C
R
-
O
CH2
C
R
Radicais livres formados pela cisão homolítica da ligação
covalente. Ocorrem na maioria das vezes na fase gasosa, em reações
onde o solvente é apolar e em reações catalisadas por luz ou pela
decomposição de substâncias produtoras de radicais como, por
exemplo, peróxidos. Reação rápida, ocorre em cadeia.
Os radicais podem ser classificados como de vida longa e vida curta
Radicais de vida longa (Facilmente estabilizados)
C
C
Solvente apolar
(Benzeno)
C.
3
+
. C 3
Hexafeniletano
Grande estabilidade do radical trifenilmetila
.
C
C
C
.
.
, etc
7
Estabilização pela deslocalização de elétrons desemparelhados via
orbitais dos núcleos benzênicos (3 núcleos).
Radicais de vida curta
As diferenças de estabilidade em radicais são menos pronunciadas do
que aquelas com carbocátions.
Radicais que envolvem posições alílicas ou benzílicas são mais
estáveis (deslocalização de elétrons via orbitais ).
.
CH2
CH
.
CH2
CH2
.
CH2
CH
CH2
;
CH2
. ,
etc
Métodos de formação (Radicais de vida curta) Cisão fotoquímica,
cisão térmica, óxido-redução, eletrólise e outros métodos.
Reações nas quais os radicais participam: adição de halogênios,
adição de haletos de hidrogênio, polimerização vinílica, substituição de
halogênios, auto-oxidação (Reação entre composto orgânico e o
oxigênio).
8
COMPOSTOS ORGÂNICOS OXIGENADOS
Possuem um ou mais átomos de oxigênio.
Os compostos orgânicos podem ser classificados de acordo com sua
estrutura
química.
Compostos
com
propriedades
semelhantes
apresentam o mesmo grupo funcional, este sofre as mesmas reações
químicas independentemente do resto da molécula.
Quanto maior o tamanho do “esqueleto carbônico”, menor a influência
do grupo funcional.
Grupos funcionais comuns contendo oxigênio
Função Orgânica
Fórmula geral
Álcool
ROH
OH
Éter
ROR'
O
Aldeído
Cetona
O
O
RCH
CH
O
O
RCR'
C
O
Ácido carboxílico
RCOH
O
Éster
Grupo funcional
RCOR'
O
COH
O
CO
O radical R (alquila) num aldeído, ácido e éster pode ser um átomo de
hidrogênio. Os dois radicais alquila (R, R’) do éter, da cetona e do
éster podem ser iguais ou diferentes.
9
ÁLCOOIS
Possuem o grupo hidroxila (-OH), ligado a um radical alquila.
Grupo hidroxila íon hidróxido
Álcool mais simples CH3OH - Metanol ou álcool metílico.
Nomenclatura IUPAC Prefixo + AN, EN ou IN +Sufixo “OL”
10
Classificação dos Álcoois
Tipo de átomo de carbono
Estrutura
Exemplo
H
Primário (1°)
C
C
CH3CH2CH2 CH2OH
H
Butan-1-ol
C
Secundário (2°)
CH3C HCH2CH3
C
C
OH
H
Butan-2-ol
C
Terciário (3°)
C
CH3
C
H3C
C
CH3
OH
C
metil-propan-2-ol
Os álcoois são encontrados na natureza isolados e ligados
quimicamente a outras moléculas (na forma de ésteres, acetais ou
outros derivados).
Álcool metílico ou metanol Álcool de madeira, é venenoso, a
ingestão em pequenas quantidades pode causar cegueira, paralisia e
morte. (Vapores também são nocivos).
Álcool etílico Ocorre no estado livre, é produto da fermentação de
grãos, frutos, legumes.
C6H12O6
Glicose
Enzimas
2 CH3CH2OH
Etanol
+2
CO2
Dióxido de
carbono
Fermentação
11
O etanol é um álcool utilizado em bebidas (embora seja tóxico),
também é usado para fazer preparações conhecidas como “tinturas”.
Sua solução aquosa a 50-70% é desinfetante ou antisséptico.
Álcool isopropílico (propan-2-ol) “álcool para fricção” em banhos de
esponja. Atua como adstringente, fazendo com que o tecido se
contraia, endurecendo a pele e limitando as secreções. A solução 70%
é usada como antisséptico. Para uso “interno” – Tóxico.
Propriedades dos álcoois
O grupo OH determina as propriedades físicas e químicas dos álcoois
com cadeia carbônica pequena.
Álcoois com até três carbonos Solúveis em água em todas as
proporções, suas propriedades físicas e químicas se assemelham às
da água.
Álcoois com massa molar mais elevada Apenas parcialmente
solúveis em água, ou mesmo insolúveis (longa cadeia de HC), suas
propriedades físicas se assemelham aos alcanos.
As temperaturas de ebulição da água e dos álcoois são
anormalmente elevadas em relação aos hidrocarbonetos, éteres e
outros compostos de massa molar semelhante.
12
Composto
MM
TE (°C)
CH4
16
-161
H2O
18
100
CH3CH3
30
-89
CH3OH
32
65
CH3-O-CH3
46
-25
CH3CH2OH
46
78
Preparação dos álcoois
Os álcoois são preparados por hidrólise de derivados halogenados de
alcanos Reações de substituição nucleofílica.
RX
+
H2O
ROH
+
HX
A reação dependerá da estabilidade do carbocátion intermediário,
derivado do haleto de alquila. Se o carbocátion for relativamente
estável ocorrerá em duas2 etapas (SN1).
Etapa 1 (Lenta)
CH3
CH3
CH3
C
CH3
Br
CH3
C+
+
-
Br
CH3
Etapa 2 (Rápida)
CH3
CH3
C+
CH3
CH3
+
2 H2O
CH3
C
CH3
OH
+
+
H3O
13
Reações dos álcoois
Pode ocorrer a quebra da ligação O-H ou a quebra da ligação C-O.
Reações envolvendo quebra da ligação O-H.
Muitas das reações dos álcoois são semelhantes às da água.
Ex: Os álcoois reagem com metais alcalinos para formar sais
2 ROH
2 RO Na+
+ 2 Na
ácido fraco
+
H2
alcóxido
(base conjugada)
mais forte que o íon
hidróxido
As reações que acontecem são reações de óxido redução; os metais
altamente eletropositivos deslocam o hidrogênio dos álcoois.
Formação de ésteres Os álcoois reagem com ácidos carboxílicos
formando ésteres, através de uma reação de condensação conhecida
como esterificação.
Mecanismo Reação catalisada por ácidos fortes.
..O
R
+
O
R
C
OH
..OH
+
H
C
OH
H
..
R'OH
R
+
C
O
..OH H
O
R'
R
+
C
OR'
H2O
14
Oxidação dos álcoois Os álcoois primários podem ser oxidados a
aldeídos e ácidos carboxílicos.
O
R CH2OH
(o)
R
C
O
(o)
R
C
OH
H
A oxidação de um álcool implica na perda de um ou mais hidrogênios
(hidrogênios ) do carbono que está ligado ao –OH.
A oxidação de aldeídos a ácidos carboxílicos se dá com agentes mais
brandos do que os requeridos para oxidar álcoois primários a aldeídos,
por isso torna-se difícil interromper a oxidação no estágio aldeído.
Os álcoois secundários podem perder o único hidrogênio que
possuem e formar cetonas. Em geral, a reação para no estágio de
cetona, porque a oxidação posterior requer a quebra de uma ligação
carbono-carbono.
R'
R
C
OH
H
(o)
O
R
C
R'
Álcool 2ario
Um álcool terciário não possui hidrogênios , somente pode ser
oxidado sob condições drásticas. A oxidação de um álcool terciário
requer a quebra de uma ligação C-C e as oxidações, quando ocorrem,
são de pouca utilidade sintética.
15
Oxidação do isopropanol (álcool secundário a cetona)
O agente oxidante mais comumente empregado é o ácido crômico
(H2CrO4). Normalmente é preparado “in situ” pela adição do óxido
crômico (CrO3) ou dicromato de sódio (Na2Cr2O7) ao ácido sulfúrico.
Mecanismo sugerido:
Etapa 1 – O álcool reage com o ácido crômico para produzir um éster
(cromato). Nesta etapa não ocorre mudança nos estados de oxidação.
O
CH3
CH
..
O
..
H
+
..
O
..
H
Rápida
Cr
CH3
O
H
CH
O
CH3
O
Isopropanol
O
CH3
Cr
O
H
+
H2O
O
Cromato de isopropila
(éster)
Cr +6
Cr +6
Etapa 2 (mais lenta) - O éster cromato perde um próton e um íon
HCrO-3 para produzir a cetona. Pode ocorrer de duas maneiras:
Etapa 2a
H
CH3
H
CH3
H
Lenta
CH
O
CH
CH3
..
O
..
O
Cr
O
H
O
+
-
HCrO3
+
H3O
+
CH3
Cr +4
O
Cr +6
O cromato pode transferir um próton para a água.
16
Etapa 2b
CH3
H
..
Lenta
CH
O
CH
CH3
CH3
O
Cr
O
H
O
+
H2CrO3
CH3
Cr +4
O
Cr +6
O próton pode ser transferido em um
mecanismo cíclico.
Em qualquer um dos mecanismos, o estado de oxidação do carbono
do álcool aumenta e o estado de oxidação do Cr passa de +6 para +4.
Oxidação biológica do etanol
Os álcoois podem ser oxidados nos organismos vivos. A reação de
oxidação do etanol a acetaldeído é catalisada por uma enzima, a
desidrogenase do álcool.
CH3 CH2
OH
Oxidação
Redução
O
CH3
C
H
O agente oxidante é um dos mais comuns em sistemas biológicos, o
NAD (dinucleotídeo de nicotinamida adenina).
Coenzima, molécula orgânica que colabora com uma enzima
na realização de uma determinada transformação química.
Neste caso, a enzima possibilita o encontro do etanol e a coenzima,
sendo a coenzima a que efetivamente realiza a oxidação.
17
Na oxidação, o NAD arranca do substrato um hidrogênio e um par de
elétrons (um íon hidreto).
NAD+ (Forma oxidada)
Representação do NAD
NADH (Forma reduzida)
+
CH3 CH2 OH
NAD
+
Desidrogenase
do álcool
CH3CHO
+ NADH + H
+
(NAD reduzido)
(NAD oxidado)
O etanol perde um dos seus hidrogênios com um par de elétrons, e
em seguida (provavelmente simultaneamente), perde o próton ligado
ao oxigênio, produzindo aldeído.
Mecanismo
H
CH3 C
..
O
..
O
CH3
H
+
C
NADH
+
H
+
H
H
+
NAD
As enzimas aceleram a reação tanto num sentido quanto no outro. A
desidrogenase do álcool catalisa também a redução do acetaldeído
pelo NADH. O acetaldeído captura o hidreto e um próton do solvente.
CH3CHO
+ NADH + H
(NAD reduzido)
+
CH3 CH2 OH + NAD
+
(NAD oxidado)
18
Mecanismo
O
CH3
C
H
H
+
H
CH3 C
O
H
+
+
NAD
H
NAD H
No organismo, após ingestão de bebida alcoólica, o álcool é
rapidamente absorvido, particularmente no estômago vazio, neste
caso, a absorção é praticamente completa em 1 hora. O etanol é
degradado no fígado pela enzima desidrogenase alcoólica.
A reação de conversão de etanol a acetaldeído é a etapa lenta da
degradação do álcool.
O acetaldeído é convertido em acetato e depois canalizado para um
processo liberador de energia que produz 7 Kcal por grama de álcool.
O nível alcoólico sangüíneo volta a zero após cerca de 6 horas.
Drogas usadas para tratamento de alcoólatras, como o disulfiran
(antabase), impedem a oxidação do acetaldeído. Elas causam tontura,
dor de cabeça, náusea, vômito e dificuldade respiratória se o álcool for
ingerido.
Reações envolvendo quebra da ligação C-O Reações de
eliminação e substituição nucleofílica, necessitam de um ácido para
converter o álcool ao verdadeiro substrato, o álcool protonado.
19
Tanto nas reações de substituição nucleofílica, quanto nas de
eliminação,
seguindo
um
mecanismo
bimolecular
(SN2)
ou
unimolecular (SN1), o substrato tem que perder um grupo nucleofílico.
O álcool protonado perde facilmente a molécula de água fracamente
básica.
Eliminação (Desidratação) Álcoois aquecidos com ácidos fortes
sofrem eliminação de água (desidratação) e formam alquenos. Os
ácidos mais comumente usados (doadores de prótons) são o ácido
sulfúrico e o ácido fosfórico.
Os alcoóis primários são os mais difíceis de desidratar. A desidratação
do etanol, por exemplo, requer ácido sulfúrico concentrado e uma
temperatura de 180°C.
H
CH3 C
O
H
H2SO4 conc
180°C
H
H
H
C
+
C
H2O
H
H
Eteno
Os álcoois secundários desidratam sob condições mais brandas. O
ciclo-hexanol, por exemplo, desidrata em ácido fosfórico a 85% a 165170°C.
OH
H3PO4 (85%)
165-170°C
Ciclo hexanol
+
Ciclo hexeno
(80%)
H2O
20
Os álcoois terciários podem usar condições muito mais brandas pois
são facilmente desidratados, o álcool t-butílico, por exemplo, desidrata
em H2SO4 aquoso a 20%, a uma temperatura de 85°C.
CH3
OH
CH3 C
CH3
H2SO4 (20%)
+
C
CH3
85°C
CH3
H 2O
CH2
Álcool t-butílico
Ordem de facilidade relativa para desidratação de alcoóis:
R"
R"
R
C
R
OH
H
R
OH
C
OH
C
R'
H
H
3ario
2ario
1ario
Alguns álcoois desidratam fornecendo mais de um produto.
Ex: 1-butanol
- H2O
Trans-2-Buteno, Cis-2-Buteno e 1-Buteno
CH3
CH3CH2CH2CH2OH
H2SO4 conc
170°C
C
H
CH3
H
+
C
CH3
C
H
H
CH3
+
C
CH3CH2CH
H
C
H
Trans-2-Buteno
Cis-2-Buteno
1-Buteno
(Produto principal)
(Produto secundário)
(Produto secundário)
21
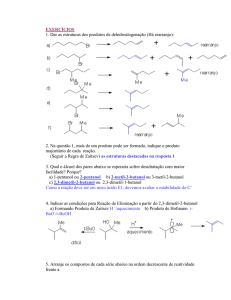
Alguns álcoois primários e secundários sofrem rearranjos.
Ex: Desidratação do 3,3-dimetil-butan-2-ol
CH3
CH3 C
CH3 CH3
CH3 CH3
CH
CH3
H3PO4 (85%)
80°C
CH3 C
CH3 OH
C
CH3
+
CH2
C
CH
CH3
2,3-Dimetil-1-Buteno
2,3-Dimetil-Buteno
(80%)
(20%)
Mecanismo
Etapa 1 – Protonação do álcool
CH3
CH3
H
CH3 C
CH
CH3
+ +O
CH3 OH
CH3 C
H
CH3
CH3 OH2
..
H
..
CH
+
Álcool protonado
Etapa 2 – O álcool protonado perde água formando um carbocátion
secundário.
CH3
CH3
CH3 C
CH
CH3
CH3 C
CH
+
CH3
+
H2O
CH3
CH3 OH2
..
+
Neste ponto ocorre rearranjo: o carbocátion secundário rearranja para
formar um carbocátion terciário mais estável.
CH3
CH3
CH3 C
CH
+
CH3
2ario (- estável)
CH3
CH3 C
+
CH
CH3
3ario (+ estável)
CH3
+
H2O
22
Etapa 3 – Perda de próton do novo carbocátion e formação de
alqueno. Pode acontecer de duas maneiras:
1
CH3 H
1
CH2 C
+
C
CH
CH3
Alqueno menos estável
(Produto secundário)
CH3 CH3
2
H
CH2 C
CH3
CH3
2
CH3 C
CH
CH3
Alqueno mais estável
(Produto principal)
CH3 CH3
Reação de substituição com haletos de hidrogênio (HX) Os álcoois
reagem com os haletos de hidrogênio (HI, HBr, HC), para formar os
haletos de alquila. A reação é catalisada por ácido, só se processa
com velocidade apreciável, quando um ácido forte está presente.
R
OH
+
HX
RX
+
H2O
Ordem de reatividade dos haletos de hidrogênio:
HI > HBr > HC(o HF geralmente não é reativo).
Ordem de reatividade dos alcoóis: benzílico > 3ario > 2ario > 1ario
Os álcoois 2arios, 3arios, alílicos e benzílicos podem reagir por um
mecanismo que envolve a formação de carbocátions.
23
Mecanismo
Etapa 1 – Protonação.
CH3
CH3 C
..
..OH +
CH3
H
+O
H
Rápida
CH3 C
H
CH3
OH2
+
+
H2O
CH3
Etapa 2 – Dissociação do álcool protonado para formar carbocátion e
água.
CH3
CH3 C
H
O
+
CH3
Lenta
CH3 C +
H
CH3
+
H2O
CH3
Nesta etapa, o carbocátion reage com o nucleófilo (íon haleto).
CH3
CH3 C +
+
.. ... Cl
.. .
CH3
Rápida
CH3
CH3
C
Cl
CH3
Muito freqüentemente as conversões de álcoois a haletos de alquila
produzem um pouco de alqueno através da eliminação.