QUIMICA GERAL
Prof. Chico de Andrade
e-mail : [email protected]
EVOLUÇÃO DOS MODELOS ATÔMICOS
A história
O potássio reage tão energicamente com a água que o hidrogênio desprendido se inflama. A
coloração rósea da solução, com a
fenolftaleína, um indicador ácidobase, mostra que se formam íons
OH durante a reação.
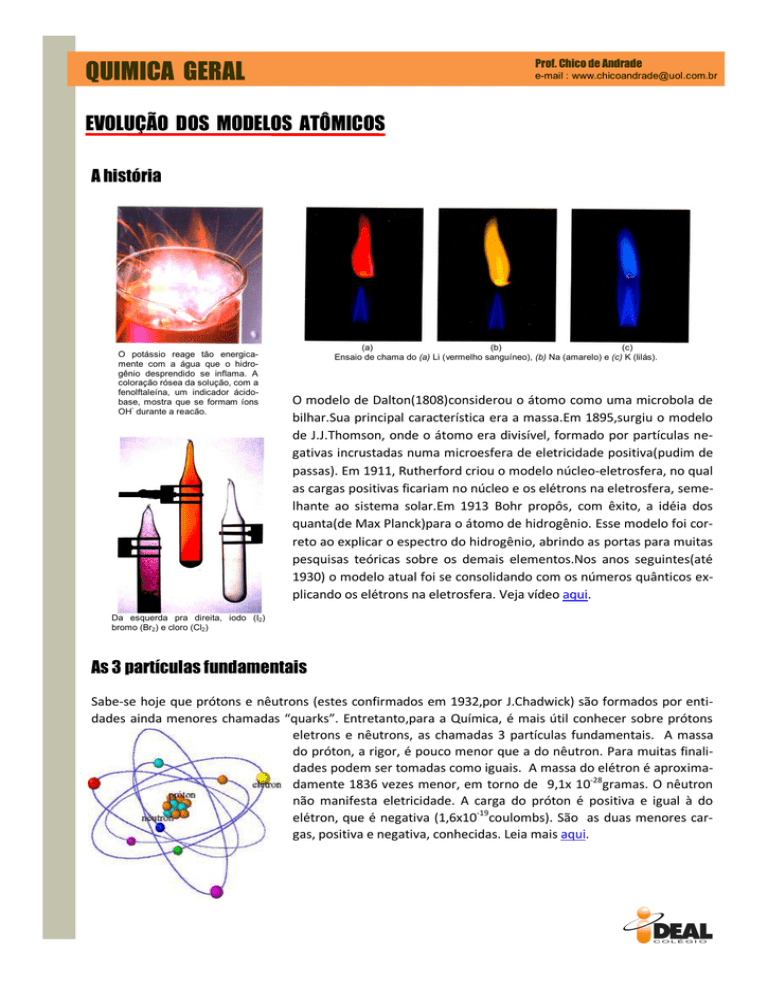
(a)
(b)
(c)
Ensaio de chama do (a) Li (vermelho sanguíneo), (b) Na (amarelo) e (c) K (lilás).
O modelo de Dalton(1808)considerou o átomo como uma microbola de
bilhar.Sua principal característica era a massa.Em 1895,surgiu o modelo
de J.J.Thomson, onde o átomo era divisível, formado por partículas negativas incrustadas numa microesfera de eletricidade positiva(pudim de
passas). Em 1911, Rutherford criou o modelo núcleo-eletrosfera, no qual
as cargas positivas ficariam no núcleo e os elétrons na eletrosfera, semelhante ao sistema solar.Em 1913 Bohr propôs, com êxito, a idéia dos
quanta(de Max Planck)para o átomo de hidrogênio. Esse modelo foi correto ao explicar o espectro do hidrogênio, abrindo as portas para muitas
pesquisas teóricas sobre os demais elementos.Nos anos seguintes(até
1930) o modelo atual foi se consolidando com os números quânticos explicando os elétrons na eletrosfera. Veja vídeo aqui.
Da esquerda pra direita, iodo (I2)
bromo (Br2) e cloro (Cl2)
As 3 partículas fundamentais
Sabe-se hoje que prótons e nêutrons (estes confirmados em 1932,por J.Chadwick) são formados por entidades ainda menores chamadas “quarks”. Entretanto,para a Química, é mais útil conhecer sobre prótons
eletrons e nêutrons, as chamadas 3 partículas fundamentais. A massa
do próton, a rigor, é pouco menor que a do nêutron. Para muitas finalidades podem ser tomadas como iguais. A massa do elétron é aproximadamente 1836 vezes menor, em torno de 9,1x 10-28gramas. O nêutron
não manifesta eletricidade. A carga do próton é positiva e igual à do
elétron, que é negativa (1,6x10-19coulombs). São as duas menores cargas, positiva e negativa, conhecidas. Leia mais aqui.
COLÉGI O
QUIMICA GERAL
Prof. Chico de Andrade
e-mail : [email protected]
Os isótopos de um elemento
Um dado elemento químico é formado por átomos não necessariamente com a mesma massa. Um exemplo interessante é o do elemento hidrogênio, onde há três tipos de átomos: H-1(prótio), H-2(deutério) e H3(trítio). O prótio é o único átomo que não possui nêutron.O número 1 indica que possui um único próton.O núcleo do deutério tem um próton e um nêutron(número de massa 2) e o núcleo do trítio tem número de massa 3,com um próton e dois nêutrons.Fica claro que o H-1 é o isótopo mais “leve” e que o trítio é o
mais “pesado”. Entenda mais sobre isótopos,isóbaros e isótonos aqui.
Número de massa e massa atômica
Número de massa é a quantidade de prótons e nêutrons (núcleons) de um átomo.É sempre um número inteiro.Massa atômica é a massa de um átomo em relação ao isótopo 12 do carbono.O único átomo com massa atômica expressa por número inteiro é o C-12.Os isótopos de todos os elementos têm massas
atômicas fracionárias.Essa massas fracionárias são próximas dos
números de massa dos respectivos isótopos e podem ser, muitas
vezes, substituídos por elas.Quando a massa atômica de um isóCésar Lattes
topo é desconhecida,ela pode ser substituída pelo número de
massa de seu isótopo mais estável.Se um elemento apresenta dois ou mais isótopos,a massa atômica do
elemento é dada pela média ponderada das massas atômicas de seus isótopos. Saiba mais um pouco aqui.
Uma tabela periódica
Se você desejar uma tabela on-line clique aqui
COLÉGI O












