Tubos de Crookes e a descoberta do elétron
(A) Efeito de um obstáculo no “caminho dos raios catódicos.
Raios Catódicos
Resultados independem do gás
usado para preencher a ampola de
vidro.
Feixe é formado por partículas que
possuem massa.
Feixe é capaz de girar um catavento
no interior da ampola.
Feixe é defletido por um campo
elétrico ou campo magnético.
Raio catódico = elétron
Elétrons possuem carga negativa
High
voltage
shadow
source of
high voltage
cathode
yellow-green
fluorescence
(B) O efeito de um campo elétrico.
High
voltage
source of
high voltage
negative
plate
source of
low voltage
cathode
+
anode
positive
plate
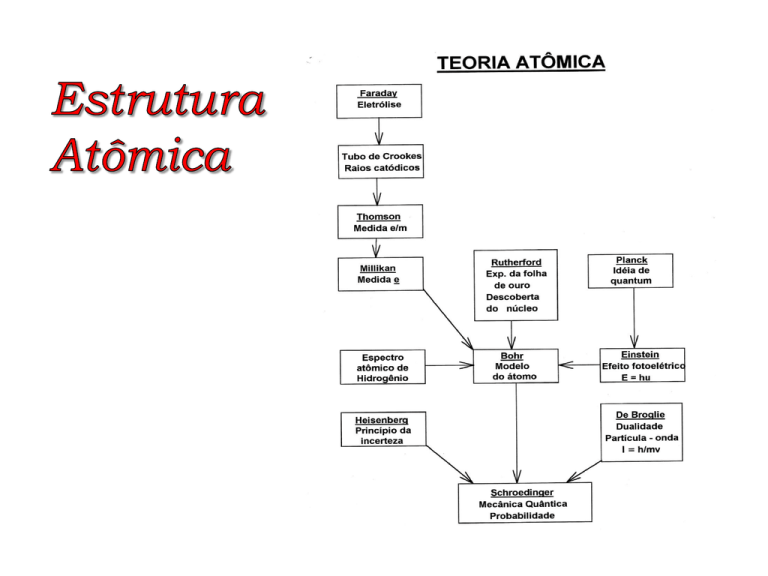
Experimento de Thomson (1895)
Determinação da razão carga/massa do elétron = -1,76 x 1011 C/kg.
O experimento de Millikan (1903) – determinação da
carga do elétron
Determinação da carga do elétron = -1,602 x 10-19 C. Logo a
massa do elétron é 9,1 x 10-31kg.
O experimento de Rutherford e o átomo nuclear (1911)
Experimento realizado por Geiger e Marsden → 1 partícula
alfa em 20.000 retornava à direção de partida!
A natureza ondulatória da luz
Radiação eletromagnética (ou
energia radiante) é a emissão e
transmissão de energia através do
espaço na forma de ondas.
c=λxν
c = velocidade da luz (m/s)
λ = comprimento de onda (m)
ν = frequência (⅟s = Hz)
Energia quantizada e fótons
A hipótese de Planck
A distribuição dos λ
emitidos depende, em
alguma extensão, da
composição do material.
Planck sugeriu que quando a radiação eletromagnética interage
com a matéria, energia somente pode ser absorvida ou
emitida em certas quantidades discretas (QUANTUM); ou
seja, existe uma quantidade mínima que pode ser emitida (ou
absorvida) em qualquer instante.
Quantum = menor quantidade de energia que pode ser emitida
(ou absorvida) na forma de radiação eletromagnética.
A energia de um quantum é dada pela equação de Planck:
E=hxν
Onde h é a constante de Planck = 6,62 x 10-34 J.s
A intensidade da radiação = número de quanta/s.
O efeito fotoelétrico – a explicação de Einstein
Luz incidindo em uma superfície metálica limpa faz com que
elétrons sejam ejetados da superfície.
Para cada metal existe uma frequência mínima de luz, abaixo da
qual nenhum elétron é emitido.
Einstein sugeriu que não devemos pensar em um feixe de luz
como uma onda, mas como um feixe de partículas. Ele supôs
que a energia radiante atingindo a superfície metálica é um
fluxo de pacotes minúsculos de energia (atualmente chamados
fótons – portadores de energia). Cada fóton tem sua energia
proporcional à freqüência da luz: Ef = h x .
Agora consideremos dois feixes de luz com a mesma
freqüência (a qual é superior à freqüência crítica), mas
intensidades diferentes. O feixe mais intenso consiste de um
número maior de fótons, logo o número de elétrons ejetados é
maior que o número de elétrons produzidos pelo feixe menos
intenso. Quanto mais intensa a luz, maior o número de
elétrons emitidos pelo metal: Iluz α no de e-(s) ejetados. O
aumento da intensidade da luz dá mais fótons, mas não
muda a sua energia individual.
O espectro atômico de raias ou linhas e o modelo atômico de
Bohr (1913).
A luz emitida por átomos depois de absorverem energia extra,
fornece dados sobre a estrutura atômica como conhecemos hoje.
CADA ELEMENTO QUÍMICO TEM UM ESPECTRO DE
EMISSÃO CARACTERÍSTICO.
Balmer e Rydberg propuseram equações matemáticas simples:
-
Equação de Rydberg
onde n é um número inteiro associado a cada raia e R é a cte
de Rydberg (1,096776 x 107 m-1, ou 2,18 x 10-18 J ou 3,29 x 1015
Hz).
De forma genérica a Equação de Rydberg pode ser escrita
como:
-
onde n1 = 1, 2, 3, ..... e n2 = (n1 +1), (n1 +2), (n1 +3), ....
Bohr relacionou os espectros dos átomos excitados com a Teoria
Quântica de Planck e às idéias de Rutherford sobre os elétrons estarem
fora do núcleo.
1) Em um átomo de hidrogênio o elétron se desloca em uma órbita
circular em volta do núcleo.
2) O elétron do átomo de hidrogênio somente pode ocupar certas
órbitas ou níveis de energia.
3) A energia de um elétron na n-ésima órbita do átomo de hidrogênio
é dada por:
ou
onde n é o nível da órbita e é adimensional com valores inteiros..
4) A diferença de energia entre os níveis corresponde a um quantum de
energia.
ou
A órbita com menor energia é n=1, é a mais próxima do
núcleo e a que deve ser ocupada pelo elétron.
Um conceito importante, introduzido por Bohr e aceito até hoje, é que um
elétron em um átomo permanece no seu nível de energia mais baixo, a
menos que seja perturbado. A energia é absorvida ou emitida quando o
elétron passa de um nível de energia para outro.
A dualidade partícula onda do elétron
A hipótese de de Broglie
De Broglie deduziu que as propriedades corpusculares e
ondulatórias se relacionam pela seguinte expressão:
onde λ é o comprimento de onda da partícula, h é a constante
de Planck e o produto mv o momento linear da partícula.
A difração da luz – fenômeno típico ondulatório
O princípio da incerteza
O princípio da incerteza de Heisenberg (1927) afirma que é
impossível conhecer simultaneamente o momentun (mv) e a
posição de uma partícula (x) com exatidão.
Todo ato de medir perturba um sistema.
Exercício 1.106 do Atkins: O princípio da incerteza é desprezível para objetos
macroscópicos. Aparelhos eletrônicos, entretanto, têm sido fabricados em escala
cada vez menor, de forma que as propriedades das nanopartículas, podem ser
diferentes daquelas das partículas grandes, devido aos fenômenos mecânicosquânticos. A) Calcule a incerteza mínima na velocidade de um elétron confinado
em uma partícula de diâmetro 200 nm e compare com a incerteza na velocidade de
um elétron em um fio de 1,00 mm de comprimento. B) Calcule a incerteza mínima
na velocidade de um íon Li+ móvel confinado em uma nanopartícula com o mesmo
diâmetro, feita de um composto de lítio. C) Qual pode ser medida com maior
precisão em uma nanopartícula?
O modelo mecânico quântico do átomo de
hidrogênio.
No modelo mecânico-quântico a expressão posição de um
elétron é substituída por região de maior probabilidade de
encontrarmos o elétron.
As partículas em movimento podem ser descritas por uma
equação de onda (), a qual descreve o movimento
ondulatório por uma equação matemática, as formas e as
energias das ondas eletrônicas.
Onde, E = energia total do sistema (quantizada), V = energia
potencial, m= massa do elétron e = função de onda.
O modelo da partícula na caixa
O exemplo mais simples de
uma função de onda estacionária verdadeira, corresponde
a uma partícula de massa m,
confinada entre duas paredes
rígidas de distância L, uma
partícula em uma caixa. Temos
uma onda estacionária, ou seja,
uma onda estável o tempo
todo. Um exemplo desta
situação é a corda de um
instrumento, onde somente são
permitidos certos comprimentos de onda ().
Vibrações de uma corda esticada.
Nó = ponto onde a amplitude é zero.
L=n
x
2
λ
n = número inteiro
A correção do modelo consiste em assumir que o elétron está
sujeito a um potencial atrativo (V ≠ 0) devido ao próton.
Agora a resolução da equação de onda não é simples, mas os
níveis de energia permitidos são:
onde
Agora os níveis de energia têm a forma sugerida pelos
experimentos.
Para o átomo de hidrogênio a eq. de Schrödinger produz duas
informações importantes: 1) especifica os possíveis estados de
energia que um elétron pode ocupar; 2) identifica a
correspondente função de onda.
Infelizmente não pode ser resolvida precisamente para átomos mais
pesados.
Orbital atômico e números quânticos.
Existem várias soluções para a eq. de Schrödinger, sendo que
cada uma corresponde a um nível de energia. Geralmente se
tem famílias de equações que requerem especificações,
denominados números quânticos.
Orbital atômico é a função de onda (ψ) de um elétron em um
átomo. Um orbital possui portanto energia e distribuição de
densidade eletrônica características. Um orbital atômico não
é uma entidade física, ele não existe!
Foram introduzidos três números inteiros denominados
números quânticos n, l e ml, que definem os estados de
energia e os orbitais disponíveis e somente podem assumir
certas combinações de valores, isto é, seus valores não podem
ser escolhidos aleatoriamente, são uma conseqüência natural
da teoria.
Número quântico principal (n). Valores possíveis: 1, 2, 3, ....
Ele está associado com a distância média do núcleo. Quanto
maior for o valor de n, mais afastado do núcleo esta o orbital e
maior é o orbital.
Número quântico do momento angular orbital (l). Valores
possíveis: 0, 1, 2, 3 ...(n-1). Seu valor depende de n.
Define a geometria da região do espaço onde o elétron pode estar.
Cada valor de l corresponde uma forma diferente de orbital.
Número quântico magnético (ml). O valor de ml é limitado
pelo valor de l (l). O número de valores de ml para uma
subcamada especifica o número de orientações que existem
para os orbitais desta subcamada.
O número quântico magnético, ml, determina em que direção do espaço
está a região de probabilidade.
Número quântico de spin do elétron (ms). Valores possíveis:
½. Está associado ao movimento de rotação do elétron em
torno de seu próprio eixo. Foi verificado experimentalmente
por medidas magnéticas, não se tratando de um resultado da
equação de Schrödinger.
A forma dos orbitais atômicos
Para os químicos o mais importante é conhecer a forma dos orbitais e seus
tamanhos relativos, os quais são representados pelos diagramas de contorno.
Orbital s. Um elétron em n=1, apenas um valor de l = 0 é
possível e denominamos orbital 1s.
A parte angular desta função de onda é uma constante, o que
significa que a probabilidade de encontrar o elétron sobre uma
direção depende somente da distância. O orbital s tem a
forma de uma esfera.
Para outros valores superiores de n, os orbitais s também
possuem a forma esférica, porém o tamanho do orbital aumenta.
Orbital p. Para l=1 os orbitais possuem um plano imaginário
que passa pelo núcleo e divide a região de densidade de
elétrons pela metade → plano nodal (região onde ψ = 0). O
orbital p tem a forma de um haltere.
Orbital d. Para l=2 os orbitais possuem dois planos
imaginários que passam pelo núcleo e dividem a região de
densidade de elétrons em quatro → dois planos nodais. O
orbital d tem a forma de um trevo de quatro folhas.
Cinco valores de ml são possíveis (+2, +1, 0, -1 e -2).
Orbital f. Para l=3 os orbitais possuem três planos
imaginários que passam pelo núcleo. O orbital f tem uma
forma mais complexa.
Sete valores de ml são possíveis (+3, +2, +1, 0, -1, -2, -3).
A energia dos orbitais atômicos.
Para o átomo de hidrogênio, a energia dos orbitais atômicos é
facilmente determinada pela equação de Bohr.
Para átomos multieletrônicos,
interação entre
os números
quânticos principal e secundário
são importantes.
Energia de ionização determinada por PES
Elemento
Primeiro pico
Segundo pico
(1s)
(2s)
Terceiro pico (2p)
Quarto pico (3s)
Quinto pico
(3p)
H
1,31
He
2,37
Li
6,26
0,52
Be
11,5
0,90
B
19,3
1,36
0,80
C
28,6
1,72
1,09
N
39,6
2,45
1,40
O
52,6
3,12
1,31
F
67,2
3,88
1,68
Ne
84,0
4,68
2,08
Na
104
6,84
3,67
0,50
Mg
126
9,07
5,31
0,74
Al
151
12,1
7,79
1,09
Tabela EI (MJ/mol) para os 10 primeiros elementos da tabela periódica.
0,58
Blindagem e a energia dos orbitais atômicos
Enquanto um dado elétron é atraído pelo núcleo, ele sofre
repulsão pelos demais elétrons. A este efeito dá-se o nome de
blindagem. O elétron está menos atraído pelo núcleo do que
estaria sem a influência dos demais elétrons. Isto reduz
efetivamente a atração entre o núcleo e os elétrons.
A carga nuclear efetiva Zef experimentada pelo elétron é
sempre menor que a carga nuclear nominal, porque as
repulsões elétron-elétron trabalham contra a atração do
núcleo.
Zef = Z – blindagem
Configuração eletrônica
Configuração eletrônica do átomo é a lista de todos os
orbitais ocupados, com o número de elétrons que cada um
contém.
Princípio da exclusão de Pauli: em um átomo não podem existir
dois elétrons com a mesma função de onda. Um orbital somente
pode ser ocupado por dois elétrons.
Princípio de Aufbau: Os orbitais de menor energia são
preenchidos primeiro.
Regra de Hund: Para orbitais degenerados (com a mesma
energia) a configuração mais estável é aquela com o maior
número de elétrons desemparelhados.
36
Propriedades periódicas
Raio atômico
Energia de ionização
É a energia necessária para retirar um elétron de um átomo neutro
no estado fundamento na fase gasosa.
A (g) → A+ (g) + e- 1º EI
A+ (g) → A++ (g) + e- 2º EI
A segunda EI é maior que a 1ª.
Afinidade ao elétron
É a energia liberada (ou absorvida) por um átomo neutro, no
estado fundamental, ao receber um elétron na fase gasosa.
A (g) + e- → A- (g) 1º AE












