Questões de vestibular
Universidade Federal do Paraná – UFPR – 2007
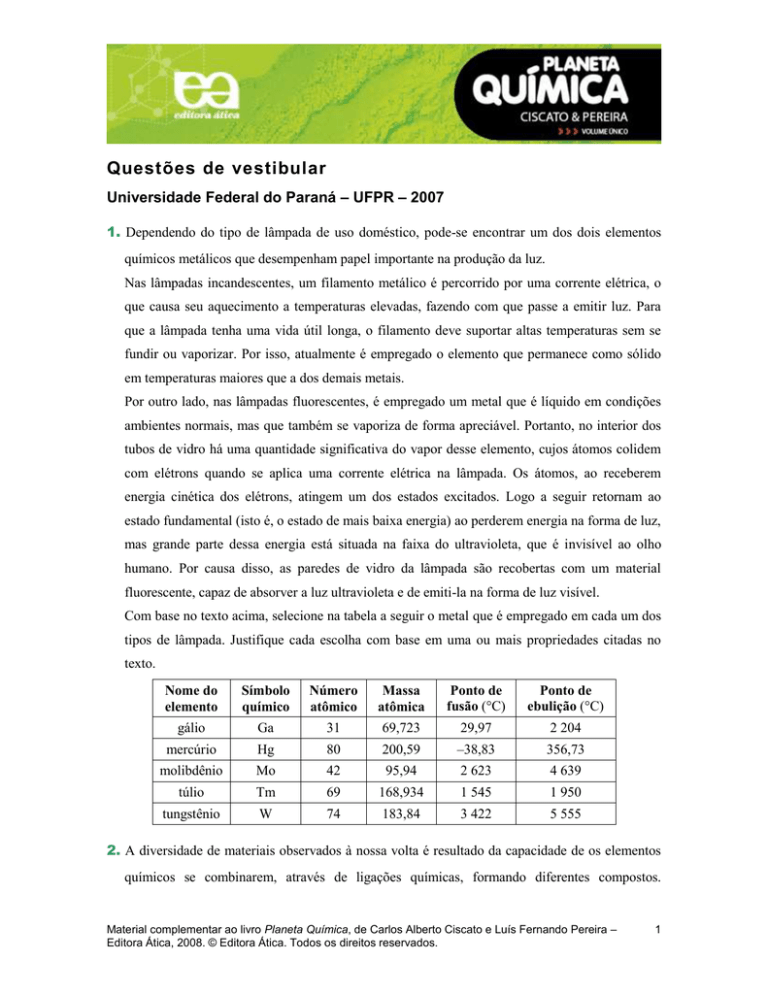
1. Dependendo do tipo de lâmpada de uso doméstico, pode-se encontrar um dos dois elementos
químicos metálicos que desempenham papel importante na produção da luz.
Nas lâmpadas incandescentes, um filamento metálico é percorrido por uma corrente elétrica, o
que causa seu aquecimento a temperaturas elevadas, fazendo com que passe a emitir luz. Para
que a lâmpada tenha uma vida útil longa, o filamento deve suportar altas temperaturas sem se
fundir ou vaporizar. Por isso, atualmente é empregado o elemento que permanece como sólido
em temperaturas maiores que a dos demais metais.
Por outro lado, nas lâmpadas fluorescentes, é empregado um metal que é líquido em condições
ambientes normais, mas que também se vaporiza de forma apreciável. Portanto, no interior dos
tubos de vidro há uma quantidade significativa do vapor desse elemento, cujos átomos colidem
com elétrons quando se aplica uma corrente elétrica na lâmpada. Os átomos, ao receberem
energia cinética dos elétrons, atingem um dos estados excitados. Logo a seguir retornam ao
estado fundamental (isto é, o estado de mais baixa energia) ao perderem energia na forma de luz,
mas grande parte dessa energia está situada na faixa do ultravioleta, que é invisível ao olho
humano. Por causa disso, as paredes de vidro da lâmpada são recobertas com um material
fluorescente, capaz de absorver a luz ultravioleta e de emiti-la na forma de luz visível.
Com base no texto acima, selecione na tabela a seguir o metal que é empregado em cada um dos
tipos de lâmpada. Justifique cada escolha com base em uma ou mais propriedades citadas no
texto.
Nome do
elemento
Símbolo
químico
Número
atômico
Massa
atômica
Ponto de
fusão (°C)
Ponto de
ebulição (°C)
gálio
Ga
31
69,723
29,97
2 204
mercúrio
Hg
80
200,59
–38,83
356,73
molibdênio
Mo
42
95,94
2 623
4 639
túlio
Tm
69
168,934
1 545
1 950
tungstênio
W
74
183,84
3 422
5 555
2. A diversidade de materiais observados à nossa volta é resultado da capacidade de os elementos
químicos se combinarem, através de ligações químicas, formando diferentes compostos.
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
1
Relacione os tipos de ligação mostrados na coluna da direita com os compostos da coluna da
esquerda.
1. NaCl, sal de cozinha
( ) Ligação metálica
2. H2S, gás sulfeto de hidrogênio
( ) Ligação iônica
3. Latão (liga de cobre e zinco)
( ) Ligação covalente apolar
4. N2 (gás nitrogênio)
( ) Ligação covalente polar
Assinale a alternativa que apresenta a sequência correta da coluna da direita de cima para baixo.
a) 3 – 1 – 4 – 2
d) 2 – 3 – 1 – 4
b) 3 – 2 – 1 – 4
e) 1 – 3 – 2 – 4
c) 4 – 1 – 3 – 2
3. A própolis é um produto natural conhecido por suas propriedades anti-inflamatórias e
cicatrizantes. Ela contém mais de 200 compostos identificados até o momento, entre os quais
alguns de estruturas simples, como os apresentados a seguir:
I) C6H5CHO
II) C6H5CH2OH
III) C6H5COOCH2CH3
a) Identifique a função orgânica do composto I.
b) O composto III é um éster que pode ser obtido pela reação de um ácido carboxílico com um
álcool. Escreva o nome do ácido carboxílico e do álcool que produzem esse éster.
c) Escreva a fórmula estrutural (usando a notação em bastão) do álcool que, através de uma
reação de oxidação, produz o composto I.
4. Os nitrotoluenos são compostos intermediários importantes na produção de explosivos. Os
mononitrotoluenos podem ser obtidos simultaneamente, a partir do benzeno, através da seguinte
sequência de reações:
a) Escreva o nome do composto A.
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
2
b) Escreva a fórmula estrutural do produto minoritário da reação II.
c) Identifique o tipo de isomeria plana presente nos três produtos orgânicos da reação II.
d) Qual é a função do AlCl3 na reação I?
5. O biodiesel pode ser obtido através da mistura de óleo (de origem animal ou vegetal) com
metanol, na presença de um catalisador. Com relação à química do biodiesel, assinale a
alternativa incorreta.
a) As funções químicas presentes nas substâncias que participam da transformação descrita são
éster e álcool.
b) As gorduras animais e vegetais podem conter em sua estrutura química ácidos graxos de
longa cadeia carbônica com várias ligações duplas, caracterizando-as como poli-insaturadas.
c) A reação acima pode ser representada pela seguinte equação: triglicerídeo + metanol
glicerol + éster.
d) O catalisador não é consumido durante a transformação química.
e) Transformações de combustão absorvem grande quantidade de energia térmica do meio onde
ocorrem.
6. Os rios que deságuam no mar podem carregar resíduos poluentes, os quais podem contaminar
grandes quantidades de água. Um possível contaminante presente nas águas desses rios,
proveniente do óleo de soja e atualmente muito utilizado nas cozinhas domésticas, é o ácido
palmítico, cuja fórmula é CH3(CH2)14COOH. Em relação ao ácido palmítico, assinale a
alternativa incorreta.
a) Na fórmula do ácido palmítico estão presentes 16 carbonos.
b) O ácido palmítico pertence à família dos ácidos carboxílicos.
c) O ácido palmítico é pouco solúvel em água.
d) O ácido palmítico é uma substância combustível.
e) Na fórmula molecular do ácido palmítico estão presentes 30 hidrogênios.
7. A decomposição do gás amônia pode ser representada pela equação abaixo:
2 NH3(g) N2(g) + 3 H2(g)
Considerando que essa transformação química ocorre em um recipiente aberto, assinale a
alternativa incorreta.
a) Seis mols de amônia resultarão em três mols de nitrogênio e nove mols de hidrogênio.
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
3
b) Com o passar do tempo, a concentração de amônia irá diminuir e as concentrações de
nitrogênio e hidrogênio irão aumentar.
c) A velocidade de formação do nitrogênio é três vezes menor que a do hidrogênio.
d) Quanto maior a temperatura, maior será a velocidade dessa transformação química.
e) O número atômico dos átomos é modificado porque novas substâncias são formadas.
8. O equilíbrio que envolve a ionização do ácido carbônico, o qual é produto da dissolução do gás
carbônico em água, é importante em uma série de eventos químicos e biológicos, entre os quais a
manutenção do pH sanguíneo, o sabor dos refrigerantes e a fixação do carbono pelo fitoplâncton.
Com base na seguinte equação, assinale a alternativa incorreta.
H2CO3
H+ + HCO 3–
Ka = 4,5 10–7
a) O valor de Ka indica que, no equilíbrio, a concentração dos produtos é menor do que a dos
reagentes.
b) A concentração de cada um dos produtos é numericamente igual.
c) O ácido carbônico é um ácido fraco.
d) A diminuição do pH deslocaria o equilíbrio para a esquerda.
e) Em refrigerantes, a abertura do recipiente promove a saída do gás carbônico e
consequentemente a diminuição do pH.
9. Compostos de função mista apresentam mais de um grupo funcional em sua estrutura. A partir
dessa informação, numere a coluna da direita de acordo com a sua correspondência com as
colunas da esquerda e central.
1. glicose
4. ácido cítrico
2. frutose
5. adrenalina
3. ácido acetilsalicílico
(
(
(
(
(
(
) Ácido carboxílico e amina.
) Álcool e cetona.
) Ácido carboxílico e álcool.
) Álcool, amina e fenol.
) Álcool e aldeído.
) Ácido carboxílico e éster.
6. alanina
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
4
Assinale a alternativa que apresenta a sequência correta da coluna da direita, de cima para baixo.
a) 5 – 2 – 6 – 3 – 1 – 4.
d) 6 – 1 – 4 – 3 – 5 – 2.
b) 5 – 2 – 3 – 1 – 6 – 4.
e) 4 – 2 – 6 – 5 – 1 – 3.
c) 6 – 2 – 4 – 5 – 1 – 3.
10. Dadas as temperaturas de fusão e ebulição, assinale a alternativa que indica, respectivamente,
os estados físicos das substâncias abaixo a 40 °C.
Substância
T. fusão (°C)
T. ebulição (°C)
água
0
100
bromo
–7
59
fenol
41
182
pentano
–130
36
a) Líquido, líquido, sólido, gasoso.
b) Gasoso, líquido, líquido, sólido.
c) Líquido, sólido, líquido, gasoso.
d) Líquido, líquido, gasoso, sólido.
e) Sólido, gasoso, líquido, líquido.
11. A densidade de um corpo é expressa pela relação entre a sua massa e o seu volume. Sobre
densidade, assinale a alternativa correta.
a) Uma bolinha de isopor flutua sobre a água porque o isopor é mais denso que a água.
b) Um quilograma de ferro é mais pesado do que um quilograma de isopor.
c) Uma bolinha de ferro afunda na água porque o ferro é menos denso que a água.
d) Uma bolinha de ferro e uma de isopor, ambas com 200 gramas, colocadas em água, irão
afundar.
e) Uma bolinha de ferro é mais densa que uma bolinha de isopor.
12. O ômega-3, representado pela estrutura abaixo, é um importante lipídio para a dieta humana,
atuando na regulação dos níveis de colesterol. Normalmente esse composto é encontrado em
peixes e óleo de linhaça, entre outros alimentos.
Assinale a alternativa que apresenta a classificação da cadeia carbônica do ômega-3.
a) Homogênea, insaturada e ramificada.
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
5
b) Heterogênea, saturada e aberta.
c) Alicíclica, insaturada e homogênea.
d) Homogênea, insaturada e linear.
e) Homogênea, saturada e ramificada.
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
6
Resolução das questões
1. Metal utilizado na lâmpada incandescente: tungstênio, pois apresenta o maior ponto de fusão
entre os metais da tabela.
Metal utilizado na lâmpada fluorescente: mercúrio, pois é líquido à temperatura ambiente e
apresenta ponto de ebulição inferior ao dos demais metais da tabela, vaporizando-se mais
facilmente.
2. Resposta: alternativa a.
Latão (3): constituído pelos metais cobre e zinco, é formado por ligação metálica.
NaCl (1): constituído por um metal (Na) e um ametal (Cl), é formado por ligação iônica.
N2 (4): constituído por átomos de um mesmo ametal, é formado por ligação covalente apolar.
H2S (2): constituído por hidrogênio e ametal, é formado por ligação covalente.
3. a) Aldeído.
b) Ácido benzoico e etanol, respectivamente.
c)
C — CH2 — OH
// \
HC CH
| ||
HC CH
\\ /
CH
4. a) Clorometano.
b)
CH3
NO2
c) Isomeria de posição, pois varia apenas a posição do grupo nitro nos compostos.
d) Catalisador, isto é, tem a função de acelerar a reação.
5. Resposta: alternativa e.
A reação de produção do biodiesel pode ser assim representada:
triglicerídeo + metanol glicerol + éster
(éster)
(álcool)
A única alternativa incorreta é a e, pois as transformações de combustão são reações
exotérmicas, liberando grande quantidade de energia térmica para o meio em que ocorrem.
6. Resposta: alternativa e.
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
7
O ácido palmítico é um ácido carboxílico de cadeia longa e pouco solúvel em água, pois é
apolar. Na sua fórmula molecular há 32 átomos de hidrogênio.
7. Resposta: alternativa e.
Numa reação química ocorre apenas rearranjo de átomos, com a modificação da sua eletrosfera,
sem haver alteração no número de prótons (número atômico), que se localizam no núcleo dos
átomos.
8. Resposta: alternativa e.
a) Correta; Ka = [produtos]/[reagentes]; como o valor de Ka é muito pequeno, isso significa que
a [reagentes] é muito superior a [produtos].
b) Correta; estão na proporção 1 : 1; portanto, serão formados e consumidos em igual
quantidade.
c) Correta.
d) Correta; com a diminuição do pH, ocorre aumento na [H+]; assim, o equilíbrio desloca-se para
a esquerda.
e) Errada; com a diminuição de CO2, o equilíbrio H2O + CO2
H2CO3 desloca-se para a
esquerda, diminuindo a concentração de H2CO3 e aumentando o consumo de H+, o que faz
com que o pH aumente.
9. Resposta: alternativa c.
1. glicose
( 6 ) Ácido carboxílico e amina.
4. ácido cítrico
( 2 ) Álcool e cetona.
( 4 ) Ácido carboxílico e álcool.
2. frutose
( 5 ) Álcool, amina e fenol.
( 1 ) Álcool e aldeído.
5. adrenalina
3. ácido acetilsalicílico
( 3 ) Ácido carboxílico e éster.
6. alanina
10. Resposta: alternativa a.
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
8
água: até 0 °C é sólida; entre 0 °C e 100 °C é líquida; acima de 100 °C é gasosa; portanto, a 40
°C é líquida.
bromo: até –7 °C é sólido; entre –7 °C e 59 °C é líquido; acima de 59 °C é gasoso; então, a 40
°C é líquido.
fenol: até 41 °C é sólido; entre 41 °C e 182 °C é líquido; acima de 182 °C é gasoso; portanto, a
40 °C é sólido.
pentano: até –130 °C é sólido; entre –130 °C e 36 °C é líquido; acima de 36 °C é gasoso;
então, a 40 °C é gasoso.
11. Resposta: alternativa e.
a) Incorreta; o isopor é menos denso que a água; por isso, flutua.
b) Incorreta; ambos possuem a mesma massa.
c) Incorreta; uma bolinha de ferro afunda na água porque o ferro é mais denso que a água.
d) Incorreta; apenas a de ferro afundará.
e) Correta.
12. Resposta: alternativa d.
Homogênea: só existem átomos de carbono na cadeia. Insaturada: existe dupla ligação na cadeia.
Linear: não apresenta ramificações.
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
9