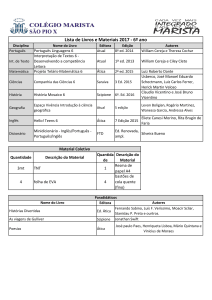
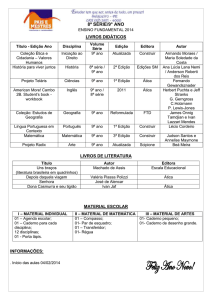
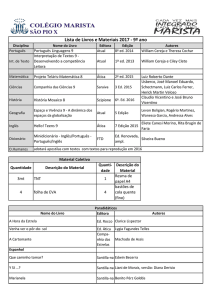
Questões de vestibular
Universidade Federal Rural do Rio de Janeiro – UFRRJ – 2007
1. As soluções de sulfato ferroso (FeSO4) e ácido fosfórico (H3PO4) são utilizadas para combater a
falta de apetite (inapetência), principalmente em crianças.
a) O sulfato ferroso pode ser obtido através de uma reação entre um ácido e uma base (reação de
neutralização). Escreva a equação entre o ácido e a base que origina esse sal.
b) Escreva a fórmula estrutural do ácido fosfórico.
2. O metanol pode ser obtido industrialmente pela reação entre o monóxido de carbono e o
hidrogênio conforme a equação abaixo:
CO(g) + 2 H2(g) CH3OH(g)
A uma certa temperatura, em um recipiente de 2 L, são introduzidos 4,0 mol de monóxido de
carbono e 4,0 mol de hidrogênio. Após um certo tempo, o processo atinge um equilíbrio quando
é formado 1 mol de metanol. Calcule a constante de equilíbrio (Kc) nas condições para a reação
acima.
3. Plano B para a energia, por W. Wayt Gibbs
Para manter este mundo tolerável à vida, a humanidade deve completar uma maratona de
mudanças tecnológicas cuja linha de chegada está bem além do horizonte. Ainda que os planos
de redução das emissões de gás carbônico funcionem, mais cedo ou mais tarde, o mundo vai
precisar de um plano B: uma ou mais tecnologias fundamentalmente novas que, juntas,
consigam fornecer 10 a 30 terawatts sem expelir uma tonelada sequer de dióxido de carbono. Os
reatores a fusão – que produzem energia nuclear juntando átomos, em vez de dividi-los – estão
no topo de quase todas as listas de tecnologias energéticas definitivas para a humanidade. O
reator não produziria gases de estufa e geraria quantidades relativamente baixas de resíduos
radioativos de baixo nível. “Mesmo que a usina fosse arrasada (por acidente ou atentado), o
nível de radiação a 1 km de distância seria tão pequeno que tornaria desnecessária a evacuação”,
diz Farrokh Najmabadi, especialista em fusão que dirige o Centro de Pesquisa de Energia da
Universidade da Califórnia em San Diego.
(Extraída de American Scientific Brasil, n. 53, outubro de 2006.)
A reação de fusão dos isótopos do hidrogênio pode ser representada por:
2
1H
+ 1H3 2He4 + X
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
1
Onde X é:
a) –10.
b) 24.
c) 1p1.
d) 0n1.
e) +1e0.
4. A vitamina C ou ácido ascórbico é uma molécula usada na hidroxilação de várias outras em
reações bioquímicas nas células. A sua principal função é a hidroxilação do colágeno, a proteína
fibrilar que dá resistência aos ossos, dentes, tendões e paredes dos vasos sanguíneos. Além disso,
é um poderoso antioxidante, sendo usado para transformar os radicais livres de oxigênio em
formas inertes. É também usado na síntese de algumas moléculas que servem como hormônios
ou neurotransmissores.
Sua fórmula estrutural está apresentada a seguir:
A partir dessa estrutura, podemos afirmar que as funções e a respectiva quantidade de carbonos
secundários presentes nela estão corretamente representadas na alternativa:
a) álcool, éter e cetona – 5.
b) álcool, cetona e alqueno – 4.
c) enol, álcool e éster – 4.
d) enol, cetona e éter – 5.
e) cetona, alqueno e éster – 5.
5. Algumas substâncias orgânicas diferentes se apresentam com a mesma fórmula molecular. A
esse fenômeno denominamos isomeria. A isomeria pode ser classificada em dois tipos: plana e
espacial. Com respeito a um hormônio secretado pelas glândulas suprarrenais – a adrenalina,
cuja estrutura está representada abaixo –, responda aos questionamentos:
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
2
a) Quantos átomos de hidrogênio existem em 42,25 102 mg de adrenalina?
b) A adrenalina apresenta isomeria espacial? Justifique.
6. Nos dias atuais, a preocupação com o meio ambiente começa a ser uma realidade no meio
empresarial, vide o certificado ISO 14 000 concedido a empresas que são consideradas
“ambientalmente corretas”. O Brasil apresenta uma série de candidatas para receberem esse
certificado; afinal, o país que apresenta uma das mais severas leis ambientais do mundo não
poderia deixar de ser também o pioneiro nessa certificação. Um tópico com o qual o governo
federal terá muito trabalho será quanto à emissão de gases poluentes, tais como o anidrido
sulfúrico e o sulfuroso, que geram, ao reagirem com a umidade do ar, o ácido sulfúrico. As
fórmulas desses dois gases poluentes são, respectivamente:
a) SO2 e SO.
b) SO3 e S2O3.
c) SO2 e S2O3.
d) SO3 e H2SO4.
e) SO3 e SO2.
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
3
Resolução das questões
1. a) Numa reação de neutralização, o sal obtido é formado pelo cátion presente na base e pelo
ânion produzido a partir do ácido. Assim, para obter FeSO4, devemos reagir hidróxido ferroso
ou hidróxido de ferro II – Fe(OH)2 – e ácido sulfúrico – H2SO4. A equação representativa
dessa reação é:
Fe(OH)2 + H2SO4 FeSO4 + 2 H2O
b) Fórmula estrutural do ácido fosfórico:
O
H—O—P—O—H
|
O
|
H
2. Cálculo das quantidades dos participantes, em mol, no equilíbrio:
CO(g) + 2 H2(g) CH3OH(g)
início:
4,0
4,0
0
reação:
1
2
1
equilíbrio:
3
2
1
Cálculo de Kc:
Kc = [CH3OH]/[CO][H2]2 = 0,5/(1,5 12) ≈ 0,33
3. Resposta: alternativa d.
Na equação:
2
1H
+ 1H3 2He4 + aXb
há conservação de carga e massa. Assim:
1+1=2+aa=0
2+3=4+bb=1
Concluímos, então, que X é um nêutron.
4. Resposta: alternativa c.
Os grupos funcionais presentes na fórmula da vitamina C são:
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
4
álcool
éster
enol
Os carbonos secundários são mostrados a seguir. São 4 ao todo:
5. a) Analisando a estrutura apresentada, temos:
fórmula molecular: C8H11NO3
massa molecular: 169 u
Portanto, o número de átomos de hidrogênio existentes em 42,25 102 mg é:
169 103 mg ————— 11 6 1023 átomos de H
42,25 102 mg ————— x
x = 42,25 102 11 6 1023/169 103 = 1,65 1023 átomos de H
b) Sim, por causa da existência de carbono quiral:
HO
OH
*
HO
NHCH3
H
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
5
6. Resposta: alternativa e.
A fórmula do anidrido sulfúrico é obtida retirando-se uma molécula de água do ácido sulfúrico:
H2SO4 (– H2O) SO3
A fórmula do anidrido sulfuroso é obtida retirando-se uma molécula de água do ácido sulfuroso:
H2SO3 (– H2O) SO2
Material complementar ao livro Planeta Química, de Carlos Alberto Ciscato e Luís Fernando Pereira –
Editora Ática, 2008. © Editora Ática. Todos os direitos reservados.
6