Disciplina: Química Inorgânica I, GQI/UFF
Professor: Fabio da Silva Miranda
Lista de exercícios Ácido Bases e solventes não-aquosos
1 – Escreva as equações balanceadas para cada reação abaixo:
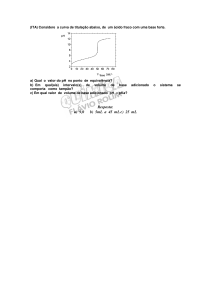
a) MgO + água
b) Hidrólise do ácido bórico
c) Hidrólise do produto da reação: CO2 + água;
d) CaO + SiO2
e) AlCl3 + xH2O → A → B
2 – Comente as equações abaixo e correlacione com a reação A + B: → A:B. Quimicamente o que podemos
dizer a respeito da relação entre a reatividade e as energias do HOMO e do LUMO? Faça uma relação com
processos redoxes:
Δ𝑁 =
𝜒≅
𝜒C − 𝜒B
2(𝜂C − 𝜂B )
𝐼+𝐴
𝜖𝐻𝑂𝑀𝑂 + 𝜖𝐿𝑈𝑀𝑂
=−
2
2
𝜂≅
𝐼 − 𝐴 𝜖𝐻𝑂𝑀𝑂 − 𝜖𝐿𝑈𝑀𝑂
=
2
2
3 – Comente as diferenças de acidez entre os ácidos baseando-se na influência do átomo central.
H2CO3
H2SiO3
H2GeO3
pKa1
6,35
9,9
9,1
pKa2
10,33
11,8
12,3
4 – Conceitual Huheey Cap. 9 e 10 a) Considerando a auto-ionização do solvente identifique o ácido e base
formados em cada caso; b) Monte a estrutura de Lewis para todas as espécies; c) Usando a teoria de repulsão
dos pares eletrônicos preveja a estrutura tridimensional de cada espécie indicando a geometria encontrada;
d) Usando a teoria de grupo encontre o respectivo grupo de ponto ao qual a molécula pertence; e) Usando
a teoria de ligação de valência diga qual hibridização o átomo central está realizando.
Shiriver 4.14 – Para cada par de ácidos diga qual é o mais forte? Justifique.
a) Al OH2
b) Fe OH2
c) Si OH 4
d) HClO3
e) H2 CrO4
f) H3 PO4
ou Ga OH2 6 3+
ou Fe OH2 6 2+
6
ou Ge OH 4
ou HClO4
ou HMnO4
ou
H2 SO4
6
3+
3+
Shiriver 4.15 – Arranje os seguintes óxidos em ordem crescente de acidez:
Al2O3, B2O3, BaO, CO2, Cl2O7, SO3
Shiriver 4.16 – Arranje os seguintes ácidos em ordem crescente de acidez:
HSO−
4,
H3 O+,
H4 SiO4 ,
CH3 GeH3 ,
NH3 ,
HSO3 F
Shiriver 4.17 – Os íons Na+ e Ag+ têm raios semelhantes. Qual dos íons aquo é o ácido mais forte?
Explique.
Shiriver 4.18 – Quais dos seguintes elementos formam óxidos polianiônicos e quais formam óxidos
policatiônicos: Al, As, Cu, Mo, Si, B, Ti.
Shiriver 4.19 – Quando um par de cátions aquo formam uma ponte M–O–M com a eliminação de água, qual
é a regra geral para a mudança de carga do metal M por íon?
Shiriver 4.20 – Balancei as seguintes reações:
𝐏𝐎𝟑−
𝟒
[𝐅𝐞 𝐎𝐇𝟐
𝟑+
𝟔
→
→
𝐏𝟐 𝐎𝟒−
𝟕
[ 𝐇𝟐 𝐎 𝟒 𝐅𝐞 𝐎𝐇 𝟐 𝐅𝐞 𝐎𝐇𝟐 𝟒 ] 𝟒+
Shiriver 4.25 – Nos processos abaixo identifique a espécie ácida e básica, caracterize os processos como
formação de complexo ou reação ácido base. Identifique os ácidos de BrØnsted ou Lewis.
a) 𝐒𝐎𝟑 +
𝐇𝟐 𝐎
b) 𝐂𝐇𝟑 𝐁𝟏𝟐
+
𝐇𝐒𝐎−
𝟒
→
𝐇𝐠 𝟐+
c) 𝐊𝐂𝐥 +
𝐒𝐧𝐂𝐥𝟐
d) 𝐀𝐬𝐅𝟑 𝐠
+
→
𝐊+
→
𝐒𝐛𝐅𝟓 𝐥
+
𝐁𝟏𝟐
𝐇+
+
𝐂𝐇𝟑 𝐇𝐠 +; 𝐁𝟏𝟐 representa a vitamina B12
+
[𝐒𝐧𝐂𝐥𝟑 ]−
+
[𝐀𝐬𝐅𝟐 ]+[𝐒𝐛𝐅𝟔 ]− (𝐬)
→
Shiriver 4.26 – Para cada caso selecione o composto com a característica requerida:
Ácido de Lewis mais forte
a) BF3
BCl3
BBr3
b) BeCl2
BCl3
c) B(n-Bu)3
B(t-Bu)3
Base de Lewis mais favorável para se ligar ao B(CH3)3
a) Me3N
Et3N
b) 2-CH3C5H4N
4- CH3C5H4N
Shiriver 4.27 – Usando o conceito de ácido duro-mole, diga quais reações são esperadas ter uma constante
de equilíbrio maior que 1.
a) 𝐑 𝟑 𝐏𝐁𝐁𝐫𝟑
+
b) 𝐒𝐎𝟐
(𝐂𝟔 𝐇𝟓 )𝟑 𝐏: 𝐇𝐎𝐂(𝐂𝐇𝟑 )𝟑
+
c) 𝐂𝐇𝟑 𝐇𝐠𝐈
d) 𝐀𝐠𝐂𝐥𝟐
−
+
𝐚𝐪
𝐑 𝟑 𝐍𝐁𝐅𝟑
𝐇𝐂𝐥
+
⇌
⇌
𝟐𝐂𝐍 − 𝐚𝐪
𝐑 𝟑 𝐏𝐁𝐅𝟑
⇌
𝐂𝐇𝟑 𝐇𝐠𝐂𝐥
⇌
+
𝐑 𝟑 𝐍𝐁𝐁𝐫𝟑
(𝐂𝟔 𝐇𝟓 )𝟑 𝐏 𝐒𝐎𝟐
+
+
𝐇𝐎𝐂(𝐂𝐇𝟑 )𝟑
𝐇𝐈
𝐀𝐠𝐂𝐍𝟐
−
𝐚𝐪
+
𝟐𝐂𝐥− 𝐚𝐪
Shiriver 4.31 – Mostre a(s) equação(ões) para a dissolução de SiO2 em HF:
Shiriver 4.32 – O sulfeto de alumínio (Al2S3) libera odor característico de ácido sulfídrico quando se torna
velho. Escreva a equação balanceada para a reação e discuta em termos de conceitos ácido base.
Shiriver 4.33 – Descreva as propriedades de um solvente que resultariam em:
a) favorecimento da troca de Cl- por I- em um centro ácido
b) favorecer a basicidade do R3As sobre o R3N
c) favorecer a acidez do Ag+ sobre o Al3+
d) promover a reação 𝟐 𝐅𝐞𝐂𝐥𝟑 +
𝐙𝐧𝐂𝐥𝟑
→
𝐙𝐧𝟐+
+
𝟐 𝐅𝐞𝐂𝐥𝟒
−
Obs: Para caso sugira um solvente.
Shiriver 4.35 – Use os conceitos ácido-base para comentar o fato que o único minério de mercúrio
importante seja o Cinabre (HgS), enquanto o zinco ocorre naturalmente na forma de sulfetos, silicatos,
carbonatos e óxidos.
Shiriver 4.38 – Os elementos do bloco-f são encontrados em silicatos na forma M(III). Discuta a dureza
desses elementos.
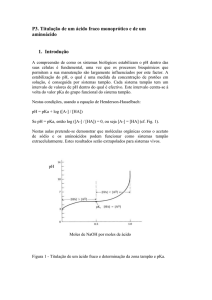
Problema 4.5 – A frequência do estiramento simétrico da vibração M–O de complexos aquo, [M(OH2)6]2+,
aumenta ao longo da série: Ca2+ < Mn2+ < Ni2+. Como essa tendência pode está relacionada com a acidez?
Problema 4.11 – Piridina forma complexos ácido-base de Lewis com mais forte com SO3 do que com SO2.
No entanto, a piridina forma complexos mais fracos com SF6 do que com SF4. Explique:
Problema 4.12 – Faça a previsão do sentido favorável para cada reação:
𝐂𝐝𝐈𝟐 +
𝐂𝐮𝐈𝟒
𝟐−
⇌
𝐂𝐮𝐂𝐥𝟒 − (aq)
(aq) +
𝐍𝐇𝟐−(aq)
𝐂𝐚𝐅𝟐
+
𝐇𝟐 𝐎(l)
⇌
⇌
𝐂𝐝𝐅𝟐
+
𝐂𝐮𝐂𝐥𝟒
𝟐−
𝐍𝐇𝟑 (aq)
𝐂𝐚𝐈𝟐
𝐂𝐮𝐈𝟒 −(aq)
(aq) +
𝐎𝐇 −(aq)
+
Shiriver self-test 4.6 – Coloque em ordem crescente de acidez os seguintes íons:
[Na(OH2)6 ]+, [Sc(OH2)6]3+, [Mn(OH2)6]2+ e [Ni(OH2)6]2+
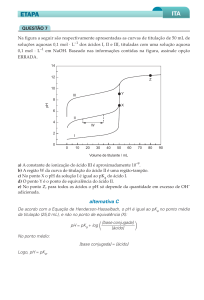
Shiriver 5.6 – Balancei a equação redox abaixo em meio ácido:
MnO−
4 aq
+
H2 SO3
→
Mn2+ aq
+
HSO−
4
Faça uma previsão qualitativa para dependência do potencial total da reação com a variação de pH .
(aumenta, diminui ou permanece inalterado).
Shiriver 5.17 – Calcule o potencial de redução a 25ºC para a conversão de MnO−
4 a MnO2 em solução
−
−
o
aquosa em pH = 9,0 e 1M de MnO4 (aq). Dado: 𝐸 MnO4 , MnO2 = +1,69 V
Shiriver problema 5.5 – Discuta a importância do potencial de redução em química inorgânica, destaque as
suas aplicações na investigação da estabilidade, solubilidade e reatividade em água.
Shiriver Problema 5.7– Discuta como o equilíbrio Cu2+ aq + Cu s
⇌ 2 Cu+(aq) pode se alterado
pela complexação de íons cloretos (referência de apoio: Malyyszko, J.; Kaczor, M. J. Chem. Educ., 2003, 80,
1048).
Huheey 9.3 – Qual é o melhor ácido de Lewis BCl3 ou B(CH3)3? Explique.
Huheey 9.4 – A ordem de acidez para os haletos de boro é a seguinte BF3 < BCl3 < BBr3. Essa ordem é
inesperada? Explique.
Huheey 9.7 – Aponte o sentido favorável das reações abaixo:
Huheey 9.13 – Encontre ou faça uma estimativa dos ácidos fosfórico e arsênico. Diga qual é o ácido mais
forte e explique.
Huheey 9.14 – O ácido fosforoso pode existir na forma de seus dois tautômeros (esquema abaixo). a)
Sabendo que o pKa do ácido fosforoso é 1,8 diga qual é a estrutura mais estável em solução aquosa. b) O
pKa do ácido hipofosforoso é 2,0. Faça a previsão da estrutura mais provável.
Huheey 9.16 – As discussões a respeito da basicidade das amidas (pg 334 e 342) são baseadas no oxigênio
carbonílico como sítio básico. Existe alguma possibilidade do nitrogênio da amida atuar como sítio básico?
Que experimento poderia ser utilizado para determinar qual átomo é sítio ácido?
Huheey 9.19 – Complete e balancei as seguintes reações:
Huheey 9.21 – Potássio metálico reage com grafite formando o composto de intercação de fórmula C8K.
Este material atuará como catalisador ácido ou básico?
Huheey 9.29 – O dioxigênio não é um bom ligante e é mole. A hemoglobina contém o íon Fe2+ que tem
moleza intermediária.
a) Desenhe a estrutura do grupo HEME e sugira uma explicação para o Fe2+ ser um sítio mais mole dentro
do grupo HEME.
b) O monóxido de carbono é venenoso porque tende a se ligar mais fortemente a hemoglobina das células
vermelhas do que o oxigênio. Por qual motivo o CO compete como ligante com o oxigênio?
Huheey 10.3 – Quando 1 mol de N2O5 é dissolvido em ácido sulfúrico 3 equivalentes de base são
produzidos. Estudos condutimétricos indicam = 6 para N2O5. Proponha uma equação para a sovólise do
N2O5 pelo ácido sulfúrico.
Huheey 10.10 – Considere cada solvente individualmente:
NH3
CH3CO2H
H2SO4
a) Mostre as equações de auto-solvólise do solvente puro.
b) Discuta os equilíbrios do ácido acético com a amônia e o ácido sulfúrico. Qual solução seria mais ácida ou
básica do que o solvente puro? O soluto atuaria como um ácido ou base? Forte ou fraco?
Huheey 10.11 – Assuma hipoteticamente que a auto-sovólise do POCl3 = 5 x 10-14 mol2 L-2 (Produto
iônico). Monte uma escala pCl para o POCl3. Faça um diagrama semelhante a Fig. 10.1. Discuta como você
obteria os dados.
Referência Huheey Cap. 10 – Dê os produtos das reações abaixo. a) Monte a estrutura de Lewis para os
produtos; b) Usando a teoria de repulsão dos pares eletrônicos preveja a estrutura tridimensional de cada
espécie indicando a geometria encontrada; c) Usando a teoria de grupo encontre o respectivo grupo de
ponto ao qual a molécula pertence; d) Usando a teoria de ligação de valência diga qual hibridização o
átomo central está realizando.
Referência Huheey Cap. 10 – Dê os produtos das reações abaixo. a) Monte a estrutura de Lewis para os
produtos; b) Usando a teoria de repulsão dos pares eletrônicos preveja a estrutura tridimensional de cada
espécie indicando a geometria encontrada; c) Usando a teoria de grupo encontre o respectivo grupo de
ponto ao qual a molécula pertence; d) Usando a teoria de ligação de valência diga qual hibridização o
átomo central está realizando.
Referência Huheey Cap. 10 – Dê os produtos das reações abaixo. a) Monte a estrutura de Lewis para os
produtos; b) Usando a teoria de repulsão dos pares eletrônicos preveja a estrutura tridimensional de cada
espécie indicando a geometria encontrada; c) Usando a teoria de grupo encontre o respectivo grupo de
ponto ao qual a molécula pertence; d) Usando a teoria de ligação de valência diga qual hibridização o
átomo central está realizando.
Referência Huheey Cap. 15 – Dê os produtos das reações abaixo. a) Monte a estrutura de Lewis para os
produtos; b) Usando a teoria de repulsão dos pares eletrônicos preveja a estrutura tridimensional de cada
espécie indicando a geometria encontrada; c) Usando a teoria de grupo encontre o respectivo grupo de
ponto ao qual a molécula pertence; d) Usando a teoria de ligação de valência diga qual hibridização o
átomo central está realizando.
Referência Huheey Cap. 10 – Explique as diferenças de solubilidade.
8 - Que frase descreve, corretamente um ácido com pKa = 5?
a)
b)
c)
d)
e)
Um ácido fraco
Um ácido muito fraco
O ácido é uma base forte
O ácido não significantemente ácido ou básico
Nenhuma das alternativas
9 - Quais das seguintes afirmações se aplicam a uma base forte? Selecione todas que se aplicam:
a)
b)
c)
d)
e)
É a base conjugada de um ácido fraco
É o ácido conjugado de uma base fraca
Possui um valor muito negativo de pKb
Gera OH- quando dissolvido em água
Nenhuma das alternativas
10 - Uma solução aquosa de um ácido HA com pKa = 0 é misturada com uma solução de concentração
similar de um segundo ácido HB cujo pKa = 5. Selecione a descrição correta para explicar essa mistura.
a)
b)
c)
d)
e)
A mistura contém quantidades iguais de A− e B−.
A mistura contém uma quantidade muito maior de B− do que A−.
A mistura contém uma quantidade muito maior de A− do que B−
A mistura contém poucos íons
Nenhuma das alternativas
11 - Qual afirmação descreve corretamente a variação da carga nuclear efetiva (Zeff) na tabela periódica?
a)
b)
c)
d)
e)
Zeff aumenta através do período e descendo no grupo
Zeff aumenta através do período e diminui descendo no grupo
Zeff permanece constante através do período e aumenta descendo no grupo
Zeff diminui descendo no grupo
Nenhuma das alternativas
12 - Quais das seguintes declarações descrevem corretamente o efeito relativístico sobre a energia dos
orbitais? Selecione todas que se aplicam.
a) Efeitos relativísticos somente são significantes para átomos do 6º período em diante.
b) Efeitos relativísticos são mais significantes para os elétrons 6s do que para 6p.
c) Efeitos relativísticos fazem com que os elétrons no orbital 6s do Au estejam em menor energia do
que 5s da Ag.
d) Efeitos relativísticos são significantes somente para elementos radioativos.
13 - Quais das seguintes afirmações são corretas com respeito a soluções tampões?
a) Uma solução tampão pode consistir de um ácido fraco e seu sal
b) Uma solução tampão é resistente a adição de pequenas quantidades de ácido
c) Uma solução tampão pode consistir de uma base fraca e seu sal
d) Uma solução tampão é resistente a adição de pequenas quantidades de base
e) Nenhuma das alternativas
8 - Que frase descreve, corretamente um ácido com pKa = 5?
f)
g)
h)
i)
j)
Um ácido fraco
Um ácido muito fraco
O ácido é uma base forte
O ácido não significantemente ácido ou básico
Nenhuma das alternativas
9 - Quais das seguintes afirmações se aplicam a uma base forte? Selecione todas que se aplicam:
f)
g)
h)
i)
j)
É a base conjugada de um ácido fraco
É o ácido conjugado de uma base fraca
Possui um valor muito negativo de pKb
Gera OH- quando dissolvido em água
Nenhuma das alternativas
10 - Uma solução aquosa de um ácido HA com pKa = 0 é misturada com uma solução de concentração
similar de um segundo ácido HB cujo pKa = 5. Selecione a descrição correta para explicar essa mistura.
f)
g)
h)
i)
j)
A mistura contém quantidades iguais de A− e B−.
A mistura contém uma quantidade muito maior de B− do que A−.
A mistura contém uma quantidade muito maior de A− do que B−
A mistura contém poucos íons
Nenhuma das alternativas
11 - Qual afirmação descreve corretamente a variação da carga nuclear efetiva (Zeff) na tabela periódicva?
f)
g)
h)
i)
j)
Zeff aumenta através do período e descendo no grupo
Zeff aumenta através do período e diminui descendo no grupo
Zeff permanece constante através do período e aumenta descendo no grupo
Zeff diminui descendo no grupo
Nenhuma das alternativas
12 - Quais das seguintes declarações descrevem corretamente o efeito relativístico sobre a energia dos
orbitais? Selecione todas que se aplicam.
e) Efeitos relativísticos somente são significantes para átomos do 6º período em diante.
f) Efeitos relativísticos são mais significantes para os elétrons 6s do que para 6p.
g) Efeitos relativísticos fazem com que os elétrons no orbital 6s do Au estejam em menor energia do
que 5s da Ag.
h) Efeitos relativísticos são significantes somente para elementos radioativos.
13 - Quais das seguintes afirmações são corretas com respeito a soluções tampões?
f)
g)
h)
i)
j)
Uma solução tampão pode consistir de um ácido fraco e seu sal
Uma solução tampão é resistente a adição de pequenas quantidades de ácido
Uma solução tampão pode consistir de uma base fraca e seu sal
Uma solução tampão é resistente a adição de pequenas quantidades de base
Nenhuma das alternativas