• QUEM SOMOS NÓS?
• DO QUE SOMOS CONSTITUÍDOS?
• PORQUE SOMOS CONSTITUÍDOS ASSIM?
A EXPLICAÇÃO ANTIGA: DEUSES e DEUSAS
Greco-Romana
• ZEUS (JÚPITER): Rei dos Deuses
• AFRODITE (VÊNUS): Deusa do Amor
• DIONÍSIO (BACO): Deus do Vinho
• NETUNO (POSEIDON): Deus das Águas
• ARES (MARTE): Deus da Guerra
GRÉCIA, 500 A.C.: FILÓLOFOS DA NATUREZA
TERRA, ÁGUA, AR e FOGO constituíam tudo o que
há na natureza
DEMÓCRITO e LEUCIPO:
propõem que a matéria é
composta por ÁTOMOS, que
seriam aproximadamente 100
diferentes partículas indivisíveis.
IDADE MÉDIA
Filosofia se distancia do estudo
da matéria e passa a se
aprofundar na compreensão do
homem e da vida em sociedade.
ALQUIMISTAS
1661
Robert Boyle
1525
Theophrastus Bombastus
Paracelsus von Hohenheim
(médico e cientista Suíço)
Século XVIII
SÉCULOS XVIII, XIX, XX: TEORIAS ATÔMICAS
John Dalton
(1776-1844)
SÉCULOS XVIII, XIX, XX: TEORIAS ATÔMICAS
J. J. Thomson
(1897)
SÉCULOS XVIII, XIX, XX: TEORIAS ATÔMICAS
Ernest Rutherford
(1908)
SÉCULOS XVIII, XIX, XX: TEORIAS ATÔMICAS
Ernest Rutherford
(1908)
Problemas do modelo proposto:
1) uma carga negativa, colocada em movimento ao redor de uma carga positiva
parada, adquire movimento espiralado em direção à carga positiva acabando por
colidir com ela;
2) uma carga em movimento perde energia constantemente, emitindo radiação.
Porém, sabe-se que o átomo em seu estado normal não emite radiação.
SÉCULOS XVIII, XIX, XX: TEORIAS ATÔMICAS
Niels Bohr
(1913)
Propôs que os elétrons circulavam em órbitas com energias definidas e que um
elétron num átomo pode adquirir apenas certas energias.
- Quanto maior a energia do elétron, mais afastado ele está do núcleo.
Um elétron só pode estar em movimento ao redor do núcleo se estiver em órbitas
específicas, definidas, e não se encontra em movimento ao redor do núcleo
em quaisquer órbitas.
O surgimento da MECÂNICA QUÂNTICA
Efeito Fotoelétrico:
Se a LUZ não é MATÉRIA, como pode
deslocar a matéria (no caso o
elétron)?
Plank propôs que a radiação
eletromagnética era constituída
de partículas, que foram
chamados de fótons.
Plank propôs que a radiação
eletromagnética era constituída
de partículas, que foram
chamados de fótons.
Mas experimentos como a difração
nos levam a vê-la como ondas.
DUALIDADE ONDA-PARTÍCULA
Erwin Shrödinger
na Caixa
Energia
Um elétron ao redor do núcleo pode ser interpretado como uma Partícula
Energia
potencial
Função matemática das
do elétron
coordenadas de posição
Energia total no núcleo
L
Uma partícula em um recipiente não pode
ter energia igual a zero, ou seja, não pode
estar parada quando confinada a um
determinado volume.
Quatro números quânticos: são fornecidos pela resolução da equação de Schrödinger
No quântico principal: CAMADA (n = 1, 2, 3, 4...)
No quântico momento angular orbital: SUBCAMADA (l = 0, 1, 2, 3... = s p d f ...)
No quântico magnético (m = -l, 0, +l)
No quântico magnético de spin (ms = +1/2, -1/2)
Todo elétron pode ser descrito por quatro números quânticos
Cada elétron em um átomo tem um único conjunto de quatro números quânticos
= Princípio de exclusão de Pauli
Orbital s
Orbital p
Orbital d
Orbital f
Então, como se dá o preenchimento para que se
tenha a configuração de mais baixa energia?
Diagrama de Linus Pauling
E porque os orbitais tem energia diferentes dentro de
uma mesma camada?
Repulsões inter-eletrônicas!
Forças de atração pelo núcleo e repulsão
elétron-elétron
• Em 2002, haviam 115 elementos conhecidos.
• A maior parte dos elementos foi descoberta entre 1735 e 1843.
• Como organizar 115 elementos diferentes de forma que possamos
fazer previsões sobre elementos não descobertos?
• Ordenar os elementos de modo que reflita as tendências nas
propriedades químicas e físicas.
• A primeira tentativa (Mendeleev - 1869) ordenou os elementos
em ordem crescente de massa atômica.
• Faltaram alguns elementos nesse esquema.
Ex.: em 1871, Mendeleev observou que a posição mais
adequada para o As seria abaixo do P, e não do Si, o que deixou
um elemento faltando abaixo do Si. Ele previu um número de
propriedades para este elemento. Em 1886 o Ge foi
descoberto. As propriedades do Ge se equiparam bem à
previsão de Mendeleev.
• QUEM SOMOS NÓS?
• DO
QUE SOMOS CONSTITUÍDOS? R: ÁTOMOS
• PORQUE SOMOS CONSTITUÍDOS ASSIM?
CORPO HUMANO
(número total de átomos)
Hidrogênio = 62,8%
Oxigênio = 25,4%
Carbono = 9,4%
Nitrogênio = 1,4%
Na, Ca, K, Mg, P, S, Cl = 0,9%
Outros = 0,1%
• QUEM SOMOS NÓS?
• DO QUE SOMOS CONSTITUÍDOS? R: ÁTOMOS
• PORQUE
SOMOS CONSTITUÍDOS ASSIM?
DEPENDE DO
AMBIENTE EM QUE SOMOS FORMADOS!!!
ÁGUA
A composição dos organismos vivos
está associada com os limites
disponíveis nos ambientes em que são
formados.
Como geralmente é a água, a
composição é determinada pelo
emprego de elementos mais solúveis e
mais estáveis neste solvente.
Abundância dos Elementos no Universo
Abundância dos Elementos no Universo
• Elementos essenciais para a vida
estão entre os mais abundantes no
• Abundância
- Na, Mg, K, Ca
- Si, Al, Fe, Ni, Cr, Ar, Ne, F
universo.
Porque a escolha de uns e não de
outros?
Cátions mais estáveis em água!
Origem da VIDA no MAR:
Concentração dos elementos na água do mar.
E os metais (atmosfera oxigenada)
Funções: Metais
- Não são empregados em grande quantidade se não forem solúveis e estáveis em
meio aquoso. Quando utilizados, são bastante empregados em equilíbrios iônicos
(mobilidade) e o Ca2+ em estruturas rígidas.
Ex.: ossos
Composto iônico de
estrutura rígida e
insolúvel!!!
RAIO ATÔMICO
• O raio atômico de um elemento é
definido como sendo a metade da
distância entre os núcleos de átomos
vizinhos.
“Não é possível medir o raio exato de um átomo”
Tendências nos tamanhos dos íons
•O tamanho do íon é a distância entre os íons
em um composto iônico.
•O tamanho do íon também depende da carga nuclear,
do número de elétrons e dos orbitais que contenham os elétrons de
valência.
•Os cátions deixam vago o orbital mais volumoso e são menores do que
os átomos que lhes dão origem.
Ex.: 20Ca = 1s2, 2s2, 2p6, 3s2, 3p6, 4s2
56Fe
= 1s2, 2s2, 2p6, 3s2, 3p6, 3d6, 4s2
•Os ânions adicionam elétrons ao orbital mais volumoso e são maiores do
que os átomos que lhe dão origem.
Ex.:
9F
= 1s2, 2s2, 2p5
8O
= 1s2, 2s2, 2p4
Comparação entre o tamanho dos íons e seus
átomos neutros
ENERGIA DE IONIZAÇÃO
Energia necessária para remover um elétron de um átomo na fase gasosa
ENERGIA DE IONIZAÇÃO
G.E. Rodgers, J. Chem. Educ. 2014, 91, 216-224.
G.E. Rodgers, J. Chem. Educ. 2014, 91, 216-224.
G.E. Rodgers, J. Chem. Educ. 2014, 91, 216-224.
G.E. Rodgers, J. Chem. Educ. 2014, 91, 216-224.
G.E. Rodgers, J. Chem. Educ. 2014, 91, 216-224.
Metais:
- Os organismos não podem então usar suas propriedades de condução de
eletricidade para a transferência de informações entre os órgãos.
Como fazer?
Metais aparecem envolvidos em processos redox quando estão
associados a moléculas orgânicas.
Funções: Não - Metais
F, Cl, Br, I, S :
- se apresentam como ânions em balanço com cargas positivas dos cátions.
H, C, O, S, N e P
- apresentam funções estruturais como na formação do DNA e de membranas.
Na pele existem termorreceptores, mecanorreceptores e receptores da dor.
Limitantes: Temperatura
Processos devem ser compatíveis com a temperatura dos organismos
Alguns organismos precisam produzir NH3 a partir do N2. Industrialmente, este
processo exige altas temperaturas e alta pressão.
N2
+
3 H2
2NH3
Organismos possuem catalisadores de grande eficiência, originados de milhões de
anos de evolução e adaptação ao ambiente.
Limitantes: Processos REDOX
E0 = E0 (reduzido) – E0 (oxidado)
2 H2O (l) 2 H2 (g) + O2 (g)
E0 = - 0,83 - 0,40 = - 1,23 V não espontânea
Zn (s) + H3O+ (aq) Zn2+ (aq) + H2 (g) + 2H2O (l)
Eo = 0 - (- 0,76) = + 0,76 espontânea
2 Na (s) + H2O (l) 2 Na+ (aq) + H2 (g) + 2 OH- (aq)
Eo = -0,42 - (- 2,71) = + 2,29 espontânea
• QUEM SOMOS NÓS?
• DO QUE SOMOS CONSTITUÍDOS?
• PORQUE SOMOS CONSTITUÍDOS ASSIM?
COMO PODEMOS USAR O QUE
A NATUREZA CRIOU P/ NOSSO
BENEFÍCIO ?
Aplicações Industriais
Alimentação Infantil
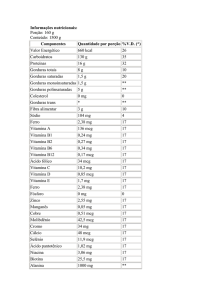
Lactose, concentrado protéico de soro de leite*, oleína de palma, leite desnatado, óleo de
canola, óleo de palmiste, óleo de milho, sais minerais (citrato de cálcio, cloreto de potássio,
cloreto de magnésio, citrato de sódio, sulfato ferroso, sulfato de zinco, sulfato de cobre,
iodeto de potássio, sulfato de manganês, selenato de sódio), vitaminas (vitamina C, niacina,
vitamina E, pantotenato de cálcio, vitamina A, vitamina B6, vitamina B1, vitamina D, vitamina
B2, ácido fólico, vitamina K, biotina), óleo de peixe**, lecitina de soja, ácido graxo
araquidônico, L-arginina, L-carnitina, nucleotídeos, taurina bitartarato de colina, inositol, Lhistidina. Não Contém Glúten.
*fonte protéica
**óleo de peixe é fonte de ácido docosahexaenóico (DHA)
Aplicações Industriais
Reposição de Vitaminas Essenciais
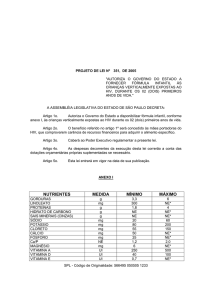
Cada comprimido revestido contêm:
Acetato de retinol e betacaroteno (vit. A) 5.000 UI;
Acetato de dl-alfa-tocoferila; (vit. E) 30 UI;
Ácido ascórbico (vit. C) 60 mg;
Ácido pantotênico (como pantotenato de cálcio) 10 mg;
Ácido fólico 400 mcg; Biotina 30 mg; Cálcio (como fosfato de cálcio dibásico) 162 mg; Cianocobalamina
(vit. B12) 6 mcg; Cloridrato de piridoxina (vit.B6) 2 mg; Cloro (como cloreto de potássio) 36,3 mg; Cobre
(como óxido cúprico) 2 mg; Colecalciferol (Vit. D3) 400 UI; Cromo (como cloreto de cromo) 25 mcg;
Estanho (como cloreto estanhoso) 10 mcg; Ferro (como fumarato ferroso) 18 mg; Fitonadiona (vit. K1)
25 mcg; Fósforo (como fosfato de cálcio dibásico 125 mg; Iodo (como iodeto de potássio) 150 mcg;
Magnésio (como óxido de magnésio) 100 mg; Manganês (como sulfato e manganês) 2,5 mg;
Molibdênio (como molibdato de sódio) 25 mcg; Mononitrato de tiamina (vit. B1) 1,5 mg; Nicotinamida
20 mg; Níquel (como sulfato niqueloso) 5 mcg; Potássio (como cloreto de potássio) 40 mg; Riboflavina
(vit. B2) 1,7 mg; Selênio (como selenato de sódio) 25 mcg; Silício (como metassilicato de sódio) 10 mcg;
Vanádio (como metavenadato da sódio) 10 mcg; Zinco (como óxido de zinco) 15 mg.
Aplicações Industriais
Cremes Dentais
Esmalte dos dentes é formado pela hidroxiapatita. O estrago nos dentes é
causado pelo ataque dos ácidos formados na digestão dos alimentos por
bactérias.
Ca5(PO4)3OH (s) + 4 H3O+ (aq) 5 Ca2+ (aq) + 3HPO42-(aq) + 5 H2O (l)
Tratamento com Flúor forma uma cobertura mais resistente ao ataque:
Ca5(PO4)3OH (s) + F- (aq) Ca5(PO4)3F (s) + OH-(aq)
Pesquisas
Pesquisas
Bibliografia
•
Atkins, P., Jones, L., Princípios de Química - Questionando a Vida Moderna e o Meio
Ambiente, 3 ed., Porto Alegre: Bookman, 2006.
•
Shriver, D. F., Atkins, P., Química Inorgânica, Ed Artmed, 2003 .
•
Lee, J. D., Química Inorgânica Não Tão Concisa. Edgard Blucher Ltda, 3a ed., São
Paulo, 1980
•
Brent, R., The Golden book of Chemistry Experiments, Golden Press, New
York,1960